胃肠间质瘤的CT和内镜表现分析
2011-11-28肖健宇
何 刚 肖健宇
胃肠间质瘤(gastrointestinal stromal tumor,GIST)是消化道最常见的间叶组织源性肿瘤,是一种独立来源于胃肠道原始间叶组织的非定向化肿瘤,部分伴有平滑肌和(或)神经鞘的不完全分化,过去多诊断为平滑肌瘤或平滑肌母细胞瘤,但免疫组化显示GIST可能源自中胚层的卡哈尔间质细胞[1-2]。因其缺乏特异性的临床症状,发病率较高,本文通过对146例GIST的内镜、超声胃镜及CT影像资料进行分析,旨在探讨其在GIST诊断中的价值。
1 资料与方法
1.1 一般资料 收集我院2005年1月—2009年6月经内镜活检及手术病理证实为GIST的患者146例,男75例,女71例,年龄33~84岁,平均(58.5±24.9)岁;病变位于胃93例,空肠20例,十二指肠15例,回肠10例,直肠5例,横结肠3例。
1.2 方法
1.2.1 CT检查 采用GE Hispeed NX/I双层螺旋CT,以7 mm或10 mm层厚扫描,包括常规平扫和增强扫描,增强扫描使用欧乃派造影剂。检查前禁食4~6 h,扫描前30 min口服2%泛影葡胺或水500~800 mL,仰卧位扫描,扫描范围包括上腹部、中腹部或全腹扫描。
1.2.2 胃镜及超声胃镜检查 采用Olympus GIF260胃镜和PENTEX OF-B141超声胃镜检查仪。术前禁食禁水6 h以上,吸烟患者检查当天禁烟。胃镜麻醉方法有2种:咽喉部局部麻醉和静脉麻醉。咽喉部局麻,于检查前10~15 min口服2%利多卡因。患者耐受力较差,可采取静脉麻醉法:术前需禁食8 h,禁饮4 h,鼻导管吸氧(1~2 L/min)。在监测血压、心率平稳情况下,静脉注射瑞芬太尼(0.5 μg/kg)及丙泊酚(2 mg/kg)麻醉,镇静程度以Ramasay 4级为度。
1.2.3 结肠镜检查 患者检查前一天半流质饮食,当天早餐禁食。前一晚常规给予口服甘露醇或复方聚乙二醇清洁肠道,所有患者肠道清洁良好行Olympus CF-H260AI电子肠镜检查,并行黏膜活检病理检查。
2 结果
2.1 CT检查结果 本组146例GIST中有126例行CT检查,其中胃内70例,见图1,小肠18例,结肠4例;未确诊34例,确诊率73.0%(92/126)。GIST的CT影像表现为胃肠外的肿块或肠壁明显增厚,肿块大小及密度不均匀,直径1~6 cm。依据GIST的分化程度不同,其特征性的改变也有不同,良性GIST密度均匀,坏死组织较少,分叶不明显;恶性分叶明显,肿块都较大,呈不均匀强化表现。

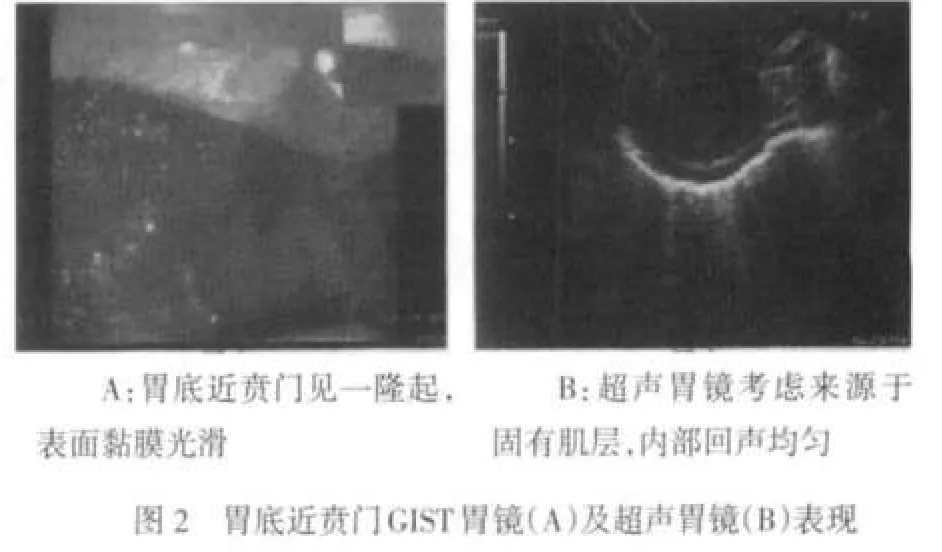
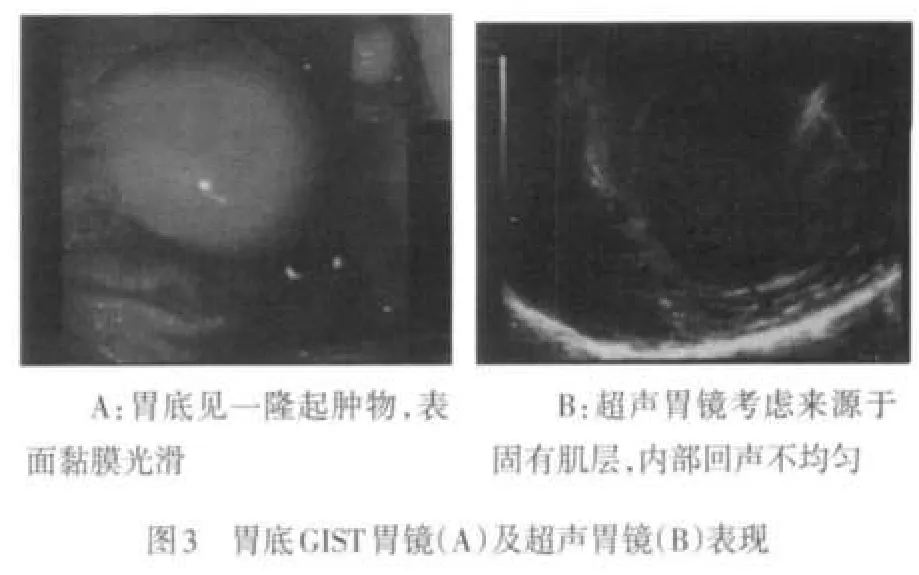
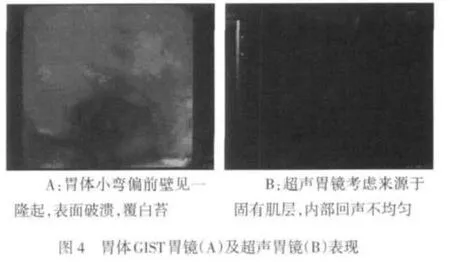
2.2 内镜检查 本组有93例进行胃镜检查发现肿瘤,其中病变累及胃底70例,胃体8例,胃窦13例,贲门2例,见图2~4。经胃镜活检病理诊断为GIST 35例,确诊率37.6%(35/93)。结肠镜检查8例,确诊率37.5%(3/8)。本组胃肠间质瘤内镜下多为半球形、椭圆形、分叶状及不规则形。顶部可见凹陷型溃疡42例,肿瘤底部见桥形皱襞68例;大多数黏膜光滑,色泽正常,部分伴有糜烂。间质瘤并发出血35例,肿瘤大小直径约1~6 cm,平均3.25 cm,直径<3 cm者26例,≥3 cm者67例,见图2~4。
2.3 超声胃镜检查 本组有66例进行超声胃镜检查,确诊率为100%(66/66)。隆起病灶多为圆形、椭圆形、梭形及不规则形,起源于黏膜肌层23例,声像图为均匀分布的低回声光团,层次清晰;起源于固有肌层43例。66例中表现为均匀的低回声团块52例;内部回声不均匀,见点状偏强回声,高回声14例,其中内部回声不均匀,见片状无回声区,囊性变12例,见图2~4。
2.4 术后病理和免疫组织化学法检查 GIST大体病理表现:肿瘤境界清楚,切面灰白,部分可见出血,坏死囊性变等继发性改变。镜下:梭形细胞型12例,上皮细胞型40例,梭形与上皮细胞混合型94例。病理分为良性20例,交界性66例,恶性60例。146例全部行免疫组化检查:CD34阳性70例,见图5;CD117 阳性86例,见图6;CD34和CD117共同阳性53例;VEGF阳性28例。


3 讨论
GIST是消化道最常见的间叶组织源性肿瘤,由于组织分型不同,有着多种不同的组织学和形态学表现。GIST主要发生在胃和小肠,其中胃间质瘤占50%~60%[3],本组中胃间质瘤占63.7%,与报道基本相符。GIST的影像诊断特别是CT在判断病灶的定位、大小、转移及其并发症方面有重要价值,但在判断良恶性程度上有一定局限性。周志刚等[4]认为肿块同时向腔内外生长者的恶性程度高,其次是腔外生长的肿瘤,而腔内生长的以良性居多,若形态不规则、合并钙化、不均匀化、间隔状强化者多为恶性,与本研究情况基本一致。常规内镜下的GIST具有黏膜下肿瘤的特点,呈半球状隆起,可形成桥形皱襞,形态上较难与平滑肌瘤、平滑肌肉瘤及神经纤维瘤区别[5]。超声胃镜对于起源于胃固有肌层或黏膜肌层间质瘤的诊断有着不可替代的优势,其可以清晰显示消化管壁的5层结构,在超声胃镜下胃间质瘤多起源于胃壁固有肌层,肿瘤呈低回声,肿瘤较大时内部回声不均匀,可有点状高回声、强回声、不规则回声或囊状无回声区以及边界不规则等改变。超声胃镜是诊断黏膜下肿瘤最准确的方法,也是手术前评价和指导治疗的一个最有价值的手段[6]。GIST需要与平滑肌类肿瘤、神经源性肿瘤、胃肠道癌和淋巴瘤鉴别[7-8],GIST发生在盆腔时容易误诊为附件肿瘤,最终的确诊需要依靠病理免疫组化和电镜检查。GIST组织学上以梭形细胞和上皮细胞呈束状或弥漫性为特征。近来研究表明,GIST的发生与位于11号染色体上的C-Kit基因突变密切相关,导致其编码的蛋白CD117在细胞水平常常有过度表达[9]。C-Kit在GIST细胞中的阳性率达85%~94%,即几乎所有的GIST均有C-Kit表达。因此认为CD117是GIST的特征性指标。CD34是较早应用于GIST的研究中的一种造血前体细胞抗原,最初有人在GIST中检查到CD34,并且有较高阳性率[10]。CD34阳性患者大多数CD117亦阳性,偶尔有CD34阳性而CD117阴性者,两者呈互补性表达。所以,联合CD34和CD117检测,可提高GIST的诊断准确率。
综上所述,超声胃镜对GIST具有重要的诊断价值,内镜和CT是确定诊断的重要补充。临床怀疑的肿物必须通过CD117、CD34的检查才能诊断。
[1]Adani GL,Marcello D,Sanna A,et al.Gastrointestinal stromal tumors:evaluation of biological and clinical current opinions[J].Chir Ital,2002,54(2):127.
[2]Fletcher C,Berman F,Corless C,et al.Diagnosis of gastrointestinal stromal tumors:a consensus approach[J].Hum Pathol,2002,33(3):459.
[3]万德森.提高对胃肠道间质瘤的诊断水平[J].中华胃肠外科杂志,2003,6(5):285-287.
[4]周志刚,高剑波,杨学华,等.胃肠道间质瘤的螺旋CT征象与病理对照分析[J].实用放射学杂志,2008,24(7):912-915.
[5]薛静,张永久,聂占国,等.胃肠道间质瘤27例内镜,病理及手术治疗临床分析[J].西北国防医学杂志,2007,28(6):438-439.
[6]彭贵勇,代建华,房殿春,等.内镜超声在消化道黏膜下肿瘤诊断与治疗中的价值[J].中华消化内镜杂志,2006,23(2):102-105.
[7]许健,卢光明,郑玲,等.胃肠道间质瘤影像学诊断价值[J].医学研究生学报,2006,19(10):910-914.
[8]章士正,方松华.胃肠道间质瘤影像学诊断[J].中国医学计算机成像杂志,2001,7(2):126-129.
[9]杨园.CD117在胃肠道间质瘤中的表达及意义[J].实用肿瘤杂志,2011,26(1):65-66.
[10]王彦丽,赵向荣,白晨光,等.胃肠道间质瘤组织中PDGFRa和c-kit基因突变和蛋白表达的关系[J].世界华人消化杂志,2007,15(21):2300-2305.
