脂质氢过氧化物氧化修饰对大豆蛋白去折叠和复折叠性质的影响
2011-11-28林亲录华欲飞
吴 伟 林亲录 华欲飞
脂质氢过氧化物氧化修饰对大豆蛋白去折叠和复折叠性质的影响
吴 伟1,2林亲录1,2华欲飞3
(中南林业科技大学食品科学与工程学院1,长沙 410004)
(粮油深加工与品质控制湖南省重点实验室2,长沙 410004)
(江南大学食品学院3,无锡 214122)
以13-氢过氧化-顺-9,反-11-十八碳二烯酸(HPODE)代表脂质氢过氧化物,采用园二色谱和内源荧光光谱研究不同浓度HPODE氧化修饰对大豆蛋白去折叠和复折叠性质的影响。结果表明:复折叠过程中氧化大豆蛋白结构恢复程度随着大豆蛋白氧化程度的增加而下降;随着蛋白质氧化程度的增加,氧化大豆蛋白ΔGH2O、m以及去折叠分数为50%对应的尿素浓度([Urea]1/2)逐渐下降,表明蛋白质氧化导致大豆蛋白结构稳定性下降;蛋白质氧化还使得大豆蛋白去折叠速率增加,复折叠速率下降。
大豆蛋白 氧化修饰 去折叠 复折叠
蛋白质氧化是蛋白质分子在活性氧直接作用下,或通过次生氧化产物间接作用于蛋白质而导致的蛋白质共价结构修饰[1]。大豆中富含脂肪氧合酶(LOX)和多不饱和脂肪酸(PUFA),在大豆加工过程中,LOX-PUFA氧化体系通过自由基攻击和活性氧化产物共价交联导致蛋白质氧化[1]。脂质自由基和活性氧化产物诱导大豆蛋白氧化的研究已在前期报道,结果发现氧化修饰改变大豆蛋白的去折叠和聚集性质[2-5],而去折叠和聚集反应是大豆蛋白形成凝胶的重要步骤,因此氧化修饰也是影响大豆蛋白凝胶性质的因素之一。
氧化修饰对蛋白质凝胶性质的影响机理目前还不甚清楚。一方面由于蛋白质氧化应急环境较复杂。LOX-PUFA氧化体系包括自由基、脂质初级氧化产物和活性醛,目前蛋白质氧化研究主要围绕脂质自由基和活性醛来进行,而忽略了同样具有氧化活性但结构不稳定的脂质氢过氧化物,但研究发现脂质氢过氧化物在一定条件下稳定性较好[6]。因此为了全面研究氧化修饰对大豆蛋白凝胶性质的影响,需要研究脂质氢过氧化物影响大豆蛋白凝胶性质的机理。另一方面蛋白质凝胶机理复杂。蛋白质凝胶主要包括变性去折叠、聚集和形成凝胶网络等步骤,变性去折叠是形成聚集体和凝胶网络的前提条件,目前尚无氧化修饰对蛋白质变性去折叠方面的报道,因此为了研究氧化修饰影响大豆蛋白凝胶性质的机理,首先需要研究氧化修饰对大豆蛋白去折叠性质的影响。
大部分蛋白质热变性是一个不可逆过程,蛋白质热变性过程中形成的聚集体影响蛋白质去折叠性质的研究。而尿素变性蛋白质在一定条件下是一个可逆反应[7],在控制条件下尿素变性环境中可研究蛋白质的去折叠和复折叠性质。亚油酸是大豆中含量最丰富的PUFA,并且LOX催化亚油酸的主要产物是13-氢过氧化-顺-9,反-11-十八碳二烯酸(HPODE)。因此本试验以HPODE代表脂质氢过氧化物研究其对大豆蛋白在尿素中去折叠和复折叠性质的影响。
1 材料与方法
1.1 原料与试剂
LOX I-B和亚油酸:美国Sigma公司;其他试剂均为分析纯。
1.2 主要仪器和设备
CR21G高速冷冻离心机:日本日立公司;HH-S数显恒温水浴锅:江苏金坛市医疗仪器厂;MOS-450圆二色谱仪:法国Bio-Logic公司;F96荧光分光光度计:上海棱光技术有限公司。
1.3 试验方法
1.3.1 HPODE氧化大豆蛋白的制备
采用Hidalgo等[8]的方法在有氧条件下LOX催化亚油酸制备HPODE,然后采用前期研究的方法[5]制备HPODE氧化大豆蛋白,HPODE终浓度分别为0,0.001,0.01,0.1,1 和 10 mmol/L。
1.3.2 大豆蛋白去折叠样品的制备
将大豆蛋白溶解于0.01 mol/L pH 7.0的磷酸盐缓冲液中配制成5 mg/mL和0.5 mg/mL溶液备用。取1 mL蛋白液与一定体积的10 mol/L尿素溶液(溶于0.01 mol/L pH 7.0的磷酸盐缓冲液)以及一定体积的0.01 mol/L pH 7.0的磷酸盐缓冲液混合均匀,使得混合液总体积为5 mL并且尿素浓度从0 mol/L渐增到8 mol/L,此时混合液蛋白浓度分别为1 mg/mL和0.1 mg/mL,样品在25℃水浴中放置12 h备用。
1.3.3 大豆蛋白复折叠样品的制备
将4倍体积的10 mol/L尿素溶液(溶于0.01 mol/L p H 7.0的磷酸盐缓冲液)与1倍体积的由1.3.2制备的蛋白质溶液快速混合均匀,随后25℃水浴放置12 h,取出0.5 mL混合液与一定体积的 10 mol/L 尿素(溶于 0.01 mol/L pH 7.0 的磷酸盐缓冲液)以及0.01 mol/L pH 7.0的磷酸盐缓冲液混合均匀,使得尿素浓度从8 mol/L逐渐稀释至0.8 mol/L,并且在尿素稀释倍数不同的情况下保持稀释液总体积均为5 mL,此时蛋白浓度分别为1 mg/mL和0.1 mg/mL,随后再次25℃水浴放置12 h。
采用分光光度计检测大豆蛋白在去折叠和复折叠过程中220~340 nm之间吸光度的变化,结果发现吸光度无显著变化,说明大豆蛋白在去折叠和复折叠过程中没有发生聚集[9]。
1.3.4 大豆蛋白去折叠和复折叠过程中圆二色谱(CD)的测定
采用CD测定大豆蛋白去折叠和复折叠过程中的远紫外CD图谱(200~250 nm),25℃条件下采用宽度0.5 cm比色皿测定。
1.3.5 大豆蛋白去折叠和复折叠过程中内源荧光光谱的测定
采用荧光分光光度计测定大豆蛋白去折叠和复折叠过程中的内源荧光光谱(激发波长295 nm,发射波长300~400 nm),25℃条件下采用宽度1 cm石英比色皿测定,灵敏度设定为2。
1.3.6 大豆蛋白去折叠动力学曲线的测定
4倍体积的10 mol/L尿素溶液(溶于0.01 mol/L pH 7.0的磷酸盐缓冲液)与1倍体积1.3.2制备的5 mg/mL蛋白质溶液快速混合均匀,在激发波长295 nm条件下测定大豆蛋白在不含尿素λmax处荧光强度。25℃条件下采用宽度1 cm石英比色皿测定,灵敏度设定为2。从混合时开始计时,每隔10 s记录一次荧光强度。
1.3.7 大豆蛋白复折叠动力学曲线的测定
4倍体积的10 mol/L尿素(溶于0.01 mol/L pH 7.0的磷酸盐缓冲液)与1倍体积50 mg/mL蛋白液(溶于0.01 mol/L pH 7.0的磷酸盐缓冲液)混合均匀后在25℃水浴条件下放置12 h,随后取出0.5 mL蛋白溶液与 4.5 mL 0.01 mol/L pH 7.0 的磷酸盐缓冲液混合,使得尿素浓度从8 mol/L迅速稀释至0.8 mol/L,同时在激发波长295 nm条件下测定大豆蛋白样品在不含尿素λmax处荧光强度。25℃条件下采用宽度1 cm石英比色皿测定,灵敏度设定为2,从混合时开始计时,每隔20 s记录一次荧光强度。
2 蛋白质变性的二态模型
二态模型认为蛋白质在变性过程中只存在两种状态:天然态和变性态。测定不同变性状态下蛋白质的结构参数,并结合相关热力学方程就可得到蛋白质的热力学参数[10]。CD光谱中222 nm平均摩尔椭圆率([θ]222)和内源荧光光谱中最大荧光峰位(λmax)荧光强度可表征蛋白质在变性过程中二级结构和三级结构的变化。
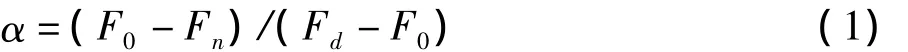
式中:α为蛋白质去折叠分数,F0为不含尿素时[θ]222或 λmax处荧光强度,Fd为含 8 mol/L 尿素时[θ]222或λmax处荧光强度,Fn为含不同浓度尿素(0~8 mol/L 之间)时[θ]222或 λmax处荧光强度。
蛋白质变性的平衡常数 K=α/(1-α) (2)
自由能的改变量ΔG=-R×T×ln K (3)
ΔG=ΔGH2O-m[尿素浓度] (4)
式中:ΔGH2O为不含尿素时蛋白质的ΔG,可表征蛋白质的结构稳定性;m为去折叠和复折叠过程中蛋白质分子的协同性,可表征蛋白质在去折叠和复折叠过程中暴露疏水氨基酸的数量。结合公式(1)~公式(3)可求解出含不同浓度尿素时蛋白质的ΔG,代入公式(4)中可得到ΔGH2O和m。ΔGH2O与m的比值是[尿素]1/2,即去折叠分数为0.5时对应的尿素浓度,也可表征蛋白质的结构稳定性 。
3 结果与讨论
3.1 蛋白质氧化对大豆蛋白去折叠和复折叠过程中[θ]222的影响
前期研究[5]发现HPODE氧化大豆蛋白的氧化程度随着HPODE添加浓度的增加而逐渐增大。图1为氧化大豆蛋白在去折叠和复折叠过程中[θ]222随着尿素浓度的变化曲线。在图1a氧化大豆蛋白去折叠过程中,随着尿素浓度的增加,[θ]222绝对值逐渐下降,表明氧化大豆蛋白α-螺旋结构逐渐遭到破坏。在图1b氧化大豆蛋白复折叠过程中,随着尿素浓度逐渐被稀释,氧化大豆蛋白[θ]222绝对值逐渐增加,表明氧化大豆蛋白α-螺旋结构逐渐恢复,但α-螺旋结构恢复程度与蛋白质氧化程度有关,大豆蛋白氧化程度越高,α-螺旋结构恢复程度越低。

图1 氧化大豆蛋白去折叠和复折叠过程中[θ]222随着尿素浓度的变化曲线
3.2 蛋白质氧化对大豆蛋白去折叠和复折叠过程中内源荧光光谱的影响
图2为氧化大豆蛋白在去折叠和复折叠过程中在不含尿素λmax处荧光强度和λmax随尿素浓度的变化曲线。在氧化大豆蛋白去折叠过程中(图2a),随着尿素浓度的增加,氧化大豆蛋白在不含尿素λmax处荧光强度逐渐下降,λmax发生红移。荧光强度下降和λmax红移是由于大豆蛋白在去折叠过程中色氨酸残基与蛋白质内部特定淬灭剂空间距离减小引起的,蛋白质内部特定淬灭剂主要包括质子化的羰基和咪唑基、去质子化的ε-氨基以及酪氨酸盐等极性基团[11],表明氧化大豆蛋白发生了去折叠反应。在氧化大豆蛋白复折叠过程中(图2b),随着尿素浓度逐渐被稀释,氧化大豆蛋白在不含尿素λmax处荧光强度逐渐上升,λmax发生蓝移,表明氧化大豆蛋白在复折叠过程中三级结构逐渐恢复。复折叠过程中大豆蛋白三级结构恢复程度与蛋白质氧化程度有关,大豆蛋白氧化程度越高,三级结构恢复程度越低。

图2 氧化大豆蛋白去折叠和复折叠过程中在不含尿素λmax处荧光强度和λmax随尿素浓度的变化曲线
3.3 蛋白质氧化对大豆蛋白去折叠和复折叠热力学参数的影响
蛋白质变性热力学研究中常采用二态模型分析,但二态模型也存在一定的应用范围。当蛋白质在去折叠过程中形成去折叠中间体或者在复折叠过程中形成聚集体时,蛋白质的去折叠和复折叠反应就不符合二态模型[10]。去折叠中间体和复折叠聚集体的存在使得采用二态模型依据不同结构特征测定方法计算出来的ΔGH2O值相差很大,因此常常采用比较依据不同结构特征测定方法计算出来的ΔGH2O值来判断蛋白质变性是否符合二态模型[12]。[θ]222表征和内源荧光强度表征得到的大豆蛋白热力学参数分别见表1和表2,对比两表数据可发现两种结构表征方法得到的ΔGH2O值比较接近,表明氧化大豆蛋白在尿素中的去折叠和复折叠反应基本符合二态模型,因此可采用二态模型分析氧化修饰对大豆蛋白热力学参数的影响。
从表1和表2中可看出氧化大豆蛋白在去折叠和复折叠过程中的ΔGH2O和[尿素]1/2值均随着蛋白质氧化程度的增加而减小,表明氧化修饰使得大豆蛋白结构稳定性下降。氧化大豆蛋白结构稳定性下降主要是由以下原因造成的:(1)氧化修饰使得大豆蛋白二硫键含量下降。二硫键是维持蛋白质结构稳定性的重要作用力之一,蛋白质在尿素中的结构稳定性与二硫键数量密切相关[13]。Pace等[14]指出破坏核糖核酸酶T1中二硫键能够导致该酶在尿素中自由能变化量急剧下降。Zhou等[15]研究发现当内皮生长抑素中一个半胱氨酸残基定点突变为丙氨酸时,该蛋白由于二硫键含量减少而导致结构稳定性大幅下降。前期研究[5]发现高浓度HPODE氧化修饰使得大豆蛋白二硫键含量显著下降。(2)氧化修饰导致蛋白质聚集。Santini等[16]认为氧化蛋白聚集体的存在会导致蛋白质结构稳定性下降。前期研究[5]中的分子量分布结果表明HPODE修饰导致大豆蛋白聚集,而氧化蛋白质聚集体可认为是一种错折叠体,错折叠体的存在可导致蛋白质结构稳定性下降[17]。

表1 [θ]222表征氧化大豆蛋白去折叠和复折叠过程得到的热力学参数

表2 在不含尿素λmax处荧光强度表征氧化大豆蛋白去折叠和复折叠过程得到的热力学参数
从表1和表2还可看出氧化大豆蛋白在去折叠和复折叠过程中的m值随着蛋白质氧化程度的增加而减小,说明蛋白质氧化使得大豆蛋白变性时暴露出的疏水性氨基酸数量下降或者分子协同性降低,这主要是由以下原因造成的:(1)蛋白质氧化将大豆蛋白中的疏水基团转化成为亲水基团,使得蛋白质表面疏水性下降;(2)蛋白质氧化导致大豆蛋白聚集,疏水键也参与聚集体的形成,当共价交联也参与到聚集体形成时,包裹疏水键的可溶聚集体可发展成为不可溶聚集体,进一步使得疏水性氨基酸残基数量下降。以上两点在前期研究[5]中已经详细说明和论证。(3)氧化聚集体作为错折叠体可降低大豆蛋白分子的协同性[17]。
3.4 蛋白质氧化对大豆蛋白去折叠和复折叠速率的影响
在氧化大豆蛋白去折叠过程中(图3a),大豆蛋白荧光强度随着时间的延长而逐渐下降。在8 mol/L尿素变性条件下,天然大豆蛋白在4 000 s左右去折叠反应达到平衡态,而氧化大豆蛋白去折叠反应达到平衡态对应的时间随着蛋白质氧化程度的增加而逐渐下降,表明氧化修饰使得大豆蛋白去折叠反应速率增大。在氧化大豆蛋白复折叠过程中(图3b),随着时间的增加,大豆蛋白荧光强度逐渐增大。将8 mol/L尿素完全去折叠大豆蛋白溶液中的尿素浓度迅速稀释10倍,完全去折叠态天然大豆蛋白在2 000 s左右复折叠反应达到平衡状态,随着蛋白质氧化程度的增加,完全去折叠态氧化大豆蛋白复折叠反应达到平衡时间逐渐增加,说明蛋白质氧化使得大豆蛋白复折叠反应速率减小。

图3 氧化大豆蛋白去折叠和复折叠过程中荧光强度随时间的变化曲线
目前有关氧化修饰对蛋白质去折叠和复折叠速率影响的研究报道极少,文献检索仅仅发现Prinsze等[18]做过类似的研究,Prinsze 等[18]发现羟自由基氧化导致3-磷酸甘油醛脱氢酶、氧化还原酶以及醇脱脂酶复折叠速率增大,而单线态氧氧化则导致肌球蛋白复折叠速率下降,说明蛋白质氧化对蛋白质复折叠速率的影响同时与蛋白质氧化类型以及蛋白质种类有关。
4 结论
氧化大豆蛋白在尿素变性环境中的去折叠反应和复折叠反应基本符合二态模型。HPODE氧化修饰使得大豆蛋白在尿素变性环境中的结构稳定性下降。HPODE氧化大豆蛋白易于发生去折叠反应,而不易发生复折叠反应,这主要是由于氧化大豆蛋白二硫键含量和表面疏水性下降以及形成氧化聚集体造成的。
[1]Shacter E.Quantification and significance of protein oxidation in biological samples[J].Drug Metabolism Reviews,2000,32(3-4):307-326
[2]Wu W,Zhang C M,Kong X Z,et al Oxidative modification of soy protein by peroxyl radicals[J].Food Chemistry,2009,116(1):295-301
[3]Wu W,Zhang C M,Hua Y F.Structural modification of soy protein by the lipid peroxidation product malondialdehyde[J].Journal of the Science of Food and Agriculture,2009,89(8):1416-1423
[4]Wu W,Wu X J,Hua Y F.Structural modification of soy protein by the lipid peroxidation product acrolein[J].LWT -Food Science and Tech-nology,2010,43(1):133 -140
[5]Wu W,Hou L,Kong X Z,et al Structural modification of soy protein by 13 - hydroperoxyoctadecadienoic acid[J].European Food Research and Tech-nology,2009,229(5):771 -778
[6]Fruebis J,Parthasarathy S,Steinberg D.Evidence for a concerted reaction between lipid hydroperoxides and polypeptides[J].Proceedings of the National Academy of Sciences of the United States of America,1992,89(22):10588 -10592
[7]Nir I,Feldman Y,Aserin A,et al Surface properties and emulsification behavior of denatured soy proteins[J].Journal of Food Science,2006,59(3):606 -610
[8]Hidalgo F J,Kinsella JE.Changes induced in β -lactoglobulin Bfollowing interactions with linoleic acid 13-hydroperoxide[J].Journal of Agricultural and Food Chemistry,1989,37(4):860-866
[9]Patel S,Chaffotte A F,Goubard F,et al Urea - induced sequential unfolding of fibronectin:a fluorescence spectroscopy and circular dichroism study[J].Biochemistry,2004,43(6):1724-1735
[10]Eftink M R,Ionescu R.Thermodynamics of protein unfolding:questions pertinent to testing the validity of the two- state model[J].Biophysical Chemistry,1997,64(1 - 3):175-197
[11]Halfman CJ,Nishida T.Nature of the alteration of the fluorescence spectrum of bovine serum albumin produced by the binding of dodecyl sulfate[J].Biochim Biophys Acta,1971,243(2):294-303
[12]Guo SY,Guo Z,Chen BY,et al Urea induced inactivation and unfolding of arginine kinase from the sea cucumber stichopus japonicus[J].Biochemistry,2003,68(11):1575 -1580
[13]Zhou N E,Kay C M,Hodges R S.Disulfide bond contribution to protein stability:positional effects of substitution in the hydrophobic core of the two-stranded alpha-helical coiled - coil[J].Biochemistry,1993,32(12):3178 - 3187
[14]Pace C N,Grimsley G R,Thomson J A,et al Conformational stability and activity of ribonuclease T1 with zero,one,and two intact disulfide bonds[J].Journal of Biological Chemistry,1988,263:11820 -11825
[15]Zhou H,Wang W,Luo Y Z.Contributions of disulfide bonds in a nested pattern to the structure,stability,and biological functions of endostatin[J].Journal of Biological Chemistry,2005,280(12):11303 -11312
[16]Santini SA,Mordente A,Meucci E,et al Conformational stability of bovineα -crystallin.Evidence for a destabilizing effect of ascorbate[J].Biochemical Journal,1992,287:107 -112
[17]Dobson C M.Protein folding and misfolding[J].Nature,2003,426(6989):884 -890
[18]Prinsze C,Dubbelman T M A R,Steveninick J V.Protein damage,induced by small amounts of photodynamically generated singlet oxygen or hydroxyl radicals[J].Biochimica et Biophysica Acta,1990,1038(2):152 -157.
Effects of Oxidative Modification by Lipid Hydroperoxide on Unfolding and Refolding Properties of Soy Protein
Wu Wei1,2Lin Qinlu1,2Hua Yufei3
(School of Food Science and Engineering,Central South University of Forestry and Tech-nology1,Changsha 410004)
(Hunan Key Laboratory of Grain - oil Process and Quality Control2,Changsha 410004)
(School of Food Science and Tech-nology,Jiangnan University3,Wuxi 214122)
13-hydroperoxy-9Z,11E -octadecadienoic acid(HPODE)was selected as the representatives of lipid hydroperoxides to investigate effects of oxidative modification by a serial concentration of lipid hydroperoxide on the unfolding and refolding properties of soy protein which was characterized by circular dichroism and intrinsic fluorescence.Results showed that:the extent of oxidized soy protein structural recovery during refolding process decreased as the extent of soy protein oxidation increased.As extent of protein oxidation increased,ΔGH2O,m,and[Urea]1/2of oxidized soy protein gradually decreased.The phenomena indicated that oxidative modification led to a decrease in protein structural stability.In addition,oxidative modification also resulted in an increase in the unfolding rate of soy protein in urea,but a decrease in the refolding rate of soy protein.
soy protein,oxidative modification,unfolding,refolding
TS201.2+1
A
1003-0174(2011)07-0017-06
国家自然科学基金(20876069),食品科学与技术国家重点实验室目标导向课题(SKLF-MB-200803)
2010-09-14
吴伟,男,1981年出生,讲师,博士,粮食及植物蛋白
