神经受体在人骨髓源性神经细胞上的表达
2011-11-27吴素霞柴立辉鄢文海
吴素霞,柴立辉,鄢文海,邢 莹*
(1.河南大学医学院 病理学教研室,河南 开封475004;2.河南大学 细胞与分子免疫学重点实验室,河南 开封475004;3.郑州大学 干细胞研究中心,河南 郑州450052)
人骨髓间充质干细胞(human bone mesenchymal stem cells,hBMSC)是存在于骨髓中的非造血干细胞,在体外一定条件下可向神经细胞进行分化[1],并具有神经元细胞的形态学特征[2],能对去极化刺激产生反应[3]和释放神经递质[4]。但是,有关人骨髓源性神经细胞受体表达的研究却鲜有报道。本实验利用细胞因子和化学诱导剂在体外诱导hBMSC向神经细胞分化,检测神经受体在分化形成的神经细胞上的表达情况,探讨hBMSC来源的神经细胞是否具有发挥传导冲动功能的受体结构,为临床应用神经细胞移植替代治疗某些神经精神性疾病提供一种理想的细胞来源。
1 材料与方法
1.1 材料
正常成人骨髓(25U/mL肝素抗凝)来源于郑州大学第一附属医院;Ficoll-paque分离液购自天津TBD公司;胎牛血清(fetal bovine serum,FBS)购自Hyclone公司;表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、二甲基亚枫(dimethyl sulphoxide,DMSO)、丁羟基茴香醚(butyl hydroxy anisol,BHA)、forskolin(FSK)、脑源性神经营养因子(brain derived neurotrophy factor,BDNF)均购自Sigma公司;FITC标记 CD34、CD45、CD44、CD117抗体购自ebioscience公司;NSE单克隆抗体、DRD2单克隆抗体均购自Santacruz公司;免疫组织化学试剂盒购自北京中杉金桥公司;总RNA提取试剂盒、反转录试剂盒和PCR扩增试剂盒均购自上海生物工程技术有限公司。
1.2 方法
1.2.1 hBMSC的分离培养 用PBS以1∶1的比例稀释骨髓,将稀释后的骨髓小心叠加于Ficollpaque分离液上层,2 000r/min,离心25min;吸取单个核细胞层,PBS洗涤细胞2次,1 200r/min,离心10min;用含20μg/L EGF、20μg/L bFGF和体积分数为10%FBS的DMEM-L培养基重悬细胞,置37℃、体积分数为5%CO2、饱和湿度条件下培养1d后更换新鲜培养基,去除非贴壁细胞;以后每3d换液1次,待细胞达到覆盖80%~90%培养底面后用消化液(体积分数为0.125%胰酶+0.1g/L EDTA)消化收集细胞,以(4~5)×103/cm2细胞密度重新接种细胞,同样条件下继续培养。消化收集培养至第4代的hBMSC,PBS洗细胞2次,分别加入FITC标记的CD34、CD45、CD44、CD117抗体,冰上孵育30min,PBS洗细胞2次,流式细胞仪检测细胞表面标志的表达情况。
1.2.2 免疫细胞化学染色 将传至第4代的hBMSC按4×103/cm2细胞密度接种于6孔培养板,用含有体 积 分 数 为 1%DMSO、200 μmol/L BHA、100μmol/L FSK 和50μmol/L BDNF的DMEM-L培养基诱导培养3d后取出细胞爬片,PBS洗涤3次,质量分数为4%多聚甲醛固定15min,体积分数为0.3%triton-X100透化处理10min,体积分数为3%H2O2作用15min以去除非特异性过氧化物酶,山羊血清封闭15min,一抗(NSE 1∶100,DRD 21∶500)4℃孵育过夜。生物素化二抗37℃ 孵育15min,辣根酶标记链酶卵白素37℃孵育15min,DAB显色10min,梯度乙醇脱水,二甲苯透明,中性树胶封片。显微镜下随机选取10个视野,计数染色阳性细胞。
1.2.3 RT-PCR检测 hBMSC经诱导培养3d后消化收集细胞,根据试剂盒说明书提取细胞总RNA,反转录合成cDNA,PCR扩增目的片断(反应体系50μL),反应条件为:94℃预变性5min,94℃变性30s,57℃退火30s,72℃延伸50s,共35个循环。最后一个循环延伸7min。反应产物采用18g/L的琼脂糖凝胶进行电泳。特异性引物序列:NSE上游引物:5'-CATCGACAAGGCTGGCTACACG-3',下 游 引 物:5'-GACAGTTGCAGGCCTTTTCTT C-3';DRD2 上 游 引 物:5'-CAAGACCATGAGCC GTA GGAAG-3',下 游 引 物:5'-TTCACGGCGC TGTTGACATAG-3';5-HT2受体 上游引物:5-A TCAAGTCACTCCAGAAAGAAGCT-3',下 游 引物:5'-TGAAAAGGCTGACCTATAGGTCTT-3';GABAA受 体-α2亚基 上游引 物:5'-GCTTATGCAGTGGC TGTTGC-3',下 游 引 物:5'-GGACTGACCCCTA ATACAGGTTC-3'。
1.2.4 统计学分析 结果采用SPSS 12.0软件进行t检验分析,以P<0.05作为有统计学意义的标志。
2 结果
2.1 hBMSC的形态学特征及表面标志
贴壁培养纯化得到的hBMSC形态为成纤维样细胞,培养纯化至第4代的细胞经流式细胞仪检测结果显示,间充质干细胞相对特异性抗原CD44、CD117表达阳性,造血干细胞特异性抗原CD34、CD45表达阴性。DMSO/BHA/FSK/BDNF诱导培养12h后大部分细胞即出现胞体变圆,折光性增强,并有突起形成,具有神经细胞光镜下的形态学特征,见图1。

图1 诱导分化后的细胞形态 (×100)
2.2 神经受体在骨髓源性神经细胞上的表达
2.2.1 免疫细胞化学染色 hBMSC经诱导培养3d后进行免疫细胞化学染色,显微镜下随机选取10个视野,计数NSE阳性细胞(图1A)和DRD2阳性细胞(图1B)。诱导3d后,NSE、DRD2阳性细胞率分别为 (2.271 8±0.552 1)% 和 (1.988 2±0.406 2)%;诱导前的NSE、DRD2阳性细胞率分别为(0.632 4±0.150 7)%和(0.354 4±0.124 5)%,两者相比有明显提高(P<0.05)。

图2 诱导分化后免疫细胞化学染色的细胞 (×100)A.NSE阳性细胞 ;B.DRD2阳性细胞 。
2.2.2 RT-PCR检测结果 hBMSC经诱导培养3d后,RT-PCR 产物电泳结果显示在 NSE、DRD2、5-HT2受体和GABAA受体-α2亚基的泳道有目的条带出现,诱导培养前的hBMSC采用相同条件不能扩增出目的产物。提示诱导分化后的细胞神经元相对特异性标志NSE及DRD2、5-HT2受体和GABAA受体-α2亚基的mRNA表达阳性(图3)。
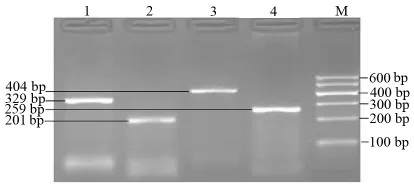
图3 RT-PCR扩增产物的电泳结果1.NSE 329bp;2.DRD2 201bp;3.5-HT2受体404bp;4.GABAA 受体-α2亚基259bp;M.Marker。
3 讨论
目前对hBMSC的鉴定还没有公认的特异性标志物。由于CD44、CD117在hBMSC表面的表达较造血干细胞和胚胎干细胞高,因此,CD44、CD117常常被作为hBMSC的相对特异性表面分子用于对hBMSC进行鉴定[5]。本实验从人骨髓前体细胞中培养扩增得到的hBMSC高表达CD44、CD117,而不表达造血干细胞的标志性分子CD34、CD45,和相关研究报道的结果一致。
近年来研究[1,6]发现,hBMSC在体内外一定条件下可以向神经细胞分化,分化后的神经细胞可表达神经元和神经胶质细胞特异性指标NSE、NF-M、tau蛋白和GFAP等。本实验通过联合应用DMSO/BHA/FSK/BDNF诱导hBMSC向神经细胞分化,免疫细胞化学染色和RT-PCR检测均检测到NSE的表达较诱导前明显增高,说明该方法可以成功诱导hBMSC向神经细胞分化。但分化后的神经细胞是否具有成熟神经细胞的功能对于临床应用极为重要,能够分泌神经递质和表达神经受体被认为是神经细胞成熟的重要标志[7]。神经受体作为神经细胞传导冲动的膜蛋白结构对神经细胞功能的正常发挥起着非常重要的作用,而且某些神经受体如5-HT2受体还是抗精神病药物的靶受体,所以研究人骨髓源性神经细胞受体的表达将为进一步研究人骨髓源性神经细胞的功能和临床应用奠定基础。本研究通过联合应用DMSO/BHA/FSK/BDNF成功诱导hBMSC向神经细胞分化,检测到GABAA受体-α2亚基、5-HT2受体和DRD2在分化后细胞上的表达,证明了人骨髓源性神经细胞可以表达神经受体。
目前对DMSO、BHA、FSK和BDNF诱导hBMSC向神经细胞分化的作用机制尚不十分清楚。DMSO、BHA可能是通过抑制磷酸二酯酶的活性,稳定保护细胞膜和促进谷胱甘肽的合成而诱导细胞分化[8];而FSK通过提高细胞内cAMP的水平,调节神经突起生长和分支的形成,并对神经元样细胞的抗凋亡过程起一定作用[7],另外,FSK作为cAMP激动剂,可能通过提高胞内cAMP的水平从而促进DRD2蛋白在细胞膜上表达[9]。这些因子可能通过协同BDNF的作用诱导神经细胞的分化发育[10]。
虽然本研究检测到DRD2等多种受体在人骨髓源性神经细胞上的表达,但这些受体是否具备结合配体的能力以及结合配体后能否引发胞内信号转导尚需进一步的研究。相信深入的研究必将为人骨髓源性神经细胞应用于临床提供充分的理论依据。
[1]Woodbury D,Schwarz E J,Prockop D J,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].Journal of Neuroscience Res,2000,61(10):364-370.
[2]柴立辉,程相树,吴素霞,等.人骨髓源性神经细胞的形态及超微结构[J].河南大学学报:医学版,2009,28(3):190-193.
[3]Shin Chieh Hung,Henrich Cheng.In Vitro Differentiation of Size-Sieved Stem Cells into Electrically Active Neural Cells[J].Stem Cells,2002,20(6):522-529.
[4]Chai Lihui,Wu Suxia,Chen Zongde,et al.Structural and functional characteristics of human bone marrow mesenchymal stem cells-derived dopaminergic neurons[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2008,12(29):5 793-5 795.
[5]Fox L E,Shen J,Ma K,et al.Membrane properties of neuron-like cells generated from adult human bone-marrow-derived mesenchymal stem cells[J].Stem Cells Dev,2010,19(12):1 831-1 841.
[6]Mari Dezawa,Hiroshi Kanno,Mikio Hoshino,et al.Specific induction of neuronal cells from bone marrow stromal cells and application for autologous transplantation[J].Research Clin,2004,113(9):1 701-1 710.
[7]Aleksandrova M A,Sukhikh G T,Chailakhyan R K,et al.Comparative analysis of differentiation and behavior of human neural and mesenchymal stem cells in vitro and in vivo[J].Bull Exp Biol Med,2006,141(1):152-160.
[8]Trzaska K A,Rameshwar P.Dopaminergic neuronal differentiation protocol for human mesenchymal stem cells[J].Methods Mol Biol,2011,698(24):295-303.
[9]Barzilay R,Kan I,Ben Zur T,et al.Induction of human mesenchymal stem cells into dopamine-producing cells with different differentiation protocols[J].Stem Cells Dev,2008,17(3):547-54.
[10]Lim J Y,Park S I,Oh J H,et al.Brain-derived neurotrophic factor stimulates the neural differentiation of human umbilical cord blood-derived mesenchymal stem cells and survival of differentiated cells through MAPK/ERK and PI3K/Akt-dependent signaling pathways[J].J Neurosci Res,2008,86(10):2 168-2 178.
