合成单菊花醇的工艺改进*
2011-11-26施小新
董 菁, 王 娜, 吕 霞, 施小新
(华东理工大学 药学院 制药工程系,上海 200237)
人体内的纺锤体驱动蛋白(Eg5)[1]是一种在细胞分裂中具有分子发动机功能的蛋白质,它协调有机细胞体的分裂形成双极的有丝分裂纺锤体。抑制Eg5能够导致癌细胞周期的停滞,从而最终引起癌细胞的凋亡。Eg5酶抑制剂与传统的作用于微管的药物不同,不会影响微管的稳定性和产生神经毒性,因此Eg5已成为肿瘤化学治疗药物新的作用靶标,逐渐为人们所重视[2~7]。
最早的靶向Eg5小分子抑制剂是Mayer等[8]发现的单菊花醇(1)。1属于二氢嘧啶酮类化合物,主要通过Biginelli反应[9]合成。文献[10]方法是在盐酸存在下,由间羟基苯甲醛(2),乙酰乙酸乙酯(3)与硫脲(4)反应合成1,收率17%。以FeC13, LaCl3, Yb(OTf)3等Lewis酸作催化剂;或以固相为载体联合微波、超声波等促进的方法,利用Biginelli反应合成二氢嘧啶酮类化合物[11,12],要么存在试剂昂贵、反应时间较长、收率偏低等缺点;要么反应条件不易控制、无法大量制备。
本文在文献[10]方法的基础上改进合成1的工艺(Scheme 1),以对甲苯磺酸(p-TsOH)为催化剂,2,3和4在乙醇中回流12 h,通过Biginelli反应“一锅法”合成了1,收率86%,其结构经1H NMR, IR和MS确证。
Scheme1
1 实验部分
1.1 仪器与试剂
Bruker ADVANCE 400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);NICOLET IR 550型红外光谱仪(KBr压片);HP 5989A型质谱仪。
所用试剂除特殊注明外均为分析纯。
1.2 合成
在圆底烧瓶中依次加入2 2.4 g(20 mmol),33.1 g(24 mmol),44.57 g(60 mmol),p-TsOH 0.34 g(2 mmol)和无水乙醇20 mL,搅拌下回流反应12 h。冷却至0 ℃,析出大量白色固体,过滤,滤饼用冷水洗涤后用80%乙醇重结晶得白色晶体15.1 g,收率86%, m.p.184 ℃~185 ℃;1H NMRδ: 10.30(s, 1H), 9.61(s, 1H), 9.46(s, 1H), 7.12(t,J=7.6 Hz, 1H), 6.65(d,J=8.9 Hz, 3H), 5.09(s, 1H), 4.02(q,J=7.1 Hz, 2H), 2.28(s, 3H), 1.12(t,J=7.1 Hz, 3H); IRν: 3 300, 3 150, 2 900~2 600, 1 680, 1 655, 1 575 cm-1; MSm/z(%): 292(M+, 87), 263(36), 219(45), 199(100), 171(37)。
2 结果与讨论
2.1 催化剂对合成1的影响
催化剂用量10 mol%,其余反应条件同1.2,考察了不同催化剂对合成1的影响,结果如表1所示。由表1可见,催化剂对反应速度和收率有较大影响,p-TsOH的催化效果最好,收率高,副产物少。
2.2 反应物摩尔比对合成1的影响
10 mol%p-TsOH, 2 20 mmol,其余反应条件同1.2,考察了反应物摩尔比[r=n(2) ∶n(3) ∶n(4)]对合成1的影响,结果见表2。从表2可以看出,增加3和4的用量,有利于提高收率,当r=1.0 ∶1.2 ∶3.0时,收率最高。
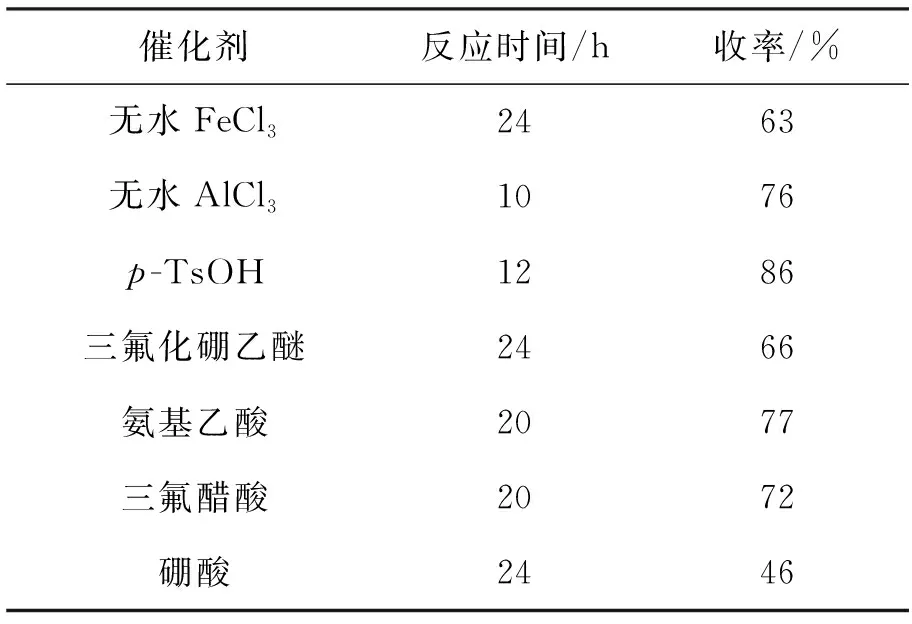
表 1 催化剂对合成1的影响*
*10 mol%催化剂,其余反应条件同1.2

表 2 r对合成1的影响*
*2 20 mmol, 10 mol%p-TsOH,其余反应条件同1.2;r=n(2) ∶n(3) ∶n(4)
综上所述,合成1的最佳反应条件为:2 20 mol,n(2) ∶n(3) ∶n(4)= 1.0 ∶1.2 ∶3.0, 10 mol%p-TsOH,在乙醇中回流反应12 h, 1收率86%。
改进方法催化剂用量少,操作简单,后处理容易,收率较高,适合大量制备。
[1] Miyamoto D T, Perlman Z E, Burbank K S. The kinesin Eg5 drives poleward microtubule flux in Xenopus laevis egg extract spindle[J].J Cell Biol,2004,167(5):813-818.
[2] Desai A, Mitchison T J. Microtubule polymerization dynamics[J].Rev Cell Dev Biol,1997,13:83-117.
[3] Lawrence C J, Dawe R K, Christie K R,etal. A standardized kinesin nomenclature[J].J Cell Biol,2004,167(1):19-22.
[4] Sharp D J, Rogers G C, Scholey J M. Microtubule motors in mitosis[J].Nature,2000,407:41-47.
[5] 江程,尤启冬,吴梧桐,等. 二氢喹唑啉类Eg5抑制剂的设计、合成及生物活性[J].中国药科大学学报,2007,38(6):489-495.
[6] 王伦善,王保龙,任维华. 驱动蛋白Eg5及其靶向治疗药物的抗肿瘤机制[J].生命的化学,2008,28(4):190-193.
[7] Xiao S, Shi X X.The first highly stereoselective approach to the mitotic kinesin Eg5 inhibitor HR22C16 and its analogues[J].Tetrahedron:Asymmetry,2010,21(2):226-231.
[8] Mayer T U, Kapoor T M, Haggarty S J,etal. Small molecule inhibitor of mitotic spindle bipolarity identified in a phenotype-based screen[J].Science,1999,286:971-974.
[9] Biginelli P. Aldehyde-urea derivatives of aceto- and oxaloacetic acids[J].Gazz Chim Ital,1893,23:360-416.
[10] Kappe C O, Shishkin O V, Uray G, Verdino P. X-Ray structure,conformational analysis,enantioseparation,and determination of absolute configuration of the mitotic kinesin Eg5 inhibitor monastrol[J].Tetrahedron,2000,56(13):1859-1862.
[11] 景崤壁,汤定坤,潘鑫,等. 3,4-二氢嘧啶-2-酮衍生物合成研究进展[J].江苏化工,2007,35(5):1-5.
[12] Shobha D, Chari M A, Mano A,etal. Synthesis of 3,4-dihydropyrimidin-2-ones(DHPMs) using mesoporous aluminosilicate(AlKIT-5) catalyst with cage type pore structure[J].Tetrahedron,2009,65(51):10608-10611.
