海洋沉积物来源链霉菌属次生代谢产物及其生物活性研究进展
2011-11-23黄永中罗雄明王建华
黄永中,罗雄明,王建华*
1重庆大学生物工程学院,重庆400044;2中国科学院南海海洋研究所,广州510301
海洋沉积物来源链霉菌属次生代谢产物及其生物活性研究进展
黄永中1,罗雄明2,王建华1*
1重庆大学生物工程学院,重庆400044;2中国科学院南海海洋研究所,广州510301
海洋沉积物是营养较为丰富的微生物栖息地,近年来从海洋沉积物中分离培养出了大量海洋链霉菌,从中还发现了一些新的属种。人们已从海洋沉积物来源链霉菌属中发现了许多具有药用价值的活性化合物,有力推动了海洋天然产物化学的发展,并为新药研发提供基础。本文就海洋沉积物来源链霉菌属次生代谢产物的结构类型及其生物活性进行简要综述。
海洋沉积物;链霉菌属;次生代谢产物;生物活性
海洋微生物由于其生存环境的特殊性(如高渗、高盐、高压、低温、低氧等),发展出独特的代谢方式,往往能产生一些化学结构新颖、生物活性多样独特的先导化合物,并使其成为海洋生物活性物质的重要来源,为新药研究提供大量的药物前体和模式结构。因此,从海洋中筛选出高效、新颖、低毒的抗菌活性物质潜力巨大。
海洋放线菌广泛栖息于海洋动植物体表、体内,海水及海底沉积物中[1]。其中,腐殖质含量丰富的海洋沉积物是海洋放线菌的一个主要栖息场所,从离海岸较近的浅滩到深达几千米的深海沉积物中均有海洋放线菌的存在。研究表明,海洋沉积物中的放线菌以链霉菌比例最高,链霉菌属(Streptomyces)成为了海洋沉积物的优势菌群。自20世纪70年代东京微生物化学研究所从海洋放线菌Chainia sp.中分离到抗生素SS-228Y以来,从海洋放线菌中发现结构新颖并具有强生理活性的物质已达100多个,其中90%以上产生于链霉菌属。因此,放线菌特别是链霉菌属成为抗生素的最大来源,是极其重要的产生活性天然产物的资源微生物。
经过大量研究得出,从海洋沉积物来源链霉菌属微生物中发现的次生代谢产物类型涉及生物碱类、蒽醌类、内酯类、萜类、肽类、脂肪酸类、黄酮类以及苯酚类等;这些成分具有抗菌、抗肿瘤、抗癌、抗炎、抗病毒、抗疟、细胞毒性等生物活性[2-4]。其中,部分化合物的结构类型及生物活性与陆生链霉菌属中所发现的有着显著差异。
1 生物碱类(alkaloids)
分离自海洋沉积物链霉菌的生物碱的主要结构有酰胺、吲哚、咔唑、吡喃、吡咯、吡啶、噻唑、吩嗪等,此外,还有一些大环生物碱和其它特殊生物碱类化合物。这些生物碱具有多种多样的生物活性,从而备受瞩目。
Staurosporine(星型孢菌素)(1)是从渤海海岸沉积物Streptomyces roseoglavus MB-97中分离得到的吲哚咔唑类生物碱,该化合物具有使平滑肌松弛,抑制蛋白激酶C,抗血小板凝集,阻滞细胞周期,抗肿瘤等多种生物活性[5]。新的星形孢菌素N-carboxamido-staurosporine(2)在浓度为80 mg/paper disk时对绿色链霉菌(Streptomyces viridis)表现出弱的选择性活性[6]。
Marineosin A(3)和marineosin B(4)是从海洋沉积物分离的Streptomyces sp.CNQ-617发酵液中得到的生物碱类化合物,二者都有两个吡咯环。Marineosins与灵红霉素有关,对白色念珠球菌(Candida albicans)有弱的抗真菌活性,化合物3对人结肠癌细胞(HCT-116)有细胞毒活性,IC50为0.5 μmol/L,明显强于化合物4(IC50为46 μmol/L)。螺环缩醛胺中心构型和四氢吡喃构象的不同是造成二者活性差异的主要原因。化合物3在NCI60细胞实验中显示出广谱抗肿瘤活性,尤其对黑色素瘤细胞和白血病细胞有较强的选择性细胞毒活性[7]。
崔洪霞等[8]从胶州湾浅滩沉积物海洋链霉菌中分离到全霉素(5)。该化合物对金黄色葡萄球菌(Staphyloccocus aureus)和丝状真菌毛霉(mucor)miehei(TU284)具有显著的抑制作用。
Streptomyces nodosus(NPS007994)是从加利福尼亚海洋沉积物中分离到的一株链霉菌,它产生的lajollamycin(6)对肿瘤细胞B16-F10的生长有抑制作用,它还对药敏型及耐药型革兰氏阳性菌有抑制作用[9]。
Jeong[10]等从深海沉积物分离的海洋链霉菌KORDI-3238的发酵液中分离到一个新的生物碱类化合物streptokordin(7),以及四个已知化合物nonactic acid,dilactone,trilactone,nonactin。其中7对七种人类肿瘤细胞有着显著的细胞毒活性,但对细菌和真菌的生长无抑制作用。
解修超[11]从海南文昌清澜港红树林保护区沉积物海洋链霉菌124092中分离到1个新的生物碱类化合物p-tolyl-3-aminopropanoate(8),发现该化合物对小鼠黑色素瘤B16细胞有一定的细胞毒活性,IC50为59.0 μg/mL。
化合物daryamides A-C(9~11)是从加利福尼亚圣地亚哥海洋沉积物中分离的链霉菌菌珠CNQ-085中得到的聚酮生物碱类化合物。这些化合物对耐甲氧西林葡萄球菌(methicillin resistant staphylococcus aureus,MRSA)无抑制作用;对人结肠癌细胞(HCT-116)有中等强度的细胞毒活性,其中化合物9的毒性较强,IC50为3.15 μg/mL;而化合物9、10对白色念珠菌有非常弱的抗真菌活性[12]。
从加州La Jolla深海沉积物中分离出一株新的Streptomyces sannurensis CNQ-418,其次生代谢出化合物marinopyrroles A-F(12~17),它们包含一个罕见的氯和溴取代的1,3'-双吡咯核,这些化合物对MRSA有着显著的抗菌活性[13]。
从墨西哥湾Laguna de Terminos海洋沉积物分离的链霉菌Streptomyces caelestis B7967中分离得到4-乙酰基-1,3-二羟基-咪唑并[4,5-c]吡啶-2-酮(18)。该化合物对金黄色葡萄球菌、大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、绿色链霉菌、白色念珠菌、毛霉菌都没有抑制活性,在海虾致死活性实验中也没有表现出细胞毒活性[14]。
Caboxamycin(19)是从太平洋Canary Basin深海沉积物分离的海洋链霉菌NTK 937菌株中分离得到的一个新的苯并噁唑类抗生素。它对革兰氏阳性菌(Bacillus subtilis,IC50=8 μmol/L、Staphylococcus lentus,IC50=20 μmol/L、Candida glabrata,IC50= 117 μmol/L)显示出抑制活性,对肿瘤细胞显示出中等的生长抑制活性,对牛脑磷酸二酯酶(PDE)有很弱的抑制性(IC50=148 μmol/L),对人磷酸二酯酶(PDE-4B2)显示出微小的抑制活性(IC50=1.46 μmol/L)[15]。
Lu等[16]首次报道了从连云港海岸潮间带海泥中分离出具有广谱抗菌活性的海洋Streptomyces sp.GB-2,并从其次生代谢产物中发现了抗菌物质sisomicin(20),该化合物对11种革兰氏阳性菌和4种革兰氏阴性菌都表现出显著的抑制作用,且有良好的pH和热稳定性,具有氨基糖甙抗生素类的广谱抗菌活性。
Carlson研究组[17]在美国Virgin Islands(维尔京群岛)海洋沉积物中分离到海洋 Streptomyces sp. 307-9,该微生物代谢出2个新的二烯基四酰胺酸类化合物 tirandamycin C(21)和 tirandamycin D (22),它们对耐万古霉素粪肠球菌(Vancomycin-resistant Enterococci faecalis,VRE)有抑制活性。
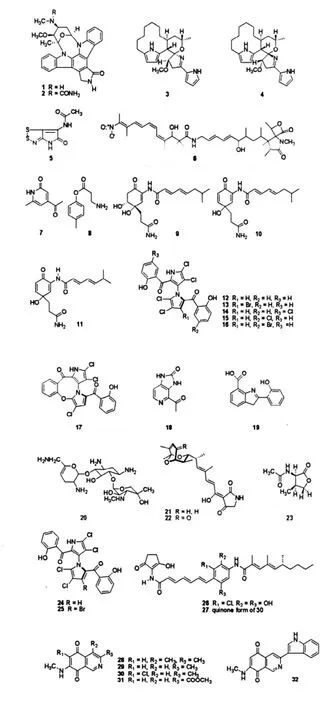
N-Acetyl-γ-hydroxyvaline lactone(23)是一个从巴西圣保罗北海岸海洋沉积物分离的海洋链霉菌菌株SS99BA-2中得到的一个罕见的氨基酸衍生物[18]。
Marinopyrroles A(24)和B(25)是从加利福尼亚La Jolla 51 m深海洋沉积样中分离的海洋Streptomyces sannurensis CNQ-418中得到的生物碱类化合物。它们对MRSA有抗菌活性,最小抑菌浓度(MIC90)小于2 μmol/L;对人结肠癌细胞(HCT-116)的细胞毒性却很微弱[19]。
Chinikomycins A(26)和B(27)是从中国胶州湾海洋沉积物中分离的海洋Streptomyces sp.M045中得到的2个新的抗肿瘤抗生素。它们是典型的侧链具有独特对位取代的64-pABA-2含氯芳香型手霉素衍生物,对不同人类癌细胞都表现出了抗肿瘤活性,但是在抗病毒、抗菌及植物毒素活性实验中均没有表现出生物活性[20]。
Hawas等[21]从德国北海岸南部翡翠湾海洋沉积样中分离出海洋来源Streptomyces sp.Mei37,其代谢出4个新的异喹啉衍生物类生物碱mansouramycins A-D(28,30~32),以及一个已知的化合物3-methyl-7-(methylamino)-5,8-isoquinolinedione(29)。Mansouramycins对36株肿瘤细胞表现出了显著的细胞毒活性,对非小细胞肺癌、乳腺癌、黑素瘤以及前列腺癌细胞也有显著的选择性活性。
2 醌类(quinones)
醌类化合物是天然产物中一类比较重要的活性成分,从海洋沉积物链霉菌属次生代谢产物中分离得到的主要为蒽醌类及其衍生物,它们大多具有较强的生物活性,如抗真菌、抗病毒、抗肿瘤等。
化合物chlorinated dihydroquinones(33~36)是从加利福尼亚La Jolla附近152 m深海洋沉积物分离的海洋链霉菌CNQ-525中得到的苯萘蒽醌类抗生素,此类化合物均具有新颖的碳骨架,其中化合物33~35为首次发现。化合物33~36对MRSA、VRE及人结肠癌细胞(HCT-116)均有较强的细胞毒活性,其中化合物34的抑菌活性较差,但其抗肿瘤活性较强[22]。
化合物37~41是从墨西哥湾海洋沉积物分离的海洋 Streptomyces sp.B8005及 Streptomyces sp.B4842中得到的蒽醌类化合物,其中化合物1-hydroxy-1-norresistomycin(38)、resistoflavin methyl ether(40)为新化合物。化合物resistomycin(37)、resistoflavin(39)和tetracenomycin(41)具有抗肿瘤活性,37和39具有抗病毒及抗原生动物活性。此外,37还具有使血管收缩的作用,可以抑制RNA及蛋白质的合成,但对DNA的合成没有抑制作用。37~41具有抑菌活性,其中38对大肠杆菌、金黄色葡萄球菌及绿色产色链霉菌Streptomyces viridochromo-genes(Tü 57)都具有抑菌效果,但其抑制作用比37弱;化合物40对大肠杆菌、金黄色葡萄球菌、白色念珠菌及枯草芽孢杆菌有一定的抑制作用,其对枯草芽孢杆菌的抑制作用较37强,MIC为3.1 μg/ mL[23]。Adinaryan等[24]还发现化合物41对胃腺癌细胞株HMO2和肝癌细胞株HepG2有细胞毒性,对革兰氏阳性菌和革兰氏阴性菌有较弱的抗菌活性。
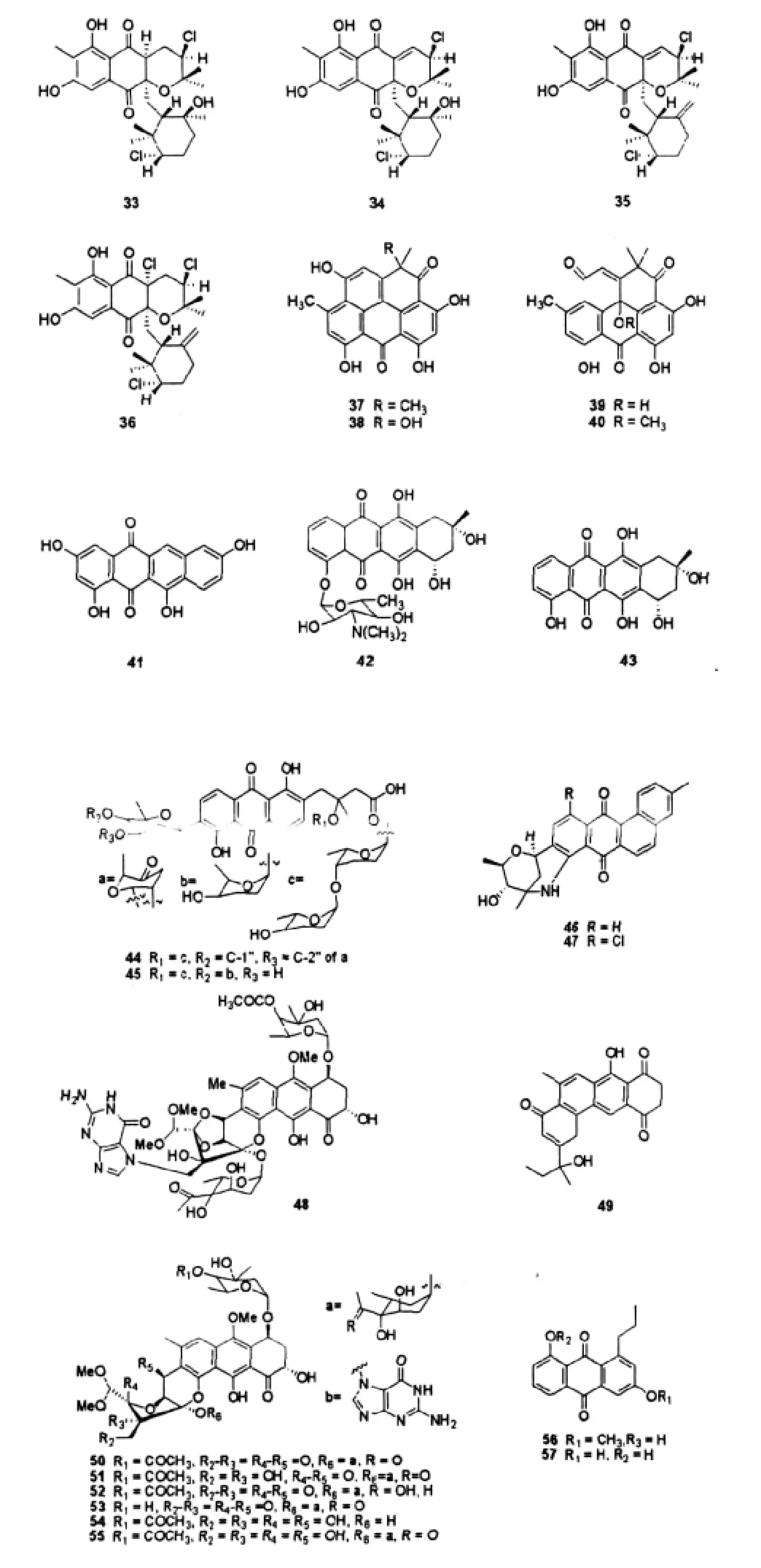
Streptomyces sp.KS3是从印尼Komodo Island海洋沉积物中分离到的一株海洋链霉菌,其次生代谢出一个新的蒽环类抗生素Komodoquinone A(42),以及它的一个糖苷配基Komodoquinone B(43)。化合物42是一个比较独特的蒽环类抗生素,并且发现其可诱导神经瘤细胞Neuro 2A的分化[25]。
Maskey等[26]从印度洋毛里求斯海岸沉积物中分离到海洋Streptomyces sp.B6921,其代谢出2个新的蒽环类抗生素himalomycin A(44)和B(45)。化合物44、45对枯草芽孢杆菌、绿色产色链霉菌、金黄色葡萄球菌及大肠杆菌都表现出较强的抗菌作用。但是没有表现出抗微藻及抗真菌活性。
美国科学家Martin等[27](2007年)从墨西哥Cortez海底沉积样中分离到海洋链霉菌,其次生代谢出2个有细胞毒性的醌类化合物 marmycins A (46)和B(47)。46对人结肠癌细胞HCT-116的抗肿瘤活性是它的氯代衍生物47的18倍,这个结果令人惊讶,因为氯原子一般是增强化合物的药理活性的。
Maskey研究组从墨西哥湾Laguna de Terminos海底沉积物分离的海洋链霉菌 Streptomycete sp.B8652的发酵液中得到gutingimycin(48)[28],parimycin(49)[29],trioxacarcins A-C(50~52)及其3个新的衍生物trioxacarcins D-F(53~55)[30]。化合物48是trioxacarcin A(50)与鸟嘌呤的共轭体,它为蒽醌类抗生素,可以抑制革兰氏阳性菌和革兰氏阴性菌。化合物49除了有抗真菌和抑制微藻生长等活性外,在浓度IC50为0.9~6.7 μg/mL时,也能抑制人肿瘤细胞(胃癌(GXF25IL),乳腺癌(MSF-7和MAXF 401NL)以及黑素瘤(MFXF 462NL和MEXF 514L))。化合物50~55对革兰氏阳性菌和革兰氏阴性菌都表现出了很强的抑菌活性,其中某些还具有极强的抗肿瘤、抗疟原虫活性,同时50也表现出抗真菌活性。
新化合物 8-hydroxy-3-methoxy-1-propylanthraquinone(56)和3,8-dihydroxy-1-propylanthraquinone (57)是从墨西哥湾海洋沉积物分离的海洋Streptomyces sp.B8000次生代谢产物中分离得到的。抗菌活性测试表明,只有化合物57对金黄色葡萄球菌和绿色产色链霉菌表现出了中等的抑制活性,但没有抑菌真菌的活性[31]。
3 内脂类(latctones)
从海洋链霉菌次生代谢产物中分离得到的内酯类化合物一般都具有特殊的结构和显著的生物活性,如抗肿瘤、抗菌、抗病毒等。其中很多已作为抗细菌和抗真菌药物在临床上广泛应用,如红霉素类和多烯大环内酯类等。

Asolkar研究组[32]从太平洋夏威夷岛Pohoiki湾沉积样中分离到海洋链霉菌株B7064。抗菌活性跟踪筛选得到大环内酯类化合物chalcomycin A(58)和chalcomycin B(59),前者为已知化合物,后者为新化合物。化合物59对枯草杆菌及金黄色葡萄球菌等的最小抑菌浓度与红霉素相当,MIC分别达到6.25 μg/mL和0.39 μg/mL,显示出其高效的抗菌活性。此外,59还具有微弱的植物毒素活性。
丁玲[33]从胶州湾海岸沉积物中分离到海洋Streptomyces sp.M491,从该菌株发酵液乙酸乙酯萃取物中分离得到新颖的大环内酯类化合物chalcomycin C(60)和chalcomycin D(61),化合物60、61对枯草芽孢杆菌、金黄色葡萄球菌及大肠杆菌的抑制作用较化合物58弱,但具有较强的细胞毒活性,平均IC50分别为0.027、0.007 μg/mL(58为0.015 μg/mL)。
Streptomyces aureoverticillatus NPS001583[34]是来自于海底沉积物的海洋链霉菌,它能代谢出一种22个原子的大环内酯类化合物 aureoverticillactam (62)。该化合物具有新颖的碳骨架,对肠腺癌细胞(HT-29)、黑色素瘤细胞(B16-F10)及白血病细胞(Jurkat)都表现出了中等的细胞毒活性。
从韩国Tongyoung Bay水下25 m沉积物中分离到Streptomyces sp.M02750,其代谢出MKN-(003A-003C)(63~65)和MKN-(004A-004D)(66~69),其中63~65、67~69为新化合物,在结构上与抗霉素类的抗真菌剂相关[35]。Xu等[36]从西太平洋5100 m深沉积物分离的海洋 Streptomyces albidoflavus UST040711-291发酵液中也得到了不饱和内酯化合物63~65,并首次报道了它们具有强防污损活性及相对较小的毒性,使得这些化合物有希望成为新的防污损添加剂。Albidopyrone(70)是从大西洋海底沉积物分离的链霉菌NTK-227菌株中得到的一个新的内酯类化合物。其不论是对革兰阴性菌(大肠杆菌和假单胞菌(Pseudomonas fluorescens))和革兰阳性菌(枯草芽孢杆菌),还是光滑假丝酵母(Candida glabrata)都没有表现出生长抑制活性;但对蛋白酪氨酸磷酸酶(PTP1B)有中等的抑制活性,IC50为128 μg/mL[37]。
4 萜类(terpenoids)
海洋萜类天然化合物主要来源于海洋藻类、海绵和珊瑚动物,从海洋放线菌链霉菌属中分离得到的萜类化合物相对较少,且生物活性较弱。
3-oxo-T-muurolol(71),11-hydroxy-T-muurolol (72),15-hydroxy-T-muurolol(73),11,15-dihydroxy-T-muurolol(74),T-muurolol(75),3α-hydroxy-T-muurolol(76)和 3-oxo-5,15-dihydroxy-T-muurolol (77)是从中国青岛胶州湾海洋沉积物分离的Streptomyces sp.M491发酵液中分离得到的衣兰油烷型倍半萜类化合物,其中73和74为新化合物。对其进行人类37种肿瘤细胞实验,结果表明只有化合物73具有微弱的细胞毒活性,IC50=6.7 μg/mL,其余均未表现出细胞毒活性(IC50>10 μg/mL)[38]。71、72、77对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌及供试微藻和真菌均无明显的抑制作用[39]。
Motohashi研究组[40]从日本德岛(Tokushima)海洋沉积物中分离到海洋Streptomyces sp.MS239,合物79对枯草芽孢杆菌(B.subtilis ATCC6633)表现出弱的抗菌活性,MIC为64 μg/mL;对金黄色葡萄球菌(S.aureus 209PJC-1)和屎肠球菌(Enterococcus faecom ATCC19434)没有活性(MIC>64 μg/mL)。化合物78没有表现出抗菌作用(MIC>64 μg/mL)。
角鲨烯(Squalene)是由6个异戊二烯组成的三萜,具有抗肿瘤、抑制心血管疾病和增强免疫力的功能。Fontana等[41]从英属哥伦比亚夏洛特女王群岛40 m深海洋沉积物分离的海洋 Streptomyces sp.QC45B中分离得到三萜类化合物squalene(80)及其代谢出2个新的萜类化合物5-dimethylallylindole-3-carboxylic acid(78)和 A80915G-8''-acid(79)。化其衍生物2,3-dihydrosqualene(DHSQ,81)和tetrahydrosqualene(THSQ,82)。
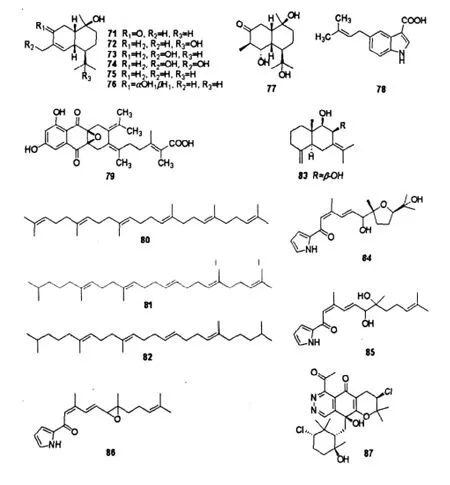
化合物 selina-4(14),7(11)-diene-8,9-diol (83)是从青岛胶州湾海洋沉积物分离的海洋Streptomyces sp.QD518中代谢出的一个新的倍半萜。在浓度为80 mg/paper disk时,其没有表现出生物活性[6]。
Streptomyces sp.(NPS008187)[42]是从阿拉斯加海洋沉积物中分离出的海洋链霉菌,其代谢出3个新的吡咯型倍半萜glaciapyrroles A-C(84~86),其中化合物84对人结肠癌细胞(HT-29)及黑色素瘤细胞(B16-F10)的生长有抑制作用,IC50为180 μmol/L。
化合物azamerone(87)是从关岛海洋沉积物分离的海洋链霉菌CNQ766菌株次生代谢产物中得到的新的混源萜类化合物,该化合物为首次报道的含有二氮杂萘酮环(Phthalazione ring)的天然产物,对小鼠脾淋巴细胞和巨噬细胞有较弱的细胞毒活性,IC50为40 μmol/L[43]。
5 肽类(peptide)
肽类化合物是由氨基酸以肽键相连组成的一大类抗生素,它是海洋沉积物来源链霉菌活性代谢产物的一个重要组成部分,并且都具有较强的生物活性。其中环肽类化合物具有多方面的生物活性(如抗肿瘤、抗菌、抗疟、抗炎、抑制酪氨酸酶、免疫抑制等),在化学和生命体系中有着广泛的应用。
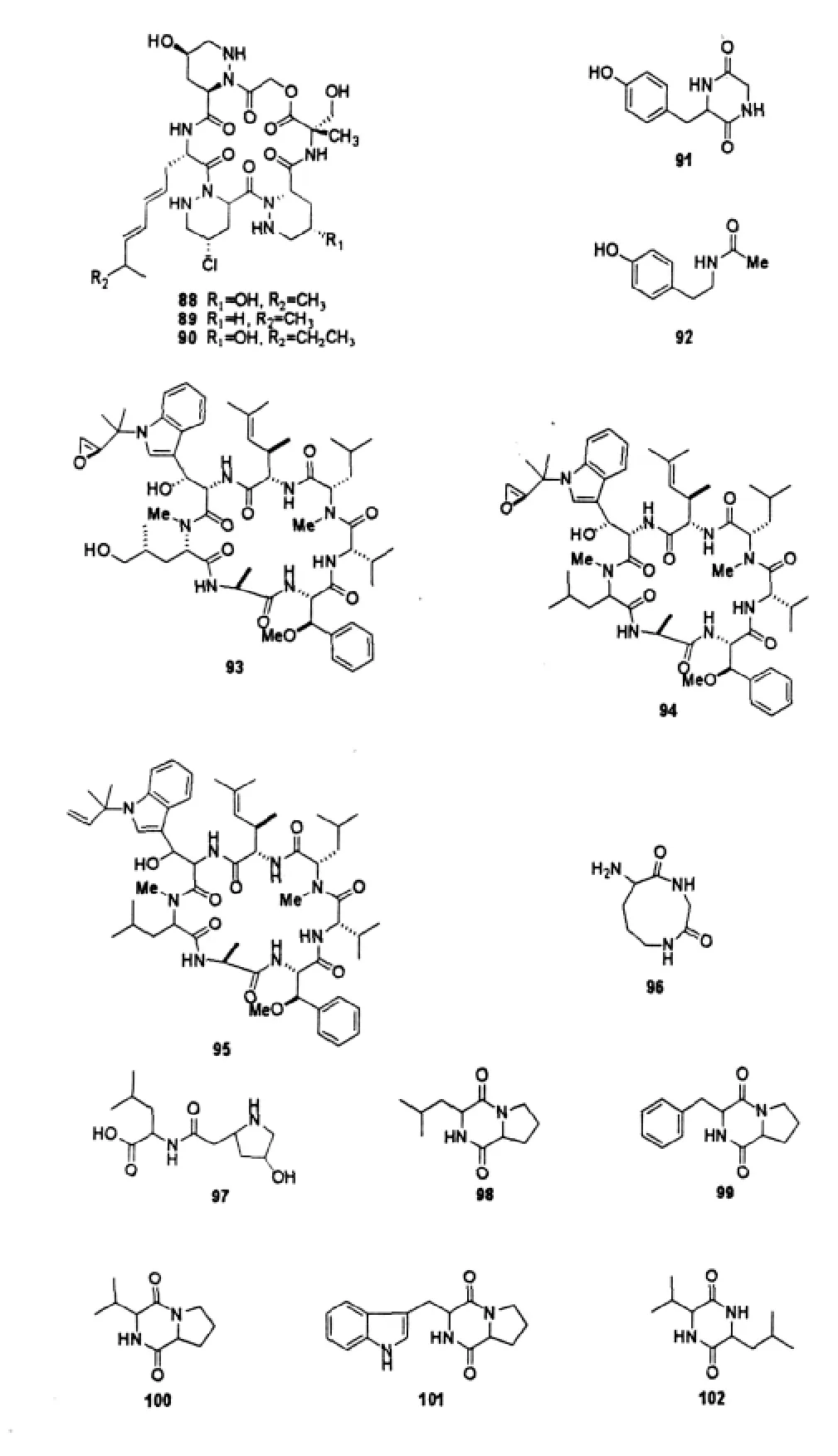
Miller等[44]在关岛附近海底沉积物中分离到一株海洋链霉菌CNQ-593,其次生代谢产物环六肽内酯经光谱、化学、晶体分离及结构鉴定,得到3个有效的抗肿瘤细胞毒素piperazimycins A-C(88~90)。这些化合物对人结肠癌细胞(HCT-116)均有细胞毒活性,平均GI50为76 ng/mL。美国国家癌症研究所(NCI)应用60株人肿瘤细胞进行抗肿瘤药物筛选,发现piperazimycin A(88)在体外对大多数肿瘤细胞有显著的抗肿瘤活性,平均GI50为100 nmol/L,其中对黑色素瘤细胞、中枢神经瘤细胞及前列腺癌细胞的毒性较强,LC50分别为0.3、0.4、0.6 μmol/L。
Sobolevskaya等[45]从日本海海底沉积物分离的Streptomyces sp.KMM 7210中发现了一个新的二肽类化合物3-(4-hydroxybenzyl)piperazine-2,5-dione (91),以及一个已知的化合物N-[2-(4-hydroxyphenyl)ethyl]acetamide(N-acetyltyramine)(92),它们对革兰阳性菌有抗菌作用,并且对海胆S.intermedius配子有细胞毒性效应。
Cyclomarins A-C(93~95)是从加州圣地亚哥米森湾海洋沉积样分离的Streptomycete sp.CNB-982中得到的3个新的、结构中含有四个特殊氨基酸的环七肽类化合物,三者的区别在于结构中部分片段不同。该菌株的主要代谢产物cyclomarin A(93)在由佛波酯诱导的小鼠耳肿胀实验中表现出显著的局部抗炎活性(体内水肿抑制率为45%,体外浮肿抑制率为92%)[46]。
化合物8-amino-[1,4]diazonane-2,5-dione(96)和leucyl-4-hydroxyproline(97)是从巴西海洋沉积物分离的海洋链霉菌acrimycini中得到的二肽类化合物。96的大环碳骨架8-amino-[1,4]diazonane-2,5-dione非常少见,先前只在海洋细菌Marinobacter sp.分离的含铁细胞中有过报道[47]。
5个二酮哌嗪类化合物 cyclo-(L-Leu-L-Pro) (98)、cyclo-(L-Phe-L-Pro)(99)、cyclo-(L-Val-LPro)(100)、cyclo-(L-Trp-L-Pro)(101)以及cyclo-(L-Leu-L-Val)(102)是从西太平洋海底5000 m深海域采集沉积样分离的链霉菌Streptomyces fungicidicus菌株中首次得到的。对它们做了抗Balanus amphitrite(纹藤壶)幼虫附着活性实验,5个化合物的EC50范围为0.10~0.28 mmol/L,LC50范围为0.47-0.75 mmol/L,LC50/EC50的疗效率为 1.7~7.5。数据表明这些化合物有可能成为新的防污剂[48]。
6 其它
近几年,国内外对海洋沉积物来源链霉菌活性产物的研究报道日益增多,除以上报道的化合物结构类型外,还包括:脂肪酸类、黄酮类、苯酚类、γ-呋喃酮类、苯并吡喃酮类等,它们具有较好的生物活性。
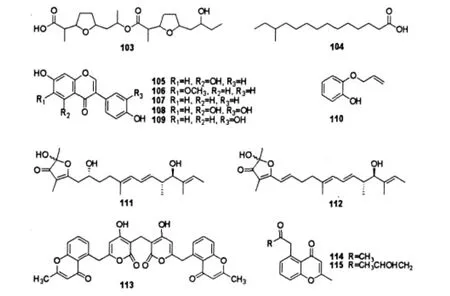
脂肪酸类:Schumacher研究组[49]从美国夏威夷群岛海洋沉积样中分离到海洋 Streptomyces sp.BD21-2,其代谢出脂肪酸bonactin(103),该化合物对革兰阳性菌、革兰阴性菌以及真菌都表现出抗菌活性。这是首次报道非环状酯类化合物具有抗菌活性。化合物12-methyltetradecanoic acid(104)[50]是从太平洋中部5774 m深海沉积物分离的海洋Streptomyces sp.UST040711-290中分离得到的一个支链脂肪酸,并且发现其能够抑制华美盘管虫(H.elegans)幼虫的附着,最小IC50>80 μg/mL,最大LC50为0.6 μg/mL。这是首个支链脂肪酸被证明有防污损的生物活性。
黄酮(flavonoids)多存在于高等植物及羊齿类植物中,而藻类、微生物、细菌中几乎没有发现黄酮类化合物的存在,但是Hu等[51]从中国南海海洋链霉菌060524菌株的次生代谢产物中分离到5个异黄酮:genistein(105),glycitein(106),daidzein (107),3',4',5,7-tetra-hydroxyisoflavone(108)和3',4',7-trihydroxyisoflavone(109)。化合物105和107的衍生物3'-hydroxygenistein和3'-hydroxydaidzein比它们各自本身对人慢性白血病细胞K562具有更强的细胞毒活性抑制能力。
苯酚类:Streptomyces sp.MS1/7[52]是从印度洋孟加拉湾海洋沉积物中分离到的海洋链霉菌,其代谢出一个苯酚类化合物2-Allyloxyphenol(110),该化合物是一类合成药物和化学中间体,而作为天然产物则是首次得到。活性测试表明其对21种细菌和3种真菌都有抑制活性,最小抑菌浓度范围为0.2~1.75 mg/mL,同时还具有强抗氧化性质(IC50为22 μg/mL)。由于化合物110不存在溶血毒性、潜在的致癌性、细胞毒性以及没有文献报道它的毒性反应,这使得其有可能应用于食品防腐剂和口腔消毒。
γ-呋喃酮:Cho等[53]从关岛500 m深的海洋沉积物中分离出海洋链霉菌株CNQ766,并从其次生代谢产物中得到2个新的γ-呋喃酮类化合物actinofuranones A(111)和B(112)。
苯并吡喃酮:phaeochromycins F(113)、G (114)、H(115)是从西太平洋深海沉积物分离的海洋Streptomyces sp.DSS-18的次生代谢产物中得到的3个新的苯并吡喃酮类化合物。化合物113和114对HeLa细胞株有较弱的细胞毒性,在浓度为10 μg/mL时抑制率分别为9.4%和1.0%;而化合物115则表现出中等的抑制率(46.0%)[54]。
7 结语
海洋是一个开放的、复杂的生态系统,生活着几十万种动、植物和上亿种微生物。海洋沉积物作为一个巨大的资源宝库,从其附生的微生物中寻找新的高活性化合物已成为天然产物研究的新领域。可以预见,随着深海样本采集技术进步,微生物分离方法、培养手段以及天然分离纯化技术的进一步发展改进,新的筛选模型不断应用,以及微量化合物分析、分离手段的建立,人们将从海洋沉积物链霉菌中获取更多高效、低毒的活性化合物,研制出更多新型药物,更好地治疗人们的疾病。
我国具有辽阔的海域,海洋微生物种类繁多、分布广泛,海洋沉积物微生物资源非常丰富,如果重视这一宝贵资源的开发利用,将会有更多的具有自主产权的新药问世。
1 Bull AT,et al.Marine actinobacteria:perspectives,challenges,future directions.Antonie Van Leeuwenhoek,2005,87: 65-79.
2 Blunt JW,et al.Marine natural products.Nat Prod Rep,2011,28:196-268.
3 Blunt JW,et al.Marine natural products.Nat Prod Rep,2010,27:165-237.
4 Blunt JW,et al.Marine natural products.Nat Prod Rep,2009,26:170-244.
5 Hu JC,et al.Staurosporine produced by marine-derived actinomycete Streptomyces roseoflavus MB-97 isolated from coastal sediment.J Biotechnol,2008,136S:S585-S586.
6 Wu SJ,et al.N-Carboxamido-staurosporine and selina-4 (14),7(11)-diene-8,9-diol,new metabolites from a marine Streptomyces sp..J Antibiot,2006,59:331-337.
7 Boonlarppradab C,et al.Marineosins A and B,cytotoxic spiroaminals from a marine-derived actinomycete.Organic Letters,2008,10:5505-5508.
8 Cui HX(崔洪霞),et al.Streptomyces sp.M095 from Jiaozhou bay produces inhibitory-fungal antibiotic,holomycin.Chin J Mar Drugs(中国海洋药物),2006,25:11-15.
9 Manam RR,et al.Lajollamycin,a nitro-tetraene spiro-β-lactone-γ-lactam antibiotic from the marine actinomycete Streptomyces nodosus.J Nat Prod,2005,68:240-243.
10 Jeong SY,et al.Streptokordin,a new cytotoxic compound of the methylpyridine class from a marine-derived Streptomyces sp.KORDI-3238.J Antibiot,2006,59:234-240.
11 Xie XC(解修超).Isolation and identification of the endophytic actinomycetes from mangrove and isolation and identification of the bioactive metabolites of two marine Streptomyces.Danzhou:South China University of Tropical Agriculture (华南热带农业大学),PhD.2007.
12 Asolkar RN,et al.Daryamides A?C,weakly cytotoxic Polyketides from a marine-derived actinomycete of the genus Streptomyces strain CNQ-085.J Nat Prod,2006,69:1756-1759.
13 Hughes CC,et al.Structures,reactivities,and antibiotic Properties of the marinopyrroles A-F.J Org Chem,2010,75: 3240-3250.
14 Rahman H,et al.An imidazopyridinone and further metabolites from Streptomycetes[1].Nat Prod Commun,2009,4: 965-970.
15 Hohmann C,et al.Caboxamycin,a new antibiotic of the benzoxazole family produced by the deep-sea strain Streptomyces sp.NTK 937.J Antibiot,2009,62:99-104.
16 Lu YJ,et al.Characterization and identification of a novel marine Streptomyces sp.produced antibacterial substance.Mar Biotechnol,2009,11:717-724.
17 Carlson JC,et al.Isolation and characterization of tirandamycins from a marine-derived Streptomyces sp..J Nat Prod,2009,72:2076-2079.
18 Hernandez ILC,et al.N-acetyl-γ-hydroxyvaline lactone,an unusual amino acid derivative from a marine Streptomycete.J Nat Prod,2000,63:664-665.
19 Hughes CC,et al.The marinopyrroles,antibiotics of an unprecedented structure class from a marine Streptomyces sp..Org Lett,2008,10:629-631.
20 Li FC,et al.Chinikomycins A and B:isolation,structure elucidation,and biological activity of novel antibiotics from a marine Streptomyces sp.isolate M045.J Nat Prod,2005,68: 349-353.
21 Hawas UW,et al.Mansouramycins A-D,cytotoxic isoquinolinequinones from a marine Streptomycete.J Nat Prod,2009,72:2120-2124.
22 Soria-Mercado IE,et al.Antibiotic terpenoid chloro-dihydroquinones from a new marine actinomycete.J Nat Prod,2005,68:904-910.
23 Kock I,et al.1-Hydroxy-1-norresistomycin and resistoflavin methyl ether:new antibiotics from marine-derived Streptomycetes.J Antibiot,2005,58:530-534.
24 Adinaryan G,et al.Cytotoxic compounds from the marine actinobacterium Streptomyces corchorusii AUBN(1)/7.Russ J Bioorg Chem,2006,32:295-300.
25 Itoh T,et al.Komodoquinone A,a novel neuritogenic anthracycline,from marine Streptomyces sp.KS3.J Nat Prod,2003, 66:1373-1377.
26 Maskey RP,et al.Himalomycin A and B:isolation and structure elucidation of new fridamycin type antibiotics from a marine Streptomyces Isolate.J Antibiot,2003,56:942-949.
27 Martin GDA,et al.Marmycins A and B,cytotoxic pentacyclic c-glycosides from a marine sediment-derived actinomycete related to the genus Streptomyces.J Nat Prod,2007,70: 1406-1409.
28 Maskey RP,et al.Gutingimycin:a highly complex metabolite from a marine Streptomycete.Angew Chem Int Ed,2004,43: 1281-1283.
29 Maskey RP,et al.Parimycin:isolation and structure elucidation of a novel cytotoxic 2,3-dihydroquinizarin analogue of gamma-indomycinone from a marine streptomycete isolate.J Antibiot,2002,55:1031-1035.
30 Maskey RP,et al.Anti-cancer and antibacterial trioxacarcins with high anti-malaria activity from a marine Streptomycete and their absolute stereochemistry.J Antibiot,2004,57:771-779.
31 Poumale HMP,et al.New anthraquinones from a marine Streptomyces sp.isolation,structure determination and biological activities.Z Naturforsch B,2006,61:1450-1454.
32 Asolkar RN,et al.Chalcomycin B,a new macrolide antibiotic from the marine isolate streptomyces sp.B7064.J Antibiot,2002,55:893-898.
33 Ding L(丁玲).Study on the secondary metabolites from eight marine-derived microbes.Qingdao:Graduate University of Chinese Academy of Sciences(中国科学院研究生院),PhD.2008.
34 Mitchell SS,et al.Aureoverticillactam,a novel 22-atom macrocyclic lactam from the marine actinomycete Streptomyces aureoverticillatus.J Nat Prod,2004,67:1400-1402.
35 Cho KW,et al.New lactone-Containing metabolites from a marine-derived bacterium of the genus Streptomyces.J Nat Prod,2001,64:664-667.
36 Xu Y,et al.Potent antifouling compounds produced by marine Streptomyces.Bioresource Technol,2010,101:1331-1336.
37 Hohmann C,Schneifer K,Brunter C,et al.Albidopyrone,a new α-pyrone-containing metabolite from marine-derived Streptomyces sp.NTK 227.J Antibiot,2009,62:75-79.
38 Ding L,et al.T-Muurolol sesquiterpenes from the marine Streptomyces sp.M491 and revision of the configuration of previously reported amorphanes.J Nat Prod,2009,72:99-101.
39 Wu SJ,et al.Amorphane sesquiterpenes from a marine Streptomyces sp..J Nat Prod,2007,70:304-306.
40 Motohashi K,et al.Studies on terpenoids produced by actinomycetes. 5-dimethylallylindole-3-carboxylic acid and A80915G-8"-acid produced by marine-derived Streptomyces sp.MS239..J Antibiot,2008,61:75-80.
41 Fontana A,et al.Evidence for the biosynthesis of squalene via the methylerythritol phosphate pathway in a Streptomyces sp.obtained from a marine sediment.J Org Chem,2001,66: 6202-6206.
42 Macherla VR,et al.Glaciapyrroles A,B,and C,pyrrolosesquiterpenes from a Streptomyces sp.Isolated from an Alaskan marine sediment.J Nat Prod,2005,68:780-783.
43 Cho JY,et al.Azamerone,a terpenoid phthalazinone from a marine-derived bacterium related to the genus Streptomyces (Actinomycetales).Org Lett,2006,8:2471-2474.
44 Miller ED,et al.Piperazimycins:cytotoxic hexadepsipeptides from a marine-derived bacterium of the genus Streptomyces.J Org Chem,2007,72:323-330.
45 Sobolevskaya MP,et al.Bioactive metabolites of the marine actinobacterium Streptomyces sp.KMM 7210.Russ Chem B,2007,56:838-840.
46 Renner MK,et al.Cyclomarins A-C,new antiinflammatory cyclic peptides produced by a marine bacterium(Streptomyces sp.).J Am Chem Soc,1999,121:11273-11276.
47 Hernández ILC,et al.Dipeptide metabolites from the marine derived bacterium Streptomyces acrymicini.J Braz Chem Soc,2004,15:441-444.
48 Li XC,et al.Antifouling diketopiperazines produced by a deep-sea bacterium,Streptomyces fungicidicus.Biofouling,2006,22:187-194.
49 Schumacher RW,et al.Isolation and structure determination of an antimicrobial ester from a marine sediment-derived bacterium.J Nat Prod,2003,66:1291-1293.
50 Xu Y,et al.Inhibitory effects of a branched-chain fatty acid on larval settlement of the polychaete hydroides elegans.Mar Biotechnol,2009,11:495-504.
51 Hu SC,et al.Biotransformation of soybean isoflavones by a marine Streptomyces sp.060524 and cytotoxicity of the products.World J Microbiol Biotechnol,2009,25:115-121.
52 Arumugam M,et al.Isolation of an unusual metabolite 2-allyloxyphenol from a marine actinobacterium,its biological activities and applications.Appl Microbiol Biotechnol,2010,86: 109-117.
53 Cho JY,et al.Actinofuranones A and B,polyketides from a marine-derived bacterium related to the genus Streptomyces (Actinomycetales).J Nat Prod,2006,69:425-428.
54 Li J,et al.Phaeochromycins F– H,three new polyketide metabolites from Streptomyces sp.DSS-18.Beilstein J Org Chem,2008,4:46.
Research Advances on Secondary Metabolites and Bioactivity for the Marine Sediment-Derived Streptomyces
HUANG Yong-zhong1,LUO Xiong-ming2,WANG Jian-hua1*1Bioengineering college,Chongqing University,Chongqing 400044,China;2South China Sea Institute of Oceanology Chinese Academy of Sciences,Guangzhou 510301,China
Marine sediment is a abundant nutrition habitat for microbes.In recent years,a large number of marine streptomyces were isolated from marine sediments,of which some new genera and species were also obtained.Many medicinal active compounds have been found from the marine sediment-derived streptomyces,which promoted the development of marine natural product chemistry and provided the basis for research and development of new drugs.In this paper,types of structures and bioactivities of secondary metabolites produced by marine sediment-derived streptomyces have been briefly reviewed.
marine sediment;Streptomyces;secondary metabolites;biological activity
1001-6880(2011)04-0758-09
2011-04-25 接受日期:2011-06-20
国家科技支撑计划项目(2007BAD51B05),重庆市科技攻关计划项目(CSTC2009AB1043),国家青年基金项目(41006091)
*通讯作者 Tel:86-23-65102507;E-mail:wjh@cqu.edu.cn
R284.2
A
