高速逆流色谱对大黄蒽醌类成分的分离研究
2011-11-23周东斌林顺权高俊飞
袁 萍,周东斌,林顺权,高俊飞,何 浏,袁 晓*
1中国科学院武汉植物园,武汉430074;2牌牌科技有限公司,广州510540
高速逆流色谱对大黄蒽醌类成分的分离研究
袁 萍1,周东斌2,林顺权1,高俊飞1,何 浏1,袁 晓1*
1中国科学院武汉植物园,武汉430074;2牌牌科技有限公司,广州510540
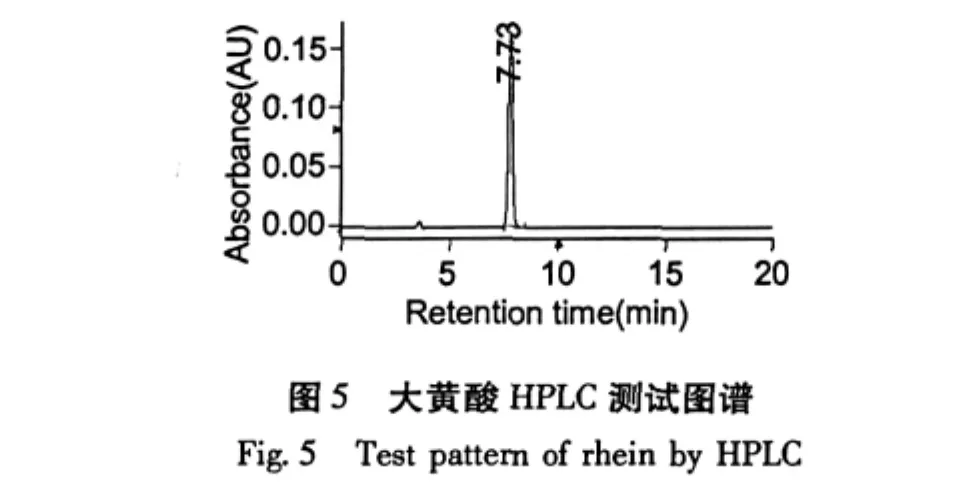
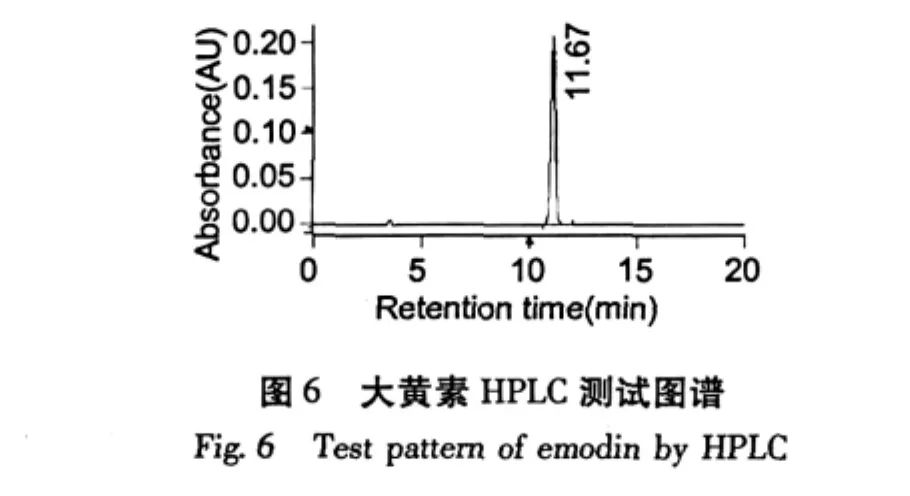
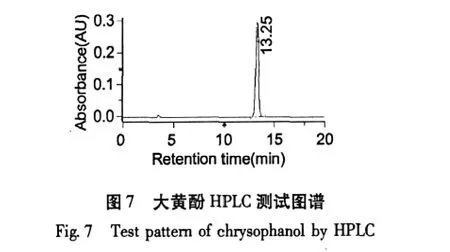
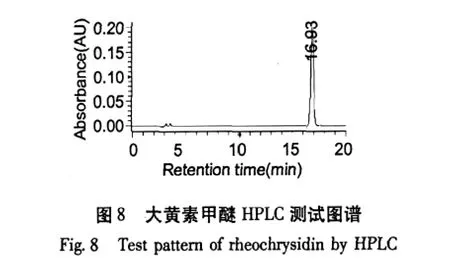
利用高速逆流色谱对大黄中的5个蒽醌活性成分进行了分离,当两相溶剂系统的组成是石油醚∶乙酸乙酯∶甲醇∶水=8∶2∶8∶1时,分离出大黄素;当两相溶剂比为3∶4∶3∶2时,分离出大黄酸和芦荟大黄素;当溶剂比为12∶2∶12∶1时,分离出大黄酚和大黄素甲醚;经高压液相色谱检测大黄素、大黄酸和芦荟大黄素、大黄酚和大黄素甲醚的含量分别为98.81%、99.15%、98.51%、98.89%和98.16%。
高速逆流色谱;芦荟大黄素;大黄酸;大黄素;大黄酚;大黄素甲醚;分离
大黄为蓼科植物掌叶大黄(Rheum palmatum L.)、药用大黄(R.officinale Baill.)或唐古特大黄(R.tanguticum Maxim.ex Balf.)的根及根茎,是我国重要的传统中药之一,具有抗菌、抗病毒、消炎止血及降血脂等多种功效,在临床上有重要作用。大黄也是我国重要的出口药材,现在世界上许多国家将大黄收录在药典中,可以说大黄已经成为世界性的药物,各国的科学工作者对大黄所含的化学物质进行了许多深入研究,以求建立起简便快速分离大黄品种优劣的方法。目前从大黄属分离出成分160多种,主要包括蒽醌类、蒽酚酮及其酯衍生物、双蒽酮类等。大黄药用成分主要为大黄酸、大黄素、芦荟大黄素、大黄酚和大黄素甲醚以及它们与糖苷生成的结合型蒽醌[3].
1 材料和方法
1.1 材料
HPD-100大孔吸附树酯由沧州宝恩吸附材料科技有限公司提供,大黄(Rheum palmatum L)干燥根茎由湖北省中药材公司提供。
1.2 仪器与药品
OptichromeTM-A半制备J型螺旋管行星式高速逆流色谱仪;江阴逆流科技有限公司生产;检测器为UV3000紫外检测器。L-2000型高压液相色谱;日本日立公司生产。5L/25型低温冷却循环泵,由巩义市予华仪器有限责任公司生产;试剂均为分析纯,
1.3 方法和条件
1.3.1 游离蒽醌的提取
将10 kg大黄干燥茎块切片,粉碎后过2号筛,分别装入5000 mL三角瓶,加入量为三角瓶容量的1/5,分别倒入95%的乙醇。置入超声仪中超声30 min,过滤出溶液后,回收溶剂。将回收的溶剂再倒入三角瓶,继续超声,重复以上操作3次,得到乙醇提取干浸膏。将乙醇干浸膏与氯仿按重量比1∶5比例置入三角瓶里萃取超声,抽滤、浓缩萃取液,再将回收的溶剂重新倒入装乙醇浸膏的瓶里继续超声萃取、抽滤、浓缩,重复3次得到游离蒽醌的氯仿萃取物。继续将氯仿萃取后的渣置入三角瓶中,用20%的硫酸和氯仿在水浴上回流4~5 h,稍放冷,过滤,分离出氯仿层,用水洗至中性,回收氯仿后,得到游离蒽醌,合并2次提取物,得到总的游离蒽醌[4,5]。
1.3.2 大黄素的分离
1.2 文字图像二值化 经过灰度处理的彩色图像还须经过二值化处理将文字与背景进一步分离开。所谓二值化,就是将彩色值图像信号转化成只有黑(0)和白(1)的二值图像信号。二值化效果的好坏,会直接影响灰度文本图像的识别率。二值化处理的具体经验有很多〔11-12〕,方法大致可以分为局部阈值二值化和整体阈值二值化。本文参考基于k中心点聚类的图像二值化方法〔13〕,采用局部阈值二值化,将方块苗文图像分割为互不相交的若干个w×w的小窗口,在每个窗口中求得所辖像素的灰度平均值,经添加惩罚项后作为初步阈值进行二值化处理,继而对各小方块进行二值化变换,各个阈值的计算公式如下:
HSCCC两相溶剂系统的组成是石油醚∶乙酸乙酯∶甲醇∶水(体积比为8∶2∶8∶1),混合前总体积为1L,充分摇匀后,在室温下静置过夜,使用前分离。上相作为固定相,下相作为流动相,上相与下相的体积比约为2∶3。用甲醇清洗逆流的管柱,然后用空气压缩机将甲醇吹出,用泵把固定相以10 mL/min速度泵入管柱,待管子的另一侧有固定相出来后停止泵入固定相,然后主机反转1100 r/min,以3 mL/ min泵入流动相,待流出来的液体与固定相的液体产生浑浊,继续以3 mL/min泵入流动相,直到工作站上的基线走平则柱子已平衡,取干燥后的游离蒽醌的氯仿萃取物约200 mg,用20 mL流动相超声溶解,超滤后(滤膜孔径为0.45 μm)用注射器进样;流动相的速度为3 mL/min;检测器的波长为220 nm[6]。仪器检测出峰时开始收集流份,其监测图如图1,根据图1中的3个峰面积收集溶液,经TLC检测,相同的化合物分为3组合并。
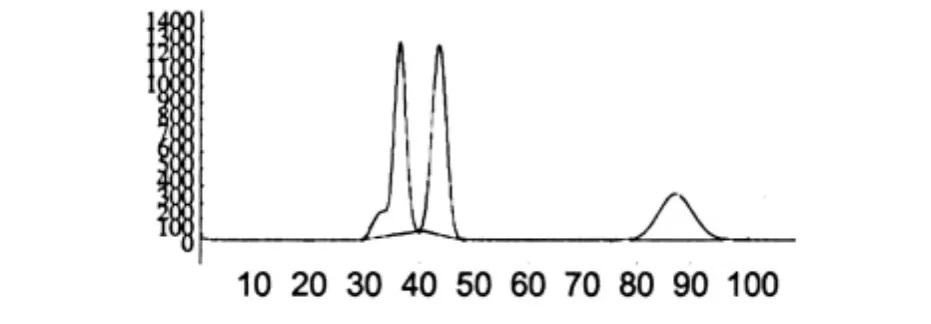
图1 用HSCCC分离大黄素的监测图Fig.1 Separation of emodin by HSCCC
1.3.3 芦荟大黄素和大黄酸的分离
HSCCC两相溶剂系统的组成是石油醚∶乙酸乙酯∶甲醇∶水(体积比为3∶4∶3∶2),对收集的第1组化合物继续分离,HSCCC其他的操作条件和方法同1.3.2一样。仪器检测出峰时开始收集流份,其监测图如图2,根据图2中的2个峰面积收集溶液。
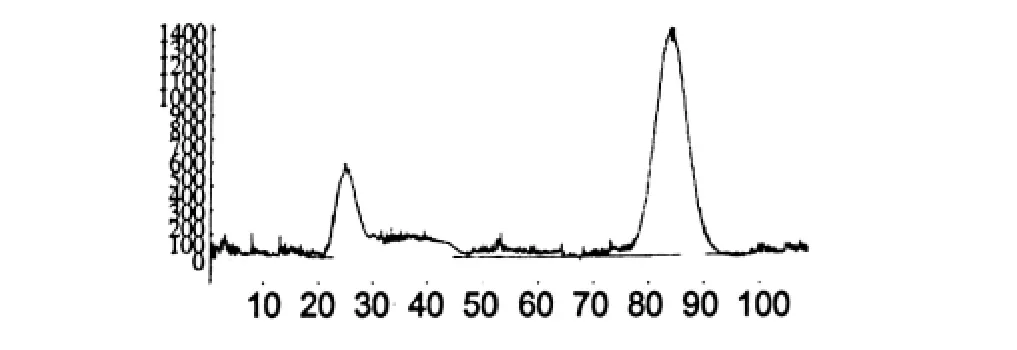
图2 用HSCCC分离芦荟大黄素和大黄酸的监测图Fig.2 Separation of aloe emodin and rhein by HSCCC
1.3.4 大黄酚和大黄素甲醚的分离
HSCCC两相溶剂系统的组成是石油醚∶乙酸乙酯∶甲醇∶水(体积比为12∶2∶12∶1),对收集的第3组化合物继续分离,HSCCC其他的操作方法同1.3.2一样,仪器检测出峰时开始收集流份。其监测图如图3根据图3中的2个峰面积收集溶液,对收集的2个化合物重结晶,大黄酚用适量的乙酸乙酯在96℃下热熔,过滤,室温静置析出黄色片晶,大黄素甲醚用适量丙酮在96℃下热熔,过滤,室温静置析出金黄色针晶,2个晶体用石油醚洗晶。
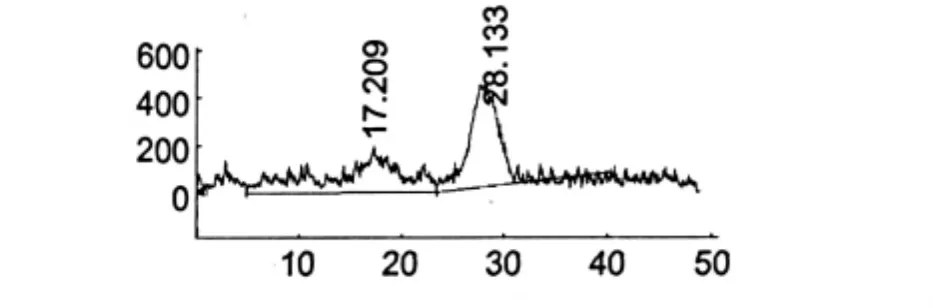
图3 用HSCCC分离大黄酚和大黄素甲醚的监测图Fig.3 Separation of chrysophanol and rheochrysidin by HSCCC
1.3.5 高压液相色谱检测条件
色谱柱为Fortis C18(250*4.6 mm,5 μm);流动相A为甲醇∶乙酸乙酯(4∶1)加0.3%的甲酸;流动相B为0.3%甲酸;流速为1 mL/min;检测波长为430 nm[7,8]进样量为30 μL,用A和B梯度洗脱的条件为;当A的浓度为80%~95%时,洗脱时间为30 min,当A的浓度为95~100时,洗脱时间为15 min。
2 结果
当溶剂系统体积比为石油醚∶乙酸乙酯∶甲醇∶水=8∶2∶8∶1时(图1),收集到的第一个峰的溶液,经TLC检测为2个化合物,为芦荟大黄素和大黄酸,第2个峰为大黄素,第3个峰为2个化合物,为大黄酚和大黄素甲醚。收集的第2个峰(大黄素)的液体放置12 h后自然结晶。当溶剂系统体积比为石油醚∶乙酸乙酯∶甲醇∶水=3∶4∶3∶2时(图2),对收集第1个峰重新分离,重新分离后,收集到的第一个峰为芦荟大黄素,第2个峰为大黄酸。当溶剂系统用石油醚∶乙酸乙酯∶甲醇∶水体积比为12∶2∶12∶1时(图3),对第3个峰重新分离,重新分离后,收集到的第一个峰为大黄酚,第2个峰为大黄素甲醚。
200 mg氯仿萃取物经过HSCCC分离得到大黄酸37.8 mg,得率为18.90%;大黄素32.1 mg,得率为16.05%;芦荟大黄素11.7 mg,得率为5.85%;大黄酚40.9 mg,得率为20.45%;大黄素甲醚19.0 mg,得率为9.50%。
经高压液相色谱用外标法检测,大黄素单体纯度为98.81%;大黄酸为99.15%;芦荟大黄素98.51%;重结晶后大黄酚为98.89%;大黄素甲醚为98.16%。
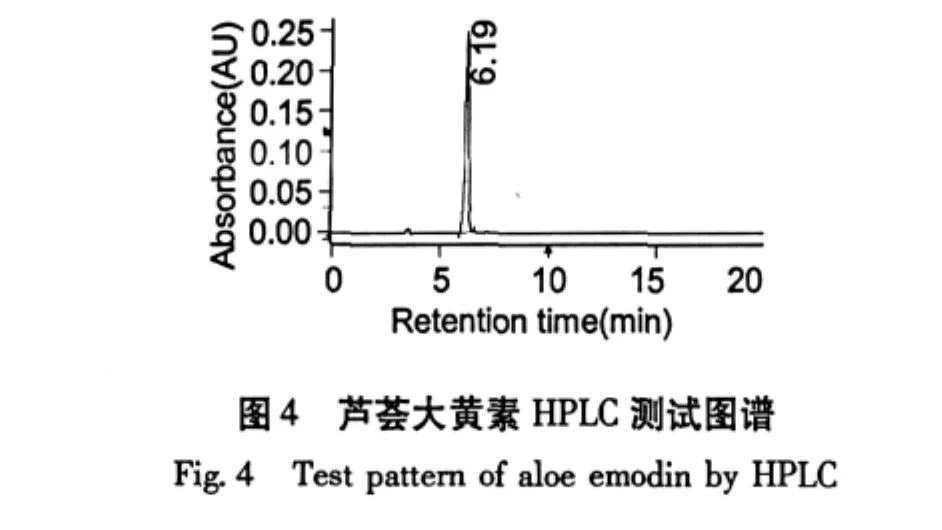
芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的HPLC测试谱图如图4~8。
3 讨论
用高速逆流分离游离蒽醌类化合物,选择溶剂系统是关键[7],如本试验第一个溶剂系统选择石油醚∶乙酸乙酯∶甲醇∶水(体积比为8∶2∶8∶1)时,能从游离蒽醌中把大黄素分离为单体,而且单体不做重结晶,高压液相色谱验证纯度在98%以上。对其它的化合物,也能做到初步分离,所有的溶剂系统只用了石油醚、乙酸乙酯、甲醇、水这4种溶剂,分离时间短。经过初步分离后的化合物,只需改变系统溶剂比例,能达到化合物完全分离[8]。
1 Sun YY(孙媛媛),Tang YH(唐玉海).Application of high speed countercurrent chromatography in separation of effective ingredients of Chinese medicine.Northwest Pharm(西北药学杂志),2003,18:282-283.
2 Huang JG(黄健光),Li ZC(李总成).Separation of active anthraquin one ingredient in Chinese rhubarb by high speed countercurrent chromatography.J Shunde Polytech(顺德职业技术学院学报),2006,4:31-33.
3 Huang Y(黄园),Xu XL(徐雄良),Zhang ZR(张志荣),et al.Study on purification process of total anthraquinone in Radix et Rhizoma Rhei decoction.Chin Tradit Patent Med(中成药),2003,25:783-785.
4 Zou HB(邹华彬),Wu B(吴波),Du AQ(杜爱琴),et al.Separation of the effective components from Rheum.Chem A-nal Comput(化学分析计量),2002,11:13-15.
5 Zhang D(张德),Cheng SP(程树平),Han HH(韩海洪),et al.Extraction of rhapontinum from the roots of Rheum tanguticum Maxim by ultrasonic wave.Nat Prod Res Dev(天然产物研究与开发),2005,17:217-219.
6 Yuan LM(袁黎明),Xia T(夏滔),Wu P(吴平),et al.Preparative separation of crude extract from rhubarb by high speed countercurrent chromatography.Chem World(化学世界),2002,43:185-186.
7Shi XG(时新刚),Chen ZW(陈志伟),Liu DW(刘东武).A review on application of high speed countercurrent chromatography.Life Sci Apparatus(生命科学器),2009,8:3-6.
8 Yuan LM(袁黎明),Li BF(李本发),Wang D(王东),et al.Separations of Rubia cordifolia L.,Polygonum cuspidatum and Cassia seed by high speed countercurrent chromatography.Nat Prod Res Dev(天然产物研究与开发),2002,14: 57-59.
Separation of Anthraquinone from Rhubarb by High Speed Countercurrent Chromatography
YUAN Ping1,ZHOU Dong-bin2,LIN Shun-quan1,GAO Jun-fei1,HE Liu1,YUAN Xiao1*1Wuhan Botanical Garden,Chinese Academy of Sciences,Wuhan 430074,China;2PI&PI Technologies Inc.,Guangzhou 510540,China
Five anthraquinones from Rhubarb were separated by high speed countercurrent chromatography.When twophase solvent system composition was petroleum ether:ethyl acetate:methanol:water(8∶2∶8∶1),emodin was obtained.Rhein and aloe emodin were separated when the proportion of solvents was 3∶4∶3∶2,while chrysophanol and rheochrysidin were separated at the proportion of solvents 12∶2∶12∶1.The purities of emodin,rhein,aloe emodin,chrysophanol and rheochrysidin are 98.81%,99.15%,98.51%,98.89%and 98.16%respectively by HPLC.
high speed countercurrent chromatography;aloe emodin;rhein;emodin;chrysophanol;rheochrysidin;separation
1001-6880(2011)04-0739-04
2010-03-08 接受日期:2010-06-17
国家科技基础专项项目(2008FY230400)
*通讯作者 Tel:86-013871483413;E-mail:yuanxiao@yahoo.com
R284.2;Q946.91
A
