高效液相法与硫酸-蒽酮法测定猪苓多糖含量比较
2011-11-23张国伟李彩霞王艳峰苏芝军
张国伟,李彩霞,王艳峰,黄 羽,苏芝军,郑 芳,曾 星*
1河北大学中医学院,保定071002;2广州中医药大学第二临床医学院,广州510006; 3中国医药集团四川抗菌素工业研究所,成都610051;4陕西省府谷县人民医院,府谷719400
高效液相法与硫酸-蒽酮法测定猪苓多糖含量比较
张国伟1,李彩霞2,王艳峰3,黄 羽2,苏芝军4,郑 芳2,曾 星2*
1河北大学中医学院,保定071002;2广州中医药大学第二临床医学院,广州510006;3中国医药集团四川抗菌素工业研究所,成都610051;4陕西省府谷县人民医院,府谷719400
本研究目的是比较高效液相法与硫酸-蒽酮法在测定猪苓多糖含量上的差异。为此,研究采用水提醇沉、Sevag法除蛋白、透析和冷冻干燥制备相对纯化的猪苓多糖,通过凝胶渗透色谱及高效液相法对猪苓多糖的相对分子量分布、组成及含量进行研究,用硫酸-蒽酮分光光度法测定猪苓颗粒中猪苓多糖的含量。结果显示,猪苓多糖数均相对分子质量为48,232,重均相对分子质量为117,506,分子范围2.44,可能由海藻糖和葡萄糖组成,其含量分别为6.05%和62.28%。硫酸-蒽酮法侧的猪苓多糖含量为87.9%。对于猪苓多糖含量测定,高效液相法优于硫酸-蒽酮法。
猪苓多糖;高效液相法;硫酸-蒽酮法
药用猪苓为多孔菌科多孔菌属真菌猪苓(Polyporus Umbellatus(Pers.)Fries)的干燥菌核,为利水渗湿常用中药。猪苓多糖(PPS,polyporus polysaccharide,水溶性多聚糖聚6-支链β-1,3-葡聚糖)为猪苓中主要成分,可增强机体免疫功能[1],是一种极有潜力的免疫增强剂[2]。前期研究证实PPS对膀胱癌细胞有抑制作用,体外应用于小鼠膀胱癌细胞T739,可通过降低IKBKB基因表达激活Toll信号通路相关基因抑制膀胱癌细胞的增殖[3,4]。本实验采用水提醇沉法制备猪苓粗多糖,通过Sevag法除蛋白后再次醇沉并通过透析和冷冻干燥制备相对纯化的猪苓多糖,通过凝胶渗透色谱(GPC,gel permeation chromatography)及HPLC法测定其相对分子量分布、组成及含量。为简化猪苓多糖的测量方法,实验中还使用硫酸-蒽酮分光光度法测猪苓颗粒中猪苓多糖的含量,并与HPLC法测定结果比较研究,探讨了有关实验条件对测定结果的影响。
1 材料、试剂与仪器
猪苓颗粒(江阴天江药业有限公司,批号,0811174),葡萄糖,棉籽糖,海藻糖(sigma),蒽酮(国药集团化学试剂有限公司),乙腈(Merck公司,HPLC级),实验用水为Millipore超纯水,其它试剂均为分析纯。
UV-2650紫外分光光度计(日本岛津),旋转蒸发仪(RV 10basic V,德国IKA公司),冷冻干燥仪(北京博医康实验仪器有限公司),电热恒温鼓风干燥箱(DHG-9146A型,上海精密实验设备有限公司),分析天平(AL104-LC,METTER TOLEDO公司),超低温冰箱(U725,美国NBS公司),离心机(LD25-2,北京医用离心机厂),Waters Alliance 2695高效液相色谱仪,Agilent 1100高效液相色谱仪。
2 方法
2.1 猪苓多糖的提取
猪苓颗粒(0.5 g/10 g生药)100 g,溶于2000 mL水中,100℃水浴1.5 h,抽滤,滤渣再重复提取1次,合并2次滤液,纱布过滤,3000 r/min离心10 mim,上清减压浓缩至合适体积,加95%乙醇,使其浓度达到80%,搅拌,置4℃箱中过夜,离心分离收集沉淀得粗多糖,抽滤液减压浓缩。将所得粗多糖冷冻干燥,粗多糖溶于纯水中,Sevage法(氯仿:正丁醇=5∶1,先加入氯仿,调pH=4-5,随后加入正丁醇),混合物剧烈震荡20 min,蛋白质变性成胶状,存在于水相和溶剂相的交界面上,3000 r/min离心10 mim,分去水层和溶剂层交界处的变性蛋白,重复5次。将溶液减压浓缩后加入95%乙醇使溶液中使醇浓度为80%,置4℃箱中过夜,3000 r/min离心10 mim,冷冻干燥,得除蛋白多糖。将所得除蛋白多糖溶于纯水,缓慢溶解,用玻棒搅拌,使不溶物缓慢溶解,记录溶液体积。用3%稀氨水调节溶液PH值为8~9,将多糖粗品水溶液加入500 mL三颈烧瓶,向烧瓶中加入1/3体积的30%H2O2,在50℃条件下搅拌2.5 h,溶液颜色逐渐变浅,待溶液冷却,加入95%乙醇使溶液中醇浓度为80%,置4℃箱中过夜,离心收集沉淀,将沉淀溶于适量纯水中,用流水透析48 h,纯水24 h(每6 h换水一次),透析后溶液加95%乙醇使醇浓度为80%,置4℃箱中过夜,离心收集沉淀,沉淀冷冻干燥,得猪苓多糖。
2.2 GPC法测定猪苓多糖相对分子质量分布
2.2.1 GPC条件
色谱柱,TSK-GEL G3000SWXL,300 mm×7.8 mm,柱温35℃;流动相,0.05 M NaH2PO4-Na2HPO4缓冲液(pH=6.7,加0.05%NaN3);体积流量,0.5 mL/min;示差折光检测器,恒温35℃;进样量20 μL。
2.2.2 GPC校正曲线的建立
取已知相对分子质量为738、5800、1.22×104,4.8×104,1.0×105,1.86×105,3.8×105,8.35× 105的多糖标样,用0.05 M NaH2PO4-Na2HPO4缓冲液(PH=6.7,加0.05%NaN3)溶解,经0.45 μm滤膜滤过,进行GPC分析。以多糖标样的保留时间为横坐标,多糖相对分子质量的对数为纵坐标做GPC普适校正曲线。
2.2.3 样品分析
取一定量猪苓多糖样品,用0.05 M NaH2PO4-Na2HPO4缓冲液(pH=6.7,加0.05%NaN3)溶解,经0.45 μm滤膜滤过,进行GPC分析。根据样品出峰时间在校正曲线上求得多糖峰的平均相对分子质量及分布。
2.3 HPLC法测定猪苓多糖组成及其含量
2.3.1 猪苓多糖的水解
取200 mg纯化猪苓多糖,加入2 M H2SO438 mL加热回流6h,冷却,用饱和Ba(OH)2溶液中和至中性,过滤,清液浓缩定容至10 mL,进行HPLC分析。
2.3.2 HPLC条件
色谱柱为Kromasil NH2(250 mm×4.6 mm),柱温45℃;流动相:乙腈-水(80∶20);体积流量:1.2 mL/min;示差折光检测器,恒温45℃;进样体积10 μL。
2.4 硫酸-蒽酮法测定猪苓多糖含量
2.4.1 蒽酮试剂
溶解0.2 g蒽酮于浓硫酸中(A.R.),当日配制使用。
2.4.2 测试条件的选择
将精密称取干燥至恒重的葡萄糖50.0 mg置于50 mL量瓶中,纯水溶解并定容至刻度,摇匀,制得1.0 g/L葡萄糖贮备液。取葡萄糖贮备液以纯化水稀释成200 mg/L制得葡萄糖稀释液。吸取葡萄糖稀释液2.0 mL,置于具塞试管中,加入2 g/L蒽酮试剂4.0 mL,迅速浸于冰水浴中冷却,后放入热水浴中,管口加盖玻璃塞,以防蒸发,准确煮沸10 min取出,自来水冷却。室温放置10 min,以试剂空白为参比,在400~800 nm波长范围进行扫描。将精密称量干燥至恒重的猪苓多糖样品0.5 g,加热水溶解,转移至100 mL量瓶中,精密移取25.0 mL于500 mL量瓶中,加水定容,得猪苓多糖贮备液。取2.0 mL猪苓多糖贮备液,置于10 mL具塞试管中,按上法操作,在460 nm~800 nm波长范围进行扫描[5]。
2.4.3 制作标准曲线
准确移取葡萄糖贮备液1,2,3,5,8,10 mL,分别置于50 mL量瓶中,加水至刻度(相当于20,40,60,80,100,160,200 mg/L)。分别取上述溶液2.00 mL置10 mL具塞试管中,加入0.2%蒽酮试剂4.0 mL,迅速浸于冰水浴中冷却,各管加完后一起放入热水浴中,管口加盖玻璃塞,以防蒸发,准确煮沸10 min取出,自来水冷却。室温放置10 min,以试剂空白为参比,在610 nm波长处测定吸收度。得到每1 mL含葡萄糖20~200 μg范围内葡萄糖量和吸收度呈良好的线性关系,求回归方程。
2.4.4 精密度试验
平行取7份葡萄糖稀释液和猪苓多糖供试液,蒽酮-硫酸法显色后测定吸光度,计算结果。
2.4.5 稳定性试验
精密量取葡萄糖稀释液和猪苓多糖的供试液,置于具塞试管中,各加入加入0.2%蒽酮试剂4.0 mL,按“2.4.2”项下操作,于室温自然光下放置2 h,每10 min测定一次,求A值在120 min内稳定性。
2.4.6 重复性考察
取同一批样品,按粗多糖贮备液的制备方法平行制备6份,按上述方法进行含量测定,分别测定吸光度,计算浓度,考察重复性。
2.4.7 回收率实验
分别精密称取5.0 mg葡萄糖,配制成50 mg/L溶液。向50 mL量瓶中分别精密量取5 mL猪苓多糖贮备液5份,同时,分别精密加入1.0 mL葡萄糖溶液,后用纯化水稀释至50 mL。按“2.4.2”项下操作进行含量测定,计算回收率。回收率公式:(最终测得量-原样品已知量)/对照品加入量×100%。
2.4.8 样品的测定
准确移取猪苓多糖供试液1.0 mL,按“2.4.3”方法显色,测定吸光度,以下列公式计算各样品多糖的含量(mg/g):多糖的含量=(C×D)/(w×E)式中:C为测试液中多糖浓度(g/L),D为供试液的稀释因子,E为称量多糖样品占提取总多糖样品比例因子,w为样品质量(g)。
3 结果
3.1 猪苓多糖相对分子质量分布
猪苓多糖数均相对分子质量为48232,重均相对分子质量为117506,分子范围为2.44[图1]。

图1 猪苓多糖GPC色谱图Fig.1 The GPC chromatogram of polyporus polysaccharide from Polyporus Umbellatus(Pers.)Fries.
3.2 猪苓多糖组成及含量
猪苓多糖水解后用HPLC分析其单糖组成,并与单糖标样进行对照,猪苓多糖可能由海藻糖和葡萄糖组成,其含量分别为6.05%和62.28%[图2]。
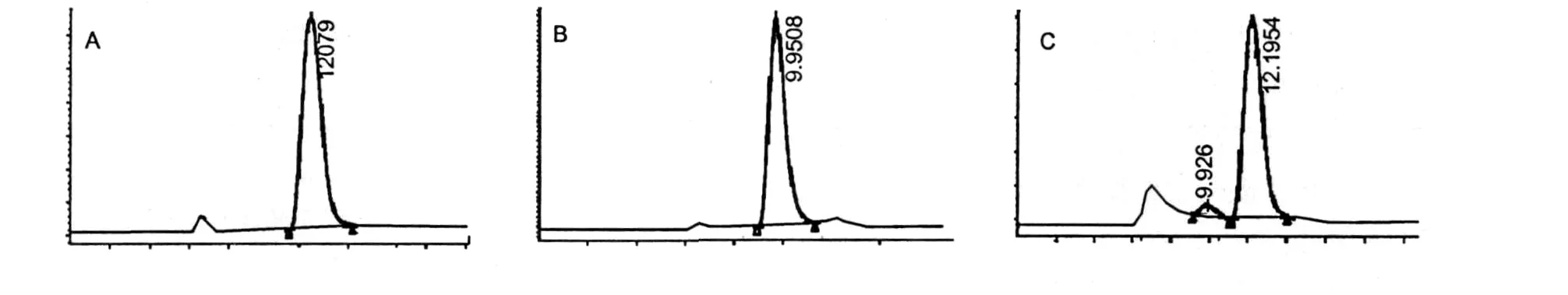
图2 A葡萄糖HPLC色谱图;B海藻糖HPLC色谱图;C猪苓多糖HPLC色谱图Fig. A.The HPLC chromatogram of glucose;B.The HPLC chromatogram of trehalose;C.The HPLC Chromatogram of polyporus polysaccharide
3.3 硫酸-蒽酮法测定猪苓多糖含量
标准曲线方程为 y=0.0039x-0.0163,R2= 0.9987;葡萄糖与猪苓多糖的精密度RSD分别为2.94%和3.03%;120 min内,葡萄糖和猪苓多糖稳定性RSD值分别为1.1%和0.76%,按此方法显色得到的结果是稳定的,本实验选择室温放置时间为10 min;猪苓多糖贮备液的平均质量浓度重复性RSD为1.91%;猪苓多糖回收率为98.6%;猪苓多糖含量为879 mg/g。
4 讨论
验用水提醇沉法制备猪苓粗多糖,采用Sevage法除蛋白后再次醇沉以及透析和冷冻干燥的方法对所提取的猪苓粗多糖进行纯化。粗多糖提取物中含有大分子蛋白质,蛋白质与多糖结合,形成蛋白多糖,但大部分蛋白质是以游离状态存在于多糖粗提物中的,因而脱蛋白是分离多糖的重要步骤。粗多糖中还含有比较多的色素物质(游离色素或结合色素),色素的存在会污染后续处理实验,也会影响多糖的外观色泽,因而必须除掉。实验中,冷冻干燥步骤较为关键,能使多糖在低温(-70℃)和减压状态下迅速干燥,避免了糖苷键的断裂。实验发现,经冷冻干燥后的多糖溶解性明显强于经直接干燥的多糖。这是由于缓慢干燥时,存在于多糖分子周围的水分子逐渐被抽除,多糖体分子间借次价力而紧密结合,使表观分子量显著增加,从而溶解性能降低。
凝胶渗透色谱法根据大分子化合物的体积及相对分子质量的大小进行分离,可以不破坏大分子化合物的原有结构和性质直接进行分析,因此适合分析多糖。在凝胶渗透色谱中相对分子质量大的先出峰,相对分子质量小的后出峰,凝胶色谱图的每个峰都反映了大分子化合物的相对分子质量分布,通过已知相对分子质量的多糖标样所作的普适校正曲线求得相对分子质量。多糖的分子量分布形态受聚合方式和聚合因素的影响而有所不同,可用表示多分散程度的参数,如分布宽度指数表示,分布宽度越大,多糖分子大小差别就越大,分散程度就越明显[6]。多糖是由一个个单糖基连接而成的天然大分子化合物,用高效液相色谱法分析多糖,需要将多糖水解成单糖后进行,用来分析多糖组成情况及个组成单糖含量。
蒽酮-硫酸法测定多糖含量,是利用多糖在浓硫酸作用下,水解生成单糖,并迅速脱水生成羟甲基糠醛,羟甲基糠醛与蒽酮综合成蓝色化合物,比色该化合物颜色的深浅来计算多糖浓度的高低。加入蒽酮试剂时会产生热量,反应温度和时间条件不易控制。置于冰水浴中冷却,再平行加热相同时间后冷却,可以较好的提高实验结果的现性和准确性。在该条件下显色产物的最大吸收波长为610 nm。在多糖的含量测定中,因为多糖组成复杂而难以得到相应的多糖对照品,所以多采用葡萄糖代替对照品,但这只能测得样品中多糖的相对含量,样品中多糖的准确含量必须通过单糖和多糖之间的换算因子计算来获得。实验中提取物中有游离的单糖,影响测定结果,采用乙醇沉淀后进行测定,避免单糖和小分子寡糖对多糖含量测定的影响
实验结果显示,猪苓多糖可能由海藻糖和葡萄糖聚合而成,其中葡萄糖占其中绝大部分,数均相对分子质量为48232,重均相对分子质量为117506,分子范围为2.44。
由HPLC法测得多糖纯度为68.33%,由蒽酮-硫酸法侧的多糖纯度为87.9%,蒽酮-硫酸法所测多糖含量明显高于HPLC所测含量,原因可能是蒽酮-硫酸法测得的是总糖含量,且硫酸-蒽酮法操作精密度差。故可得出结论,测定多糖含量方面,HPLC法优于硫酸-蒽酮法。
1 Nie H(聂红),Ma AL(马安伦),Shen BH(沈佰华),et al.Immunoregulation effect of compound Polyporus umbellatus polysaccharide on mice.Chin J Cell Mol Immunol(细胞与分子免疫学杂志),2000,16:384-386.
2 Zhang JC(张俊才),Jian ZJ(简子健),Deng PH(邓普辉),et al.Effect of different adjuvants to immunity of BCG.Prog Veter Med(动物医学进展),2003,24(5):96-98.
3 Wei JA(危建安),Zeng X(曾星),Han L(韩凌),et al.Expression of Toll signal pathway-associated genes in bladder cancer cell line stimulated by polyporus polysaccharide.Immunol J(免疫学杂志),2009,25:375-379.
4 Wei JA(危建安),Zeng X(曾星),Han L(韩凌),et al.Effect of NF-κB p65 activity through Toll-like receptors in mice bladder cancer cell line T739 induced by Bacillus Calmette-Guerin.Chin J Cell Mol Immunol(细胞与分子免疫学杂志),2009,25:276-279.
5 Zhang WJ(张惟杰).Glycoconjugates biochemical research technology(糖复合物生化研究技术),2ndEd.Hangzhou: Zhejiang University Press,1999.12-13.
6 Yu SL(于世林).The HPLC methods its application(高效液相色谱方法及应用),1stEd.Beijing:Chemical Industry Press,1999.159.
Determination and Comparison of Polyporus Polysaccharide by HPLC and Anthrone-Sulfuric Acid Method
ZHANG Guo-wei1,LI Cai-xia2,WANG Yan-feng3,HUANG Yu2,SU Zhi-jun4,ZHENG Fang2,ZENG Xing2*1College of Chinese Medicine,Hebei University,Baoding 071002,China;2Guangdong Provincial Academy of Chinese Medical Sciences,Guangzhou University of Chinese Medicine,Guangzhou 510006,China;3Sinopharm ChuanKong pharmaceutical CO.,LTD,Chengdu 610051,China;4Fugu Peoples Hospital of Shanxi,Fugu 719400,China
This method is aimed to compare the differences between HPLC and anthrone-sulfuric acid method in determining Polyporus Polysaccharide(PPS).PPS was prepared by water extracting-alcohol precipitating,deproteinization with Sevag method,dialysis and freeze-drying.Relative molecular weight of PPS was determined by Gel Permeation in Chromatography(GPC)and the constitutes were analyzed by HPLC.At the same time,anthrone-sulfuric acid method was used to measure the content and purity of PPS.The results showed that the number-average molecular weight(Mn)of PPS wass 48,232,weight-average molecular weight(Mw)was 117,506,the polydispersity(Mw/Mn)was 2.44.PPS was composed of glucose(62.28%)and trehalose(6.05%).The PPS purify degree was 87.9%by anthrone-sulfuric acid method.Conclusively,HPLC method was superior to anthrone-sulfuric acid method in determining of PPS content.
Polyporus polysaccharide;HPLC;anthrone-sulfuric acid method
1001-6880(2011)06-1099-04
2010-08-24 接受日期:2010-12-13
广东省科技计划项目(2010B030700059);河北大学科研基金资助项目(2010Q46);河北省卫生厅科研基金项目(20110514)
*通讯作者 Tel:86-20-39318678;E-mail:zengxing-china@163.com
R284.2
A
