4′-烷氧基-1,1′-联苯-4-羧酸脂三肽的合成
2011-11-22姚建忠张东炜刘红明盛春泉缪震元张万年
周 亭,姚建忠 ,张东炜,刘红明,盛春泉,缪震元,张万年
(第二军医大学药学院,上海 200433)
4′-烷氧基-1,1′-联苯-4-羧酸脂三肽的合成
周 亭,姚建忠 ,张东炜,刘红明,盛春泉,缪震元,张万年
(第二军医大学药学院,上海 200433)
目的制备用于全合成新型卡泊芬类环六脂肽抗真菌剂的关键脂三肽中间体4′-烷氧基-1,1′-联苯-4-羧酸脂三肽。方法以L-脯氨酸叔丁酯为原料,依次经与N-(9-芴甲氧羰基)-L-苏氨酸叔丁醚(a)或N-(9-芴甲氧羰基)-L-丝氨酸叔丁醚(b)缩合、脱N-保护基后与Nα-(9-芴甲氧羰基)-Nδ-苄氧羰基-L-鸟氨酸缩合、再脱Nα-保护基后与4′-烷氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑“活泼酯”(Ie~If)缩合5步反应制备目标脂三肽1。结果以67.4%~80.0%的总收率合成了8个脂三肽1ae~1ah和1be~1bh,其结构经电喷雾质谱(ESI-MS)和元素分析确证。结论该合成路线具有反应条件温和、操作简便、总收率高的优点。
药物化学;合成;脂三肽;卡泊芬净;环六脂肽;抗真菌剂
棘白菌素(echinocandin) 是天然环六脂肽类真菌细胞壁β-1,3-葡聚糖合成酶抑制剂,对念珠菌和曲霉菌等深部真菌具有独特的“杀菌”活性,但也存在抗菌谱窄、水溶性差及溶血毒性[1]。其中,上市的卡泊芬净(caspofungin)、米卡芬净(micafungin)和阿尼芬净(anidulafungin)3个新药[2]是其半合成衍生物,临床用于治疗侵入性念珠菌病和曲霉菌病。
为了进一步探讨此类药物的构效关系,寻找高效、低毒、广谱的抗深部真菌新药,作者开展了新型卡泊芬净类似物的优化设计与全合成和活性研究;其中,4′-烷氧基-1,1′-联苯-4-羧酸脂三肽(1)是“液相三肽片段对接法”全合成卡泊芬净类环六脂肽胺型抗真菌剂的关键脂三肽中间体(图1)。
本合成以市售L-脯氨酸叔丁酯(4)为起始原料,首先在缩合剂[N-(3-二甲氨基)丙基-N′-乙基]碳二亚胺盐酸盐(EDC HCl)及N-羟基苯并三氮唑(HOBt)作用下,与N-(9-芴甲氧羰基)-L-苏氨酸叔丁醚(a)或N-(9-芴甲氧羰基)-L-丝氨酸叔丁醚(b)反应制得二肽3a和3b;然后,二肽3a或3b经二乙胺脱N-9-芴甲氧羰基(N-Fmoc)后按二肽相同制备方法与Nα-(9-芴甲氧羰基)-Nδ-苄氧羰基(CBz)-L-鸟氨酸缩合制得三肽2a或2b;最后,三肽2a或2b经二乙胺脱N-Fmoc后与4′-烷氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑“活泼酯”(I,R2CO2Bt)在N,N-二甲基甲酰胺(DMF)中反应制得8个目标脂三肽1ae~1ah和1be~1bh,合成路线如图2 所示。
其中,4′-烷氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑“活泼酯”(I,R2CO2Bt)的制备是以4′-羟基-1,1′-联苯-4-羧酸(Ⅴ)为原料,经酸催化乙酯化、Williamson酚羟基烃化、碱水解制得4′-烷氧基-1,1′-联苯-4-羧酸(Ⅲ)后,再在二环己基碳二亚胺(DCC)作用下与N-羟基苯并三氮唑(HOBt)缩合制得,合成路线如图3 所示。
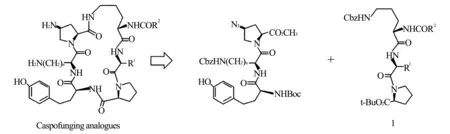
图1卡泊芬净类环六脂肽抗真菌剂的反合成分析

图2 4′-烷氧基-1,1′-联苯-4-羧酸脂三肽(1)的合成
.
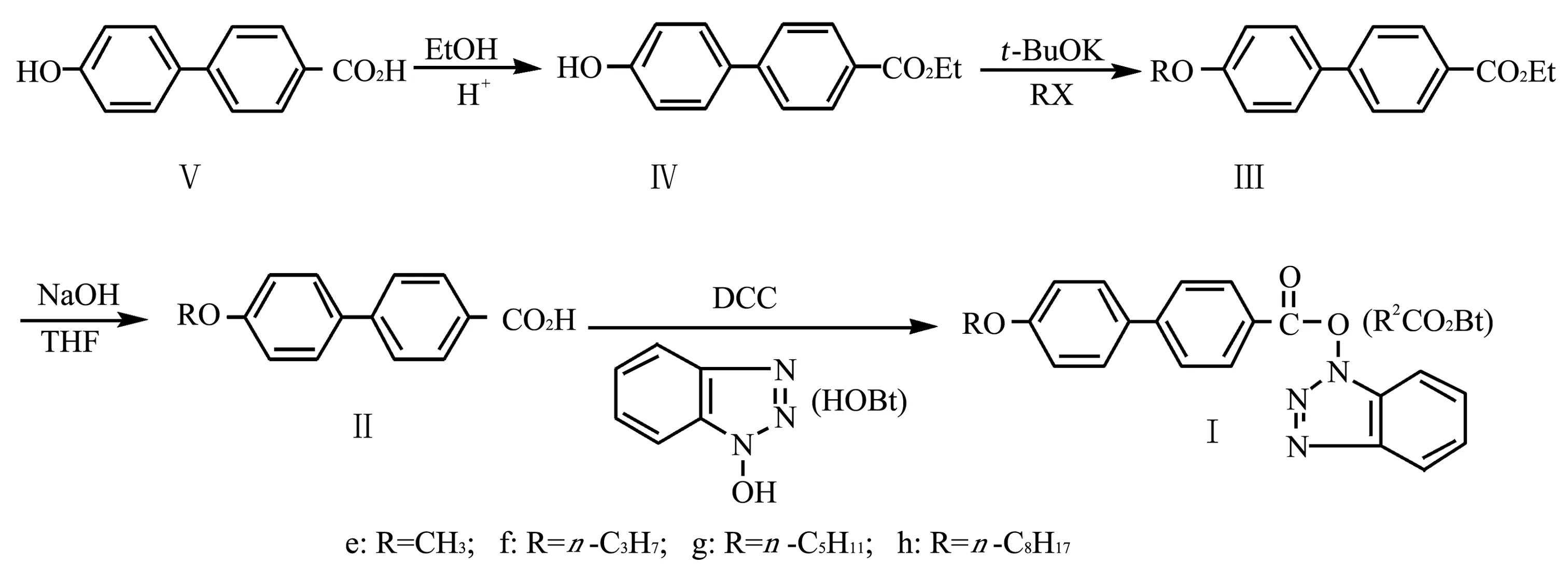
图3 4′-烷氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑“活泼酯”(I, R2CO2Bt)的合成
1 仪器与试剂
核磁氢谱(1H NMR)用Bruker DMX-500型核磁共振仪测定,TMS为内标;电喷雾质谱(ESI-MS)采用Micromass Qtof-Micro LC/MS/MS质谱仪测定;元素分析用Carlo Erba-1106型元素分析仪测定。 N -9-芴甲氧羰基-N-苄氧羰基-L-鸟氨酸购自上海源聚生物科技有限公司;其他保护氨基酸和缩合剂均购自吉尔生化(上海)有限公司。实验所用其它试剂和溶剂均为市售化学纯商品。
2 方法与结果
2.14′-烷氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑酯(I, R2CO2Bt)的合成
2.1.14′-羟基-1,1′-联苯-4-羧酸乙酯(Ⅳ)的制备 4′-羟基-1,1′-联苯4-羧酸(Ⅴ)20.0 g(93.46 mmol)溶于220 ml乙醇,加入10 ml浓硫酸回流2 h。将反应液倒入400 ml冰水中,冷却,过滤,滤饼水洗至中性,得黄色固体粗品,干燥,硅胶H柱纯化(二氯甲烷为洗脱剂)得白色固体Ⅳ 19.3 g,产率为85.3%。MS(ESI-)m/z:241(M-1,100%)。
2.1.24′-烷氧基-1,1′-联苯-4-羧酸乙酯(Ⅲ)的制备 化合物Ⅳ 2.0 g(8.26 mmol)溶于30 ml乙腈,加叔丁醇钾0.93 g(8.30 mmol)及碘甲烷 0.55 ml(1.23 g,8.67 mmol),回流24 h。反应完毕,回收溶剂,残留物用乙醚溶解,乙醚液先后用0.2% NaOH水液和水洗涤,无水硫酸镁干燥,过滤,回收溶剂得黄色固体,硅胶H柱层析纯化得白色固体4′-甲氧基-1,1′-联苯-4-羧酸乙酯(Ⅲe)1.4 g,收率为66.2%。MS(ESI-)m/z:255(M-1,100%)。
按Ⅲe相同的制备操作,化合物Ⅳ 2.0 g(8.26 mmol)在等摩尔量的叔丁醇钾存在下,于30 ml乙腈中分别与1.05倍摩尔量的1-溴正丙烷、1-溴正戊烷和1-溴正辛烷反应制得化合物4′-正丙氧基-1,1′-联苯-4-羧酸乙酯(Ⅲf)1.2 g,收率为51.1%,MS(ESI-)m/z:283(M-1,100%)、4′-正戊氧基-1,1′-联苯-4-羧酸乙酯(Ⅲg)1.2 g,收率为46.5%,MS(ESI-)m/z:311(M-1,100%)、4′-正辛氧基-1,1′-联苯-4-羧酸乙酯(Ⅲh)1.3 g,收率为44.4%,MS(ESI-)m/z:353(M-1,100%)。
2.1.34′-烷氧基-1,1′-联苯-4-羧酸(Ⅱ)的制备 化合物Ⅲe 1.40 g(5.47 mmol)溶于18 ml四氢呋喃(THF)溶液中,加入1 mol/L NaOH水液11 ml,于80 ℃反应10 h。反应完毕,回收THF,残液用2 mol/L HCl调节pH5~6,过滤,干燥,得白色固体4′-甲氧基-1,1′-联苯-4-羧酸(Ⅱe)1.22 g,产率为97.8%。
按IIe相同的制备方法,化合物Ⅲf 0.30 g(1.06 mmol)、Ⅲg 1.20 g(3.85 mmol)、Ⅲh 1.3 g(3.67 mmol)各自经2倍摩尔量的1 mol/L NaOH水液于2倍体积的THF中分别水解制得4′-正丙氧基-1,1′-联苯-4-羧酸(Ⅱf)0.26 g、4′-正戊氧基-1,1′-联苯-4-羧酸(IIg)1.07 g、4′-正辛氧基-1,1′-联苯-4-羧酸(Ⅱh)1.17 g;所有4′-烷氧基-1,1′-联苯-4-羧酸(Ⅱe~Ⅱh)的收率及理化数据见表1。
2.1.44′-烷氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑酯(I, R2CO2Bt)的制备 化合物Ⅱf 0.5 g(1.76 mmol)溶于20 ml二氯甲烷,依次加HOBt 0.25 g(1.85 mmol)及DCC 0.4 g(1.94 mmol),室温搅拌48 h。反应完毕,过滤,回收溶剂得粗品。粗品经硅胶H柱色谱分离制得白色絮状物4′-正戊氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑酯(Ⅰg)0.45 g,收率为63.7%。MS(ESI-)m/z:400(M-1,100%)。
按化合物Ⅰg相同制备操作,化合物Ⅱe 1.0 g(4.39 mmol)、Ⅱf 1.0 g(3.91 mmol)和Ⅱh 1.5 g(4.60 mmol)各自与1.05倍摩尔量的HOBt在1.10倍摩尔量的DCC作用下分别反应制得4′-甲氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑酯(Ⅰe)0.91 g,收率为60.1%,MS(ESI-)m/z:344(M-1,100%)、4′-正丙氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑酯(Ⅰf)0.95 g,收率为65.2%,MS(ESI-)m/z:396(M+Na,100%)、4′-正辛氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑酯(Ⅰh)0.87 g,收率为64.0%,MS(ESI-)m/z:442(M-1,100%)。

表1 4′-烷氧基-1,1′-联苯-4-羧酸(Ⅱe~Ⅱh)的结构和光谱数据
2.24′-烷氧基-1,1′-联苯-4-甲酸脂三肽(1)的合成
2.2.1脯-苏二肽(3a)和脯-丝二肽(3b)的制备 L-脯氨酸叔丁酯(4)3.0 g(17.54 mmol)溶于80 ml无水二氯甲烷,于0 ℃下加入N-Fmoc-L-苏氨酸叔丁醚(a)7.3 g(18.39 mmol)、HOBt 3.1 g(22.96 mmol)及EDC HCl 4.4 g(23.0 mmol),搅拌反应24 h,回收溶剂,油状残液加入50 ml乙酸乙酯和 50 ml 10%(w/v)柠檬酸水液,充分振摇,分取乙酸乙酯层,并依次用饱和碳酸钠水液、水、饱和食盐水洗涤,无水硫酸钠干燥,回收溶剂得粗品。粗品经硅胶H柱色谱分离得白色固体3a 9.1 g,收率为94.3%。MS(ESI+)m/z:573(M+Na,100%)。
按二肽3a相同的制备操作, L-脯氨酸叔丁酯(4)2.0 g(11.70 mmol)与N-Fmoc-L-丝氨酸叔丁醚(b)4.7 g(12.27 mmol)、HOBt 2.1 g(15.56 mmol)及EDC HCl 2.9 g(15.14 mmol)反应制得白色固体二肽3b 6.0 g,收率为95.7%。MS(ESI+)m/z:559(M+Na,100%)。
2.2.2脯-苏-鸟三肽(2a)和脯-丝-鸟三肽(2b)的制备 二肽3a 9.1 g(16.55 mmol)溶于60 ml乙腈,于0 ℃下加入二乙胺17.3 ml(165.9 mmol),搅拌反应2.5 h,回收溶剂及二乙胺,P2O5真空干燥,所得胶状固体按二肽3a相同的合成操作,与Nα-Fmoc-Nδ-Cbz-L-鸟氨酸8.5 g(17.42 mmol)、EDC HC l4.1 g(21.41 mmol)及HOBt 2.9 g(21.48 mmol),反应制得白色固体2a 12.3 g,收率为93.2%。MS(ESI+)m/z:821(M+Na,100%)。
按三肽2a相同的制备操作,二肽3b 6.0 g(11.19 mmol)经10倍摩尔量的二乙胺脱Fmoc保护基后,与Nα-Fmoc-Nδ-Cbz -L-鸟氨酸5.5 g(11.27 mmol)、EDC 2.8 g(14.62 mmol)及HOBt 2.0 g(14.81 mmol)反应制得白色固体三肽2b 8.1 g,收率92.3%。MS(ESI+)m/z:807(M+Na,100%)。
2.2.3目标脂三肽(1ae~1ah)的制备 2a 1.0 g(1.25 mmol)经10倍摩尔量的二乙胺脱Fmoc保护基后,与Ie 0.5 g(1.45 mmol)在30 ml无水DMF中室温搅拌反应24 h。反应完毕,加2倍量水稀释,二氯甲烷萃取3次(50 ml×3),二氯甲烷液用水洗2次,无水硫酸钠干燥,过滤,回收溶剂所得粗品经硅胶H柱分离得淡黄色固体脯-苏-(Nα-4′-甲氧基-1,1′-联苯-4-甲酰)-鸟三肽(1ae)0.84 g。收率85.3%。MS(ESI-)m/z:786(M,100%)。Anal. Calcd for C44H58N4O9: C 67.18, H 7.38, N 7.12; found C 66.98, H 7.41, N 7.15。
按脂三肽1ae相同的制备操作,三肽2a 1.0 g(1.25 mmol)经二乙胺脱Fmoc保护基后分别与1.1倍摩尔量的化合物Ⅰf、Ⅰg和Ih反应制得脯-苏-(Nα-4′-正丙氧基-1,1′-联苯-4-甲酰)-鸟三肽(1af)0.90 g,收率88.2%,MS(ESI+)m/z:837(M+Na,100%);Anal. Calcd for C46H62N4O9: C 67.81, H 7.62, N 6.88; found C 67.60, H 7.65, N 6.92、脯-苏-(Nα-4′-正戊氧基-1,1′-联苯-4-甲酰)-鸟三肽(1ag)0.96 g,收率91.0%,MS(ESI+)m/z:865(M+Na,100%);Anal. Calcd for C48H66N4O9: C 68.41, H 7.84, N 6.65; found C 68.20, H 7.89, N 6.60和脯-苏-(Nα-4′-正辛氧基-1,1′-联苯-4-甲酰)-鸟三肽(1ah)0.85 g,收率76.7%。MS(ESI+)m/z:1 792(2M+Na,100%);Anal. Calcd for C51H72N4O9: C 69.23, H 8.14, N 6.33; found C 69.01, H 8.10, N 6.29。
2.2.4目标脂三肽(1be~1bh)的制备 按脂三肽1ae相同的制备操作,三肽2b 1.0 g(1.28 mmol)经二乙胺脱Fmoc保护基后分别与1.1倍摩尔量的化合物Ie、If、Ig和Ih反应制得脯-丝-(Nα-4′-甲氧基-1,1′-联苯-4-甲酰)-鸟三肽(1be)0.89 g,收率90.4%,MS(ESI+)m/z:795(M+Na,100%);Anal. Calcd for C43H56N4O9: C 66.84, H 7.25, N 7.25; found C 66.65, H 7.28, N 7.27、脯-丝-(Nα-4′-正丙氧基-1,1′-联苯-4-甲酰)-鸟三肽(1bf)0.85 g,收率83.3%,MS(ESI+)m/z:823(M+Na,100%);Anal. Calcd for C45H60N4O9: C 67.50, H 7.50, N 7.00; found C 67.29, H 7.53, N 7.02、脯-丝-(Nα-4′-正戊氧基-1,1′-联苯-4-甲酰)-鸟三肽(1bg)0.92 g,收率87.1%,MS(ESI+)m/z:851(M+Na,100%);Anal. Calcd for C47H64N4O9: C 68.12, H 7.73, N 6.76; found C 67.91, H 7.76, N 6.78和脯-丝-(Nα-4′-正辛氧基-1,1′-联苯-4-甲酰)-鸟三肽(1bh)0.99 g,收率89.2%。MS(ESI+)m/z:893(M+Na,100%);Anal. Calcd for C50H70N4O9: C 68.97, H 8.05, N 6.44; found C 67.78, H 8.08, N 6.46。
3 总结与讨论
以L-脯氨酸叔丁脂(4)为起始原料,用液相法经2步脱N-保护基及3步成肽缩合反应成功合成了8个目标脂三肽1ae~1ah和1be~1bh,为下步新型环六脂肽胺型抗真菌剂的全合成与活性研究打下了坚实的基础。该脂三肽合成路线总收率达67.4 %~80.0%,所合成目标化合物均为首次报道。
脂肪酸与肽类的成肽键缩合反应是合成脂肽化合物的关键。在脂肽类化合物的固相或液相合成中,一般采用肽分子中的游离氨基对脂肪酸“活泼酯”的定向亲核氨解反应来实现。其中,传统的脂肪酸“活泼酯”多数为2,4,5-三氯苯酚等多卤取代苯酚酯[3,4],但多卤取代苯酚毒性大。作者采用相对廉价且安全易得的HOBt,成功制备了4′-烷氧基-1,1′-联苯-4-羧酸-N-羟基苯并三氮唑“活泼酯”(I,R2CO2Bt),而且,该步4个脂肪酸“活泼酯”与2个三肽缩合制备8个目标脂三肽的收率达76.7%~91.0%,平均收率为87.4%。总之,该目标脂三肽化合物的合成路线具有反应条件温和安全、操作简便、总收率高等优点,适合工业化生产。
[1] Georgopapadakou NH. Update on antifungals targeted to the cell wall:focus on beta-1,3-glucan synthase inhibitors[J]. Expert Opin Invest Drugs, 2001, 10(2): 269.
[2] 郑玉果,朱宝泉,陈代杰. 芬净类抗真菌抗生素的研究开发和临床应用[J]. 世界临床药物,2007, 28(2): 738.
[3] Klein LL, Li L, Chen HJ,etal. Total synthesis and antifungal evaluation of cyclic aminohexapeptides[J]. Bioorg Med Chem, 2000, 8(7): 1677.
[4] Journet M, Cai DW, DiMichele LM,etal. Semisynthesis of an antifungal lipopeptide echinocandin[J]. J Org Chem, 1999, 64(7): 2411.
2010-06-06
[修回日期] 2011-01-04
Synthesisof4′-alkoxy-1,1′-bisphenyl-4-carboxylicacidlipotripeptides
ZHOU Ting, YAO Jian-Zhong, ZHANG Dong-Wei, LIU Hong-Ming, SHENG Chun-Quan, MIAO Zhen-Yuan, ZHANG Wan-Nian
(School of Pharmacy, Second Military Medical University, Shanghai 200433, China )
ObjectiveTo prepare 4′-alkoxy-1,1′-bisphenyl-4-carboxylic acid lipotripeptides , which is the key intermediates for total synthesis of novel caspofungin-like cyclohexalipopeptide antifungal agents.MethodsStarting from Pro-O-t-Bu , the target compound 1 were prepared via 5 steps including condensation with N-Fmoc-L-Thr(O-t-Bu)-OH (a) or N-Fmoc-L-Ser(O-t-Bu)-OH (b), then removed of N-Fmoc group and coupling with Nα-Fmoc-Nδ-Cbz-L-Orn-OH followed by removal of Nα-Fmoc group and reaction with 4′-alkoxy-1,1-4-carboxylic acid N-hydroxybenzotriazole ester (Ie~If).Results8 target compounds 1ae~1af and 1be~1bf had been synthesized in an overall yield ranged from 67.4% to 80.0%. The structures were confirmed by ESI-MS spectra and elemental analysis.ConclusionThe process developed had several adventages of facile reaction conditions, convenient workup and high yield.
medicinal chemistry; synthesis; lipotripeptide; caspofungin; cyclohexalipopeptide; antifungal agent
国家自然科学基金(30772674、30930107)和上海市重点学科建设基金(B906)资助项目.
周 亭(1984-),女,硕士研究生. E-mail:zhouting8451@sina.com.
姚建忠.E-mail:yaojz@sh163.net.张万年. E-mail:zhangwnk@hotmail.com.
R914
A
1006-0111(2011)01-0017-04
