溶氧浓度对rhG-CSF工程菌高密度发酵的影响
2011-11-22岑仡,童涌,杨峰
岑 仡,童 涌,杨 峰
(1.上海三维生物技术有限公司,上海 201206; 2. 第二军医大学无机化学教研室,上海 200433)
溶氧浓度对rhG-CSF工程菌高密度发酵的影响
岑 仡1,童 涌1,杨 峰2
(1.上海三维生物技术有限公司,上海 201206; 2. 第二军医大学无机化学教研室,上海 200433)
目的确定rhG-CSF工程菌高密度发酵的最佳溶氧浓度。方法通过通入纯氧,高密度发酵的溶氧值可以精确控制。考察不同溶氧浓度对工程菌的生长、质粒丢失率、乙酸积累情况以及rhG-CSF表达的影响,来确定溶氧的最佳控制范围。结果工程菌生长阶段溶氧控制在25%,诱导后控制在35%,最有利于菌体生长和外源蛋白表达,最终菌体密度为(79.6±2.1)g/L,表达量为(40.2±1.2)%。结论溶氧对工程菌rhG-CSF高密度发酵有显著影响。
rhG-CSF; 高密度发酵; 溶氧
粒细胞集落刺激因子(G-CSF)是目前已知血细胞集落刺激因子中特异作用粒系祖细胞,促进其向成熟中性粒细胞增殖、分化,并维持其功能、存活的造血生长因子。它对于治疗由肿瘤放化疗、骨髓移植所引起的粒细胞减少症具有显著疗效[1]。由于rhG-CSF天然来源非常有限,利用基因工程重组技术,进行工程菌高密度发酵是大量获取有药用价值hG-CSF的一条重要途径[2]。
溶氧是影响高密度发酵的一个重要参数。工程菌在生长过程中,需要大量的氧气参与代谢,因而氧的供给非常重要。溶氧浓度过高或过低,都会影响菌体的生长和产物合成[3]。不同溶氧浓度(DO)对高密度发酵中的菌体生长、外源质粒丢失、乙酸的生成都会造成不同的影响,而这些因素又直接影响到外源蛋白的产量高低。本研究通过不同DO对上述3个因素影响的研究,最终确定了rhG-CSF工程菌pBVQG8/ MM294最适生长和最适表达的溶氧浓度,分别为25%和35%,为大规模生产rhG-CSF奠定了基础。在确定了最适溶氧浓度后,rhG-CSF工程菌高密度发酵最终获得菌体80 g/L,表达量可达菌体总蛋白的40%。
1 材料与方法
1.1工程菌 工程菌pBVQG8/ MM294由中国军事医学科学院构建,上海三维生物技术有限公司保存,受PRPL双重启动子控制,能在42 ℃下表达rhG-CSF,具有氨苄抗性。
1.2培养基 ①种子培养基:LB培养基[4];②基础培养基:蛋白胨 12 g/L、酵母膏 24 g/L、甘油 4 ml/L、KH2PO42.31 g/L、K2HPO412.54 g/L、葡萄糖20 g/L、MgSO40.2 g/L、微量元素[5]3 ml/L;③补料培养基:葡萄糖 500 g/L、MgSO40.2 g/L、100 g/L蛋白胨。
1.3发酵方法
1.3.1种子液制备 取甘油管1支,接种于LB培养基中,在28 ℃ 200 r/min下培养至OD600(波长600 nm处的吸光值)到0.5~0.7之间。再以2%的接种量接种于LB培养基中,在28℃ 200 r/min下培养至OD600到0.5~0.7之间接种于发酵罐进行发酵。
1.3.2高密度发酵 采用分批补料方式[6]。当发酵过程中残糖浓度低于1 g/L后,开始补料,控制残糖浓度为1 g/L。pH控制为7.0,生长阶段温度控制为28 ℃,诱导温度控制为42 ℃。
1.4检测方法 ①菌体浓度测定:可见光分光光度计在λ=600 nm处测吸光值。②发酵液中葡萄糖浓度测定:使用Roche公司生产的血糖仪进行检测。③表达量的测定:发酵液菌体做聚丙烯酰胺凝胶电泳,扫描测定rhG-CSF表达量。④乙酸测定:HPLC法,参照文献[7]方法。⑤质粒稳定性检测参照文献[8]方法。
2 结果与讨论
2.1溶氧控制失败与成功的高密度发酵比较 设定控制溶氧为30%进行发酵,随着补料的进行,菌体生长进入对数生长期后,发酵罐的搅拌转速和通气量设定至最大值,但是DO仍无法控制在30%,DO随着发酵的进行,不断下降,直至降为0。生长曲线与溶氧值及乙酸生成情况见图1,当DO降为0后,菌体的OD600值增加速率明显减缓,甚至不增加,检测最终发酵液中的乙酸含量达到9.2 g/L,已经达到对菌体生长抑制的浓度。这说明溶氧值对大肠杆菌高密度发酵至关重要。要解决溶解氧的问题,必须增加纯氧供气,来满足发酵过程菌体对氧的需求。

图1 溶氧控制失败的生长情况
设定控制溶氧为 30%进行发酵,当溶氧控制不住的时候,改用纯氧通气,使溶氧值始终控制在30%。发酵结果:OD600值达到了75,乙酸最终累积浓度也只有1.23 g/L。
由图2可以看出,DO控制成功与否,对于工程菌生长有的显著的影响。DO控制成功后,发酵液的OD600可从40左右提高到了75。乙酸积累从原先的9.2 g/L下降到1.23 g/L,未达到抑制菌体生长的浓度。

图2 溶氧控制失败与成功的菌体生长曲线
通过上述实验的比较,说明DO对于rhG-CSF发酵是至关重要的,但最适DO还需要进行实验考察进行确定。
2.2溶氧浓度对rhG-CSF工程菌高密度发酵生长阶段的影响 分别控制不同的溶氧浓度(5%~40%),进行不诱导高密度发酵,培养9 h后,取样,分别测定发酵液OD600、乙酸含量、质粒稳定性。
在DO控制在5%~25%之间时,发酵最终光密度随着DO的升高也不断升高。当DO在25%~30%之间时,发酵液的OD600值也达到最高值75左右。随后OD600随着DO的增加而减少,此种减少可能是由于供氧过高而导致前期菌体快速生长,导致其他的营养物质过早耗竭,最终使菌体过早衰老,并发生菌体自溶所致,见图3。

图3 不同DO值下的菌体密度
发酵过程中, 追求高溶氧水平未必能得到高表达效果。如Meyer和 Fiechter发现, 用枯草杆菌生产A干扰素时, 溶氧限制在较低水平对产物形成有利[9],可能是在高溶氧浓度下,菌体生理代谢活性较强, 比生长速率较快, 而质粒复制速度赶不上菌体生长速度, 质粒拷贝数减少, 造成质粒稳定性降低,质粒丢失, 最终影响蛋白产量。所以溶氧对工程菌的质粒稳定性的影响必须进行考察,见图4。随着DO值的上升,质粒稳定率也不断下降,当溶氧值大于30%后,质粒稳定率下降的更加明显。
溶氧浓度过低会弱化TCA循环, 改变转录水平的相关基因与葡萄糖和乙酸代谢[10], 导致乙酸大量积累。有文献报道,当发酵液中的乙酸浓度高于5~10 g/L时[11],会对菌体生长产生抑制作用, 降低生物量和蛋白产量。因此不同DO下的乙酸积累浓度也必须进行考察,结果见图5。发酵液中的乙酸浓度,随着DO的上升,不断降低。溶氧值在5%时,乙酸积累浓度高达7.2 g/L,达到抑制菌体生长的浓度,当DO值超过10%之后,发酵液中的乙酸积累量都达不到抑制所需要的浓度。
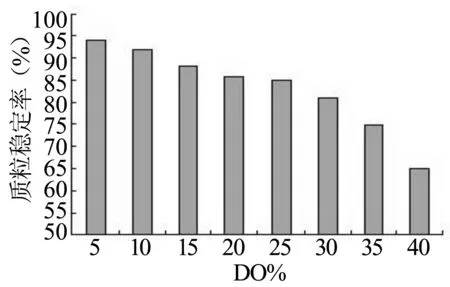
图4 不同DO值下的质粒稳定性

图5 不同DO下的乙酸积累情况
通过对菌体密度、质粒稳定性和乙酸积累浓度三方面的考察以及综合评定,确定了菌体生长阶段的最适溶氧浓度为25%。
2.3不同DO对rhG-CSF表达的影响 将工程菌种子液接种于发酵基础培养基中,控制温度28 ℃,pH 7.0,进行高密度发酵,生长阶段DO控制在25%,当OD600值到达30左右时,然后控制不同的溶氧浓度(5%~45%)下,进行诱导表达,结果见图6。表达量随着所控制的溶氧值升高而升高,当DO值到达35%后,表达量基本趋于稳定,在40%左右。考虑到节约搅拌动力和氧气用量,笔者决定诱导后溶氧值控制在35%。
2.4稳定性研究 确定好的最适溶氧浓度运用于rhG-CSF高密度发酵中,重复进行3批发酵,考察其稳定性。发酵条件为温度28 ℃,溶氧25%、pH7.0,当OD600值达到30左右时,迅速将培养温度升至42 ℃,同时控制溶氧浓度为35%。进行诱导表达,结果见表1,得到基本一致的结果。

图6 不同DO值下的表达量

批号诱导OD600最终OD600表达量(%)菌体量(g/L)F00128.245.840.582F00229.247.141.279F00330.346.538.978
图7 3批发酵菌体电泳图谱
2.5结论 通过在不同溶氧值下工程菌pBVQG8/ MM294高密度发酵下的菌体生长、质粒丢失率、乙酸积累浓度、rhG-CSF表达量的考察,确定了工程菌生长阶段和诱导阶段的最适溶氧浓度,分别为25%和35%。通过对溶氧浓度的优化,工程菌pBVQG8/ MM294高密度发酵最终OD600值为45,菌体量为80 g/L,rhG-CSF表达量为40%。
[1] 张 力,李龙芸,林宏英,等,重组人粒细胞集落刺激因子对肿瘤患者白细胞的影响[J].中国临床药学杂志,2001,10(4):207.
[2] 乌 垠,杨 红,陆 军,等,重组人粒细胞集落刺激因子在Escherichia coli中的表达研究[J].东北师大学报2000,32(4):46.
[3] 李 寅,高海军,陈 坚.高细胞密度发酵技术[M].北京:化学工业出版社,2006: 4.
[4] 卢圣栋,主编.现代分子生物学实验技术[M],北京:高等教育出版社,1993:590.
[5] Yee L, Blanch HW. Recombinant trypsin production in high cell density fed-batch cultures in Escherichia coli[J]. Biotechnol Bioeng, 1993, 41(8): 781.
[6] 俞俊棠,唐孝宣.生物工艺学[M].上海:华东化工学院出版社,1994.
[7] Suare DC, Kilikian BV. Acetic acid accumulation in aerobic growth of recombinant Escherichia coli[J]. Process Biochemistry, 2000, 35: 1051.
[8] 常海燕,范代娣,骆艳娥. 重组大肠杆菌高密度发酵生产类人胶原蛋白Ⅱ条件优化[J].微生物学通报,2009, 36(6): 870.
[9] Meyer HP, Iechter AF. Production of cloned human leukocyt interferon by Bacillus subtilis: Optimal production is connected with rest rained growth[J]. Appl Environ Mi-crobiol, 1985, 50: 503.
[10] Phue J.N, Shiloach J. Impact of dissolved oxygen concentration on acetate accumulation and physiology of E. coli BL21, evaluating transcription levels of key genes at different dissolved oxygen conditions[J]. Metabolic Engi-neering, 2005, 7: 353.
[11] Yee L, Blanch HW. Recombinant trypsin production in high cell density fed-batch cultures in Escherichia coli[J]. Biotechnol Bioeng, 1993, 41(8): 781.
2011-01-22
[修回日期] 2011-04-22
EffectofdissolvedoxygenonhighdensityfermentationofE.coliinproducingrhG-CSF
CEN Yi1, YANG Feng2,TONG Yong1
(1.Shanghai Sunwaybio Company, Shanghai 201206,China;2.Department of Inorganic Chemistry,School of Pharmacy, Second Military Medical University, Shanghai 200433, China)
ObjectiveTo study the density of the dissolved oxygen(DO) on fermentation of E.coli in producing rhG-CSF.MethodsPure oxygen was used to control DO precisely and to observe the growth of engineered bacteria, the lost of plasmids ,the accumulation of acetic acid from different DO density. The optimum density of DO for fermentation was determined.Results25% in growth phase and 30% after induction was optimum density of DO for rhG-CSF expression and engineered bacteria growth. Under these conditions, the wet cell weight reached(79.6±2.1) g/L and the expression of rhG-CSF was(40.2±1.2)%.ConclusionsThe growth of engineered bacteria and the expression of rhG-CSF were influenced by the density of dissolved oxygen significantly.
rhG-CSF; high density fermentation; dissolved oxygen
上海市高新技术成果转化项目[98-0075(5)].
岑 仡(1974-),男,执业药师.共同第一作者:童 涌(1972-),男,硕士,执业药师.
杨 峰.Tel: (021)81871220, E-mail: yangfeng1008@sohu.com.
R966
A
1006-0111(2011)03-0197-04
