口服缓控释微丸的研究进展
2011-11-22宋洪涛
陈 婷,张 倩,宋洪涛
(1.南京军区福州总医院药学科,福建 福州 350025;2.福建医科大学福总临床医学院药学科,福建 福州 350025;3.福建医科大学药学院,福建 福州 350004)
口服缓控释微丸的研究进展
陈 婷1,2,3,张 倩3,宋洪涛1,2
(1.南京军区福州总医院药学科,福建 福州 350025;2.福建医科大学福总临床医学院药学科,福建 福州 350025;3.福建医科大学药学院,福建 福州 350004)
目的综述近年来国内外缓控释微丸的研究进展,并展望微丸制剂的发展前景。方法查阅相关文献,并将其分析、归纳。结果阐明了不同种类缓控释微丸的特点、所选用的辅料、制备工艺及微丸压片技术。结论微丸作为一种多单元释药系统,具有较多优点,随着现代制备工艺的逐渐成熟及辅料的发展,微丸成为目前缓控释制剂发展的重要方向。
微丸;辅料;包衣;压片技术
微丸是直径小于2.5mm的球状制剂,口服后在胃肠道形成均匀分散的微粒系统,避免了药物局部浓度过高引起的对胃黏膜的刺激,有利于药物吸收,从而提高其生物利用度,减少个体差异。同时,微丸还具有释药稳定,载药范围宽(可从1%至95%以上),易制成缓、控释制剂,外形美观,流动性好,产品批间释药重现性高等优点。根据组成结构及释药机制的不同,缓控释微丸可分为:骨架型、膜控型及采用骨架与膜控技术相结合制备的微丸。制成的微丸可直接填充胶囊,也可与适宜的辅料混合后压制成片。本文就近年来国内外微丸制剂的研究进展作一综述。
1 骨架型微丸
骨架型微丸一般由药物、骨架材料(也称为阻滞剂)和致孔剂组成。致孔剂旨在增加微丸内部孔隙率以调节药物释放速率,多为一些水溶性物质,如羟丙甲纤维素(HPMC)、聚乙二醇等。骨架材料可分为亲水性凝胶类、水不溶性高分子聚合物和蜡质脂肪类。
1.1亲水性凝胶骨架微丸 对于水溶性药物,其释药机制主要是药物的扩散和凝胶层的不断溶蚀;对于难溶性药物,释药机制主要以骨架溶蚀为主。以海藻酸钠与氯化钙反应制得的海藻酸钙凝胶微丸作为口服释药的载体是很好的选择,尤其对难溶性及大分子药物更具优势。马萍等[1]以此制备了硝苯地平凝胶微丸,其可容纳大量水分,且溶胀具有pH敏感性,在水和0.1 mol/L盐酸溶液中几乎不溶胀,而在pH6.8的磷酸盐缓冲液中溶胀。以加有吐温-80 pH6.8 的磷酸盐缓冲液为释放介质进行考察,结果2 h时累积释放量为20%~30%,6 h为60%~80%,12 h时大于85%,释药行为符合一级方程,具有良好的缓释作用。卡波普[2]亦是一种理想的缓、控释材料,作为微丸的骨架材料能使微丸粘附在胃肠壁上,延长药物在肠道内的滞留时间,尤其对有特定吸收部位的药物,能够提高其吸收。此外,HPMC、壳聚糖也是亲水凝胶骨架微丸中常用的辅料。
1.2溶蚀型骨架微丸 溶蚀性材料由于基本无毒、无刺激性,每日允许摄入量不受限制且可用于提高水不溶性药物体内生物利用度而受到药学工作者的青睐,其释药机制主要是溶蚀-分散-溶出过程。
Krause等[3]采用无水挤出滚圆法以15%Witocan42/44、2.5%Dynasan114及2.5%Precirol ATO5为载体制备了载药量达80%的苯甲酸钠速释微丸,但制得的微丸与采用微晶纤维素(MCC)或κ-卡拉胶制得的微丸相比释药更平缓。该方法是通过挤出过程中的摩擦力等使溶蚀性材料熔化充当粘合剂使物料经挤出作用形成长条状挤出物再经滚圆制备得微丸,与湿法制备微丸相比亦省去了干燥过程,因此对于温度敏感性、易挥发性及对水敏感的药物是很好的选择。与其它固体脂质挤出技术相比,该法所用设备简单,分析其快速释药的原因可能与以下两点有关:①载药量高达80%;②苯甲酸钠水溶性很好。因此,也可采用此法提高溶蚀性材料的用量以制备难溶性药物的缓释微丸。
Cheboyina等[4,5]的研究以茶碱和盐酸地尔硫(DHCl)为模型药物,以十六烷基酯蜡、十六醇、单硬脂酸甘油酯(GMS)、黄蜂蜡、甘油棕榈酸硬脂酸酯为蜡质材料,以一种新型的冷冻制丸法制备骨架缓释微丸。该技术是以胶体二氧化硅为助悬剂,以聚氧乙烯月桂醚为表面活性剂,将药物分散在熔融的蜡质材料中以液滴的形式从下端进入装有80%甘油水溶液的柱内,控制柱的前端柱温为75 ℃,后端冷却温度为15 ℃,然后在柱的上端收集微丸并用去离子水洗3次后干燥,即得,装置见图1。该技术制得的含药微丸可达20%的载药量及(100±10)%的药物回收率,但不同药物其载药量不同,且所选用蜡质材料不同,药物所呈现的状态与释放动力学也各不相同。如上述各种蜡质材料制备的茶碱微丸,当药物载药量低时,药物呈溶解状态,释放规律符合解吸附动力学;而当载药量≥10%时,药物呈晶体状态,释放规律符合零级方程;但当聚氧乙烯月桂醚的量增大时,茶碱释放加快,释药规律符合Higuchi方程,而制备的 DHCl 甘油棕榈酸硬脂酸酯微丸无论载药量高低,均符合Higuchi方程。因此,可采用该种新技术制备不同药物不同释放性质的蜡质骨架微丸。
1.3不溶性骨架微丸 不溶性骨架微丸是用不溶于水或水溶性极小的高分子聚合物材料与药物混合制备而成。胃肠液渗入骨架孔隙后,药物溶解并通过骨架中错综复杂的极细通道,缓缓向外扩散而释放,在药物的整个释放过程中,骨架几乎没有改变,最终随粪便排出。
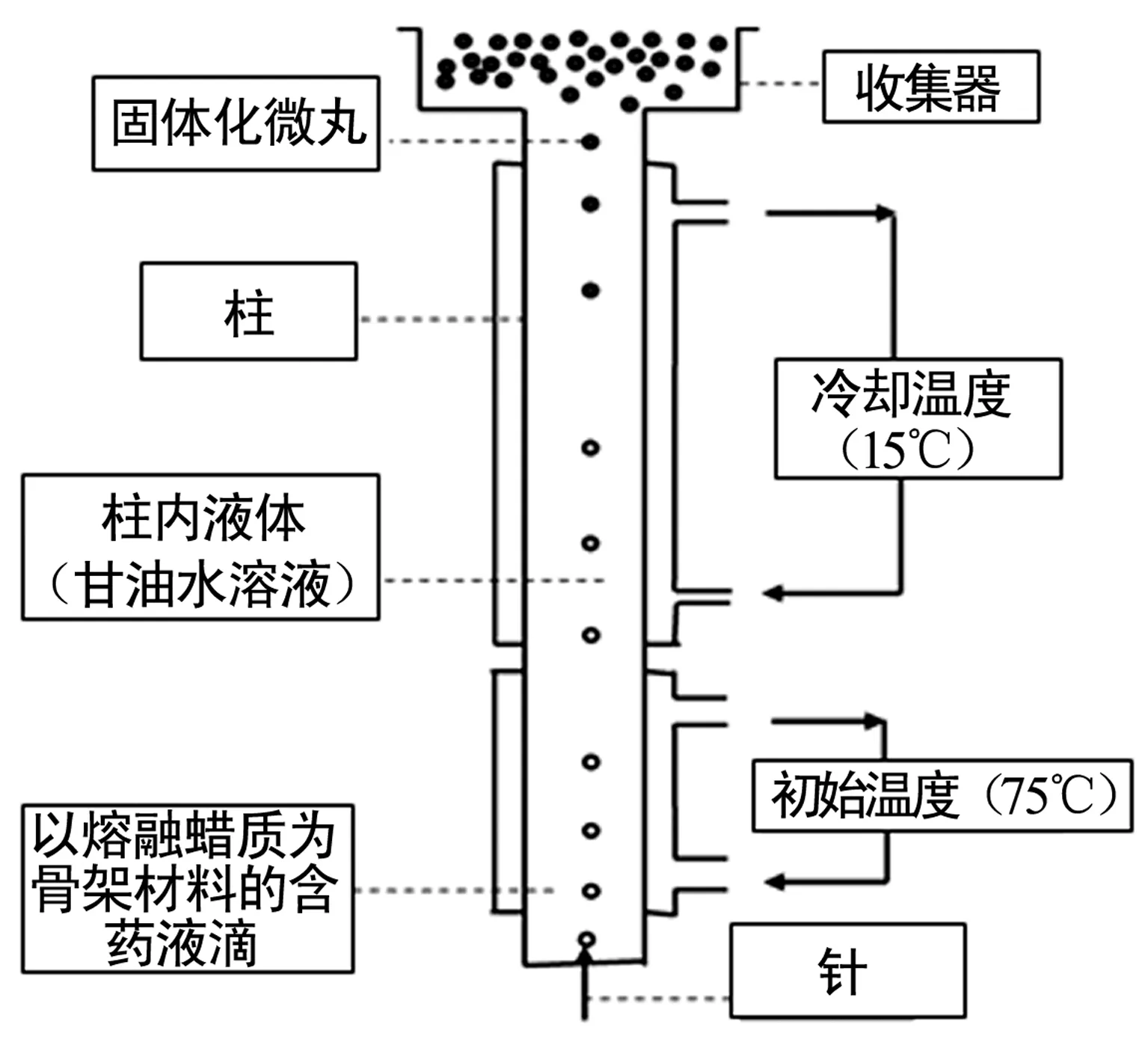
图1 冷冻制丸装置图
熔融挤出技术凭借能将药物改性和成型合为一体的优势受到越来越多药学研究人员的青睐。Young等[6,7]在熔融挤出技术基础上开发了熔融挤出滚圆工艺,并制备了茶碱缓释微丸。他们先将茶碱、骨架材料丙烯酸树脂4135F、固体增塑剂聚乙二醇 8000加入挤出机中,在螺杆的推进下前移,经熔融段、均化段物料均匀混合,最后以直径1.22 mm左右的条状挤出,再用切割机将其均匀切段,然后投到滚圆机,在旋转的同时,锅底鼓入热风,小段在温度的作用下产生塑性,在离心力的作用下翻滚碰撞,逐渐磨平棱角,成为球形,为防止颗粒间的粘结,可适当撒入MCC粉末。由于处方中加入了增塑剂,物料塑化温度得以降低,即使滚动时间较长也不会引起药物的热降解。该种技术集多种单元操作为一体,降低了成本,且能高效率生产,在熔融混合时,当物料中的一种是药物,另外几种是载体时,就能形成固体分散体,再制成骨架制剂,可显著提高难溶性药物的释放速率,增加药物的体内吸收。
1.4混合型骨架微丸 目前,多用水不溶性高分子材料与蜡质或亲水性材料混合制备混合型骨架微丸。学者多以乙基纤维素(EC)和硬脂酸为疏水材料制备混合型骨架微丸[8~10]。处方中的硬脂酸经热处理后能在乙基纤维素周围形成致密结构,有助于达到缓释目的;而乙基纤维素则能嵌合在硬脂酸形成的溶蚀性骨架中,起到加固作用,同时阻塞部分孔隙使孔道曲率增加,减缓药物的释放速率。所制得的微丸以药物扩散为主要释放机制,兼有硬脂酸的骨架溶蚀作用。此外,处方中加入的适量MCC可使微丸成型性更好。
2 膜控型微丸
膜控型微丸是在丸芯外包裹缓、控释衣膜而成,分为药物与辅料直接混合制备含药丸芯后喷包衣液以及在空白丸芯外喷含药包衣液两种,当药物剂量较大时可选择前者,剂量较小时可选择后者。包衣所使用的膜材主要分为水溶性、肠溶性和水不溶性材料。缓控释包衣常用不溶性的丙烯酸树脂NE、RL、RS型以及EC水分散体等包衣材料。可以选择一种或混合使用几种成膜材料,通过改变材料的组成和比例,制备不同释药规律的微丸制剂。
Eudragit NE30D型为非pH依赖型,在不同介质中均为渗透型,仅随着时间的延长衣膜渗透性有所改变,无需加入增塑剂。关世侠等[11]采用Eudragit NE30对制得的非诺贝特含药素丸进行包衣,当包衣增重3% 时缓释效果良好,体外释药过程符合Higuchi方程。此外,还可加入适量肠溶性辅料Eudragit L30D-55,以增加衣膜的渗透性。Eudragit L30D-55在低pH值时作为释放阻滞剂,当pH>5.5时,包衣膜部分溶解起到致孔作用,加快药物的释放速率,避免生物利用度的降低。
丙烯酸树脂RL、RS型常联合用于制备各种缓释微丸。Kramar等[112]采用流化床包衣法制备双氯芬酸钠缓释微丸,采用Box-Behnken组合设计法考察了增塑剂浓度、EudragitRS和RL的比例等因素对包衣的影响,结果表明当增塑剂柠檬酸三乙酯的浓度为25%,EudragitRS和RL的比例为3:1时,3 h时累积释放量达到40%,符合预期目标,呈现出最好的缓释效果。
EC水分散体成膜后由于渗透性低,常存在释药过缓或释药不完全现象,Siepmann等[13]以EC水分散体(Aquacoat ECD)为包衣液制备茶碱缓释微丸(包衣增重10%、20%),测定其释放度,无论在0.1 mol/L HCl或pH7.4的缓冲液中8h内药物的释放均小于10%,而在包衣液中分别加入5%~20%的水溶性聚乙烯醇-聚乙二醇接枝共聚物(PVA-PEG),在相同包衣增重条件下药物释放速率随PVA-PEG在包衣液中比例的增大而加快,当包衣增重为20%,PVA-PEG含量为20%时,制备的茶碱微丸在pH7.4的缓冲液中8 h内可释放完全。这与加入PVA-PEG后膜材的吸水性增加,干重减少及渗透性增加有关。其释放均为扩散机制,不受药物的溶解性及丸芯的处方等性质影响[14]。且与加入HPMC相比,PVA-PEG不会引起包衣液的絮凝。
近年,Sriamornsak等[15,16]研究以多聚糖-钙作为薄膜包衣材料制备结构相似但水溶性不同的3种药物:咖啡因、茶碱、可可碱(水溶性依次递减)的缓释微丸,与未包衣前3种药物微丸的体外释放度进行比较,结果可可碱微丸的释放仍然最慢,这可能与药物自身的水溶性不同导致包衣微丸内药物溶解度不同,最终导致药物扩散速率不同有关,但3种微丸包衣后释放速度均比包衣前减缓了4~6 倍。因此,多聚糖-钙可作为这些药物的缓释包衣材料。
3 膜控与骨架技术相结合制备微丸
采用膜控与骨架技术相结合制成的微丸是在骨架微丸基础上进一步包薄膜衣而成。
首先,可通过丸芯材料的选择控制药物的载药量、释放速率等性质。对于水易溶性药物,可加入一些水不溶性填充剂来控制其释放速率;对于一些水难溶性药物,可加入水溶性辅料、表面活性剂或在液体环境下能产生较强渗透压的物质如糖类,以解决药物释放过于缓慢的问题,亦可先将药物制成固体分散体后再制备骨架微丸。有学者以泊洛沙姆188(F68)为载体材料,采用热熔法制备硝苯地平固体分散体,然后以丙烯酸树脂Ll00-55和S(1:3)为骨架材料制备硝苯地平骨架微丸及硝苯地平固体分散体骨架微丸。由释放度研究表明,硝苯地平骨架微丸释药曲线符合24 h零级过程,而固体分散体骨架微丸释药曲线符合12 h一级过程,释药速率显著提高,且固体分散体中F68比例越高,其释药速率相应增加。
此外,MCC凭借其优越的性能在微丸制备中受到广泛的使用,但以下方面仍限制其使用范围:①对于某些水不溶性药物来说,以MCC制备的微丸释放过于缓慢;②某些药物与之有配伍禁忌;③某些药物会吸附于MCC上,因此众多学者致力于改性MCC及其替代物的研究。Podczeckd等[17]以水溶性依次降低的3种药物:维生素C、乳糖、布洛芬为模型,以挤出-滚圆法制备微丸,通过与未改性MCC相比,对两种加有不同量羧甲基纤维素钠的改性MCC的载药量进行探讨,结果对于水溶性相对较高的乳糖与维生素C,3种MCC作为赋型剂均可使微丸载药量达到80%,但对于水不溶性药物布洛芬,只有两种改性MCC能使微丸的载药量达到80%,这与挤出滚圆过程中,改性MCC能保留水分,防止水分迁移有关。Roblegg等[18]以布洛芬为模型药物研究以硬脂酸钙替代MCC制备微丸,制备的载药量为15%~25%的微丸无需包衣即可达到缓释目的,体外释放考察表明微丸在24 h内不崩解,但释放度符合要求,微丸的粒径、所用的粘合剂等均会影响药物的释放速率。此外,粉状纤维素、淀粉、壳聚糖、κ-卡拉胶、果胶酯酸、羟丙甲纤维素、羟乙基纤维素、聚乙烯纤维素、交联聚维酮、单硬脂酸甘油酯等均可作为替代物[19]。
其次,可通过包衣层控制药物的释放。Sousa等[20]的研究表明,比起药物自身的理化性质和丸芯各材料的性质,衣膜材料是控制药物释放行为的主要因素。许多药物由于溶解度低存在生物利用度低的问题。可将药物溶于自微乳化系统后加入其它辅料制备丸芯,然后通过包衣制备缓释微丸以改善上述问题。Serratoni等[21]分别以尼泊金甲酯、尼泊金丙酯为模型药物,先将药物溶于单辛酸甘油酯、二辛酸甘油酯、吐温80等组成的自微乳化系统(30.5%)中,然后与MCC及一水乳糖的混合物置于行星混合器混合10min后置于挤出机中使成长条状,经滚圆5 min后于30 ℃烘干12 h,最后以含3%EC、2%乳糖及0.6%甘油的96%乙醇液为包衣液,采用底喷法制备不同包衣增重的包衣微丸。对制得的微丸进行释放度考察,结果表明,与药物直接和MCC、一水乳糖经湿法制备的未包衣微丸相比,药物溶于自微乳化系统后制备的未包衣微丸其药物释放明显加快(以尼泊金丙酯为例,1 h时前者为33%,后者为85%),而通过对后者进行包衣,可达缓释目的,不同包衣增重达到的缓释效果不同。通过内外双重调节,不但解决了因药物溶解度低造成生物利用度低的问题,而且缓释效果理想。
4 微丸压片技术的研究
目前上市的品种多数是将微丸装入普通空心胶囊制成胶囊剂,但由于胶囊体积一般偏大,患者吞咽相对较难,分剂量准确性较差,且灌装胶囊的成本要比压片高,因此,出现了微丸压片技术。其最突出的优点是剂量可分割,且分割后仍能保持原来的缓控释性质,此外压制成的片剂服用后在胃肠道可迅速崩解或离散成单一微丸,这为临床用药提供了更加灵活的剂量方案,特别是对于治疗指数较小,剂量需随时调整的药物,具有重大的意义。
将微丸压制成片,辅料的选择非常重要。包衣微丸一般使用干法直接压片,但存在衣膜易破碎等问题,因此,辅料除作为填充剂、崩解剂、润滑剂或粘合剂外,还充当微丸形变时的缓冲垫。这就要求辅料自身有一定的弹性,能够缓解压片引起的微丸的形变,且在较低的压力下能提高片剂的硬度,还能保证片剂迅速崩解,不影响药物释放。此外,还应能与膜控微丸混合均匀,以避免压片过程中的分层而使药物含量均一性下降。建议使用粒径较大的辅料或加入不含药的空白微丸以起到稀释的作用。多项研究表明,MCC并不能使膜控微丸衣膜破碎降至最低程度,且兼顾压制后片剂的释放度,MCC联合聚乙二醇类、磷酸二氢钙、交联聚维酮及各种蜡质材料才可达到理想的效果[22]。
目前膜控微丸压制成片的上市品种较少,如奥美拉唑多单元微丸系统(商品名:Antra®MUPS)、兰索拉唑多单元微丸系统(商品名:Prevacid®SoluTabTM)及酒石酸美托洛尔缓释多单元片剂(商品名:Beloc®ZOK)等。以后者为例,每片含数百至上千个直径约0.5mm或更小的微丸。每个微丸内核为活性药物美托洛尔,外层由不被蛋白酶水解的乙基纤维素多聚体外膜包裹。将这些数百成千的微丸和无活性的赋形剂压缩在一起,形成了可掰开使用的缓释片,一掰为二的每一部分仍保持稳定的缓释特性。药片进入胃内迅速崩解,微丸释放并广泛分布于消化道内。每个微丸都作为独立扩散单位传输药物,其方式为体液经外膜渗入丸内溶解酒石酸美托洛尔形成饱和溶液,并以恒速持续不断向外释放,供机体吸收利用。
5 展望
由于微丸具有众多优点,且伴随制备设备的日益现代化、制备工艺及各种薄膜包衣辅料的逐渐发展,微丸制剂在现代药品开发和应用上越来越受到重视。且大多上市的口服释药微丸是20世纪90年代申请的美国专利,即将在近年内失效,使得专利到期的药品成为可挖掘的金矿,将成为我国研制开发仿制药的一个重要方面。因此,该领域有着巨大的潜力和广阔的发展前景。
[1] 马 萍,孙淑英,辛艳茹,等.硝苯地平海藻酸钙凝胶缓释微丸处方及工艺的优化[J].沈阳药科大学学报,2003,20(6):406.
[2] 郑建津,沈慧风.卡波普在口服缓释制剂中的应用概况[J].中国药学杂志,2002,37(2):84.
[3] Krause J,Thommes M,Breitkreutz J.Immediate release pellets with lipid binders obtained by solvent-free cold extrusion[J].Eur J Pharm Biopharm,2009,71:138.
[4] Cheboyina S,Wyandt CM.Wax-based sustained release matrix pellets prepared by a novel freeze pelletization technique I. Formulation and process variables affecting pellet characteristics[J].Int J Pharm,2008,359(1-2):158.
[5] Cheboyina S,Wyandt CM.Wax-based sustained release matrix pellets prepared by a novel freeze pelletization technique II. In vitro drug release studies and release mechanisms[J].Int J Pharm, 2008,359(1-2):167.
[6] Young CR, Koleng JJ,McGinity JW.Production of spherical pellets by a hot-melt extrusion and spheronization process[J].Int J Pharm,2002,242(1-2):87.[7] Young CR,Dietzsch C,McGinity JW.Compression of controlled-release pellets produced by a hot-melt extrusion and spheronization process[J].Pharm Dev Technol,2005,10(1):133.
[8] 刘 扬,张 玮,袁 臻,等.去甲斑蝥素骨架型缓释微丸的工艺优化[J].中国医院药学杂志,2008,28(15):1243.
[9] 陈大为,张彦青,邹艳霜,等.灯盏花素缓释微丸制备工艺与处方优化的研究[J].中草药,2003,34(11):990.
[10] 蔡翠芳,毕殿洲,毛世瑞.挤出滚圆法制备氢溴酸右美沙芬骨架缓释微丸[J].沈阳药科大学学报,2003,20(5):313.
[11] 关世侠,杨 民,李海刚,等.非诺贝特缓释微丸的制备及释放度研究[J].中国医院药学杂志,2008,28(9):712.
[12] Kramar A,Turk S,Vrecer F.Statistical optimisation of diclofenac sustained release pellets coated with polymethacrylic films[J].Int J Pharm,2003,256(1-2):43.
[13] Siepmann F,Hoffmann A,Leclercq B,etal.How to adjust desired drug release patterns from ethylcellulose-coated dosage forms[J].J Controlled Release,2007,119:182.
[14] Muschert S,Siepmann F,Leclercq B,etal.Drug release mechanisms from ethylcellulose: PVA-PEG graft copolymer-coated pellets[J].Eur J Pharm Biopharm,2009,72:130.
[15] Serratoni M,Newton M,Booth S,etal.Controlled drug release from pellets containing water-insoluble drugs dissolved in a self-emulsifying system[J].Eur J Pharm Biopharm,2007,65:94.
[16] Sriamornsak P,Kennedy RA.Effect of drug solubility on release behavior of calcium polysaccharide gel-coated pellets[J].Eur J Pharm Sci,2007,32(3):231.
[17] Podczeck F, Knight PE, Newton JM.The evaluation of modified microcrystalline cellulose for the preparation of pellets with high drug loading by extrusion/spheronization[J].Int J Pharm,2008,350:145.
[18] Roblegg E,Ulbing S,Zeissmann S,etal.Development of lipophilic calcium stearate pellets using ibuprofen as model drug[J].Eur J Pharm Biopharm,2010,75(1):56.
[19] Dukic′-Ott A,Thommes M,Remon JP,etal.Production of pellets via extrusion-spheronisation without the incorporation of microcrystalline cellulose: A critical review[J].Eur J Pharm Biopharm,2009,71:38.
[20] Sousa J,Sousa A,Moura J,etal.The influence of core materials and film coating on the drug release from coated pellets[J].Int J Pharm,2002,233(1/2):111.
[21] Sriamornsak P,Burton MA,Kennedy RA.Development of polysaccharide gel coated pellets for oral administration 1. Physico-mechanical properties[J].Int J Pharm,2006,326(1-2):80.
[22] Abdul S,Chandewar A,Jaiswal S.A flexible technology for modified-release drugs: Multiple-unit pellet system (MUPS)[J].J Controlled Release,2010,147(1):2.
2010-09-15
[修回日期] 2010-12-21
Progressoforalsustained-releaseandcontrolled-releasepellets
CHEN Ting1,2,3,ZHANG Qian3,SONG Hong-tao1,2
(1.Department of Pharmacy,Fuzhou General Hospitol of PLA,Fuzhou 350025,China;2. Department of Pharmacy,School of clinical medicine of Fuzhou General Hospital,Fujian Medical University,Fuzhou 350025,China;3. School of Pharmacy,Fujian Medical University,Fuzhou 350004,China)
ObjectiveTo summarize the recent advances in oral sustained/controlled release pellets in international and domestic and prospect its developing future.MethodsA great quantity of references were comprehensively reviewed.ResultsVarious kinds of information of oral sustained/controlled release pellets including the characteristic,excipients,preparation methods and squash technique were summarized.ConclusionsPellets as multiple-unit drug delivery system have many advantages.With preparation techniques and excipient materials were gradually developed,pellets would play an important part in the development of sustained/controlled release drug delivery system.
pellets;excipient;coating;squash technique
陈 婷(1986-),女,硕士研究生.Tel:(0591)22859972,E-mail:chenting2010new@163.com.
宋洪涛. Tel:(0591)22859459,E-mail:sohoto@vip.sohu.com.
R944.9
A
1006-0111(2011)03-0169-05
