Toll样受体4/核因子-κB对哮喘大鼠气道炎症和重构的影响*
2011-11-20韦江红莫碧文黄剑伟
韦江红, 莫碧文, 黄剑伟
(桂林医学院附属医院呼吸内科,广西 桂林 541001)
Toll样受体4/核因子-κB对哮喘大鼠气道炎症和重构的影响*
韦江红, 莫碧文△, 黄剑伟
(桂林医学院附属医院呼吸内科,广西 桂林 541001)
目的: 探讨TLR4/NF-κB对哮喘大鼠气道炎症和气道重构的影响。方法将18只SD大鼠随机分成3组:对照组、哮喘4周组和哮喘8周组,每组6只。造模成功后,利用HE染色、免疫组织化学方法及病理图像分析系统分析大鼠气道平滑肌的嗜酸性粒细胞(EOS)浸润情况、气道壁厚度以及增殖细胞核抗原(PCNA)和Bcl-2的蛋白表达量。利用RT-PCR和Western blotting检测ASM中TLR4和NF-κB的mRNA及蛋白表达。结果哮喘4周组和哮喘8周组的气道壁EOS计数、气道壁厚度、气道反应性均较正常对照组显著增加(Plt;0.01);哮喘4周组和哮喘8周组的TLR4及NF-κB的mRNA水平和蛋白表达与对照组比较均显著增加(Plt;0.01);TLR4及NF-κB的mRNA水平随哮喘天数的增加而显著增加(Plt;0.01);哮喘4周组、哮喘8周组PCNA和Bcl-2的蛋白表达量均显著高于正常对照组(Plt;0.01);哮喘两组间上述指标差异显著(Plt;0.05或Plt;0.01)。结论TLR4/NF-κB可能参与哮喘大鼠气道炎症和气道重构的调控。
Toll样受体4; 哮喘; 细胞增殖; 细胞凋亡
支气管哮喘(以下简称哮喘)是世界范围内一种常见多发性慢性气道炎症性疾病,迄今它的发病机制仍未完全明确。大量研究显示,Toll样受体(Toll-like receptors,TLRs)是天然免疫和获得性免疫之间的桥梁[1],在哮喘的发生发展中可能起着较为重要的作用[2]。核因子-κB(nuclear factor kappa B,NF-κB)是一种普遍存在于细胞质中的重要的、多向性的核转录因子,其位于TLRs下游信号通路的枢纽位置,参与免疫反应、细胞增殖与分化等过程。
目前国内外对TLR4的研究均局限于体外实验,即对气道平滑肌细胞(airway smooth muscle cells,ASMCs)功能的研究,未见整体动物实验的研究,因此,我们将建立哮喘动物模型,从整体水平探讨TLR4/NF-κB对哮喘气道炎症和气道重构及平滑肌增殖、凋亡的影响。
材 料 和 方 法
1材料
SPF级SD大鼠(雄性,200-250 g)由广西医科大学实验动物中心提供;戊巴比妥钠、卵清白蛋白、氢氧化铝凝胶和多聚甲醛均为Sigma产品;灭活百日咳杆菌为北京生物研究所提供;Taq DNA聚合酶、dNTPs、逆转录酶(M-MLV)、随机引物(random primer)、琼脂糖和焦碳酸二乙酸均由大连宝生公司提供;PCR特异引物、内参照β肌动蛋白(β-actin)引物及特异性引物均由上海生物工程有限公司合成;地塞米松为扬子药业产品; PCNAⅠ抗、Bcl-2Ⅰ抗和TLR4Ⅰ抗购自武汉博士德公司;通用蛋白裂解液、吐温20、考马斯亮蓝和辣根过氧化物酶标记的羊抗兔IgG购自碧云天公司;PCR仪为MJ Research Co产品;低温高速离心机为Beckman产品,紫外分光光度仪为Biochrom产品;GBOX HR型全自动凝胶图像分析仪为德国产品;Image-Pro Plus 6.0 病理图像分析软件为PDA;402AI型超声雾化器为江苏省鱼跃医疗设备有限公司产品;小动物解剖器械由上海医疗器械(集团)有限公司手术器械厂提供;BG-SUBMINI水平电泳仪和BG-VERMINI垂直电泳仪均为Baygene产品。
2方法
2.1哮喘大鼠模型的建立 第1、8 d将每只大鼠于皮下注射10 mg卵清蛋白(ovalbumin,OVA)和200 mg氢氧化铝凝胶(混合于1 mL PBS缓冲液),同时腹腔注射5×109个灭活百日咳杆菌致敏大鼠。于第15 d开始激发:将大鼠置于一密闭容器中,予2%OVA磷酸盐缓冲液50 mL雾化吸入刺激,每天1次,每次30 min。诱喘成功后大鼠出现烦躁不安,进而呼吸加快、加深,静伏不动、弓背,严重者伸颈、缩胸、收缩呈喘息状,甚至大小便失禁等。对照组则以磷酸盐缓冲液代替致敏原注射和雾化吸入。
2.2实验分组 将18只SD大鼠随机分成3组,每组6只。A组(对照组):雾化吸入生理盐水4周;B组(哮喘4周组):每天激发哮喘1次,共4周;C组(哮喘8周组):每天激发哮喘1次,共8周。
2.3气道反应性的测定 气管切开插管,接三通管。一管连接动物呼吸机,潮气量10 mL/kg,频率60次/min;一管连接呼吸机测压管道。可直接测气道压力,读数。将盐酸组胺配成1.28 g/L,然后双倍稀释至0.01 g/L。首先将PBS经雾化器喷入气管插管内,记录气管内压(airway pressure,Paw),然后将盐酸组胺的磷酸缓冲液从低浓度开始喷入,1 min开始测压。若Paw升高不到PBS对照的20%,间隔10 min喷入下一浓度,直到Paw升高20%为止。此时,所需雾吸组胺浓度作为PC20的值。
2.4标本的制备 上述各组大鼠,最后1次激发后24 h内,分别测定气道阻力,后立即行腹主动脉放血处死,开胸迅速剥离右肺,分离气道平滑肌(airway smooth muscle,ASM)-80℃冻存,用于RT-PCR测定及Western bloting;左肺气管内注入4%多聚甲醛约6 mL固定,并置4%多聚甲醛中保存,石蜡包埋备做常规HE染色及免疫组织化学染色。(1) HE染色:经脱蜡、脱水的肺组织石蜡切片,苏木素染色,70%盐酸乙醇分化,流水冲洗10 min,1%NaHCO 液中漂洗至蓝紫色,伊红染色5 s,乙醇梯度脱水,二甲苯透明,中性树胶封片,光镜观察。(2)气道壁嗜酸性粒细胞(eosinophils,EOS)计数:石蜡切片作常规HE染色后,选择结构较完整的支气管壁,由同一观察者随机计数5个高倍视野(×400)下支气管壁EOS数,取其均数。(3)气道壁厚度的测定:取各组HE染色左肺3-4级完整支气管,测量管腔的内周长(perimeter inner,Pi)、管壁面积(wall area,WA)、支气管平滑肌面积(smooth muscle area,SMA)和支气管平滑肌细胞核数(the number of bronchial smooth muscle nucleus,N)。将测得的后3个值用Pi进行标准化,分别以WA/ Pi、SMA/ Pi和N/ Pi 表示。
2.5RT-PCR检测TLR4及NF-κB的mRNA水平 取分离的ASM立即在液氮下研磨,加入RNA提取试剂Trizol(Invitrogen)抽提RNA,严格按试剂盒说明书操作。产物mRNA于-80 ℃保存,用于一步法RT-PCR。
① TLR4 RT-PCR扩增反应 TLR4上游引物5’-CGCTTTCACCTCTGCCTTCACTACAG-3’,下游引物5’- ACACTACCACAATAACCTTCGGCTC -3’,扩增产物长度为270 bp。β-actin上游引物5’- GATTACTGCTCTGGCTCCTGC-3’,下游引物5’-GAC-TCATCGTACTCCTGCTTGC-3’,扩增产物长度为150 bp。严格按大连宝生生物公司DRR024A一步法RT-PCR反应体系说明书操作。TLR4和β-actin的上、下游引物各1 μL,扩增产物进行琼脂糖电泳。
② NF-κB PCR扩增反应 NF-κB上游引物5’-GCACGGATGACAGAGGCGTGTATAAGG-3’,下游引物5’- GGCGGATGATCTCCTTCTCTCTGTCTG -3’,扩增产物长度为420 bp。β-actin上游引物5’- GATTACTGCTCTGGCTCCTGC-3’,下游引物5’-GACTCATCGTACTCCTGCTTGC-3’,扩增产物长度为190 bp。严格按大连宝生生物公司DRR024A一步法RT-PCR反应体系说明书逐步操作,NF-κB和β-actin的上、下游引物各1 μL,扩增产物进行琼脂糖电泳。
③ 琼脂糖电泳 反应成功后,取5 μL PCR产物加1μL DNA上样缓冲液和PCR marker,点样在2%琼脂糖凝胶的样板孔中,凝胶中含有0.5 mg/L的溴化乙啶(EB)显色,电泳电压0.8 V/cm,时间30 min。电泳结束后,采用GBOX HR型全自动图像分析仪对电泳结果进行分析:分别测定每一个目的基因及看家基因β-actin的吸光度值,取目的基因与β-actin吸光度值的比值。
2.6Western bloting检测ASM中TLR4蛋白的表达 支气管平滑肌经机械分散后通用蛋白裂解液提取支气管平滑肌总蛋白,用Bradford法测定总蛋白浓度,分装,-80 ℃冻存,待测。聚丙烯酰胺凝胶电泳步骤如下:取40 μg蛋白质样品(使用前煮沸变性)上样后,先以10 V/cm电压电泳,溴酚蓝进入分离胶后,
改电压为18 V/cm。电泳结束后取出分离胶,安装半干式电转移仪,转膜。取出硝酸纤维素膜,加入封闭液,摇床上室温孵育1 h。弃封闭液,将膜放入塑料袋中,加入Ⅰ抗稀释溶液(兔抗鼠TLR4抗体:稀释度1∶1 000),摇床上室温孵育4 h。孵育结束回收Ⅰ抗,用TBST漂洗滤膜3次,10 min/次。然后,加入TBS及Ⅱ抗稀释溶液(羊抗兔IgG,稀释度1∶100),摇床上室温孵育2 h。取出,TBST中室温漂洗,共3次,10 min/次。最后加入底物显色液,待蛋白条带颜色深度适当,即用PBS缓冲液漂洗,将滤膜用GBOX HR凝胶成像分析系统进行扫描读取各条带的吸光度(A)值。
2.7增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及凋亡蛋白Bcl-2的免疫组织化学染色 取石蜡切片后根据SP法染色试剂盒说明步骤进行免疫组织化学染色,Ⅰ抗分别选用小鼠抗大鼠PCNA和Bcl-2单克隆抗体,稀释度均为1∶200。阴性对照选用PBS缓冲液代替Ⅰ抗,其它步骤相同。
3统计学处理
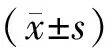
结 果
1肺组织HE染色及气道壁EOS浸润情况
哮喘4周组、哮喘8周组大鼠肺组织HE染色可见细支气管及血管周围、肺泡腔、肺泡隔内大量EOS浸润,细支气管腔内有过度分泌的黏液;黏膜下层和平滑肌层增厚,管腔变形狭窄;基底膜有大量的胶原沉积。正常对照组无明显炎症反应,肺泡腔以及肺间质内未见到EOS,基底膜胶原沉积很少,见图1。
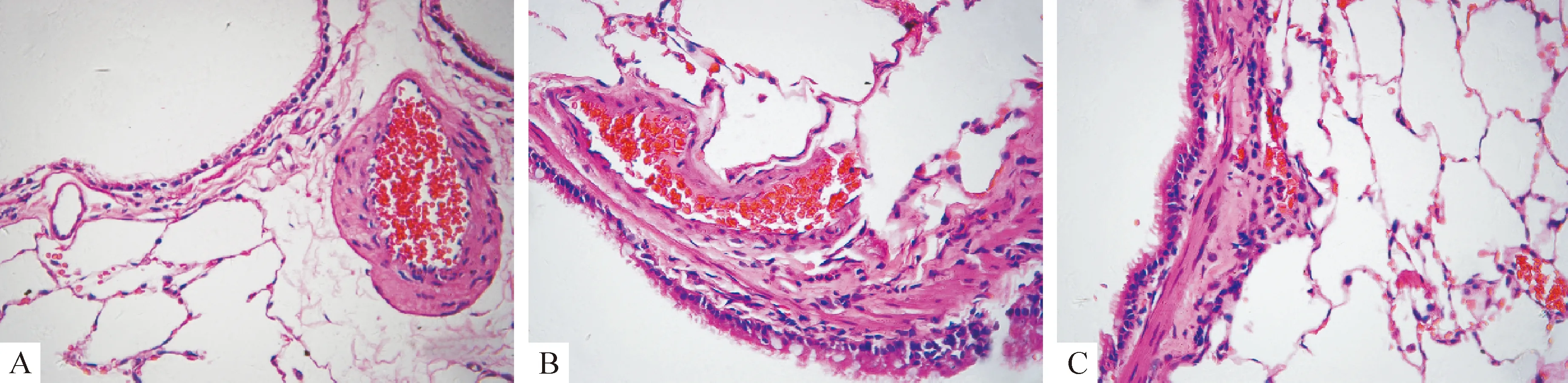
Figure 1.HE staining of lung tissues in the three groups(×400).A:control group; B: asthmatic 4 weeks group; C: asthmatic 8 weeks group.
哮喘4周组、哮喘8周组的气道壁EOS计数均较正常对照组显著增加(均Plt;0.01),且随哮喘天数的增加EOS计数也有增加的趋势,且两组间比较差异显著(Plt;0.05),见表1。
表1 各组大鼠气道壁EOS浸润情况及气道反应性比较
2支气管壁厚度、支气管平滑肌厚度及支气管平滑肌细胞核数量的比较
哮喘4周组及哮喘8周组支气管壁厚度(WA/Pi)、支气管壁平滑肌厚度(SMA/Pi)和支气管壁平滑肌细胞核数量(N/Pi)均较正常对照组显著增加(Plt;0.01),且随哮喘天数的增加上述指标亦有增加趋势,哮喘8周组较哮喘4周组显著增加(Plt;0.01),见表2。
表2 各组大鼠WA/Pi、平滑肌的面积/Pi和N/Pi的比较
3气道反应性变化
比较各组大鼠气道反应性结果显示:哮喘4周组和哮喘8周组的气道反应性均显著高于正常对照组(Plt;0.01),哮喘8周组气道反应性较哮喘4周组显著增高(Plt;0.01),见表1。
4RT-PCR检测ASM中TLR4及NF-κB的mRNA水平。
各组电泳图经扫描发现: 哮喘4周组和哮喘8周组的TLR4及NF-κB的mRNA水平显著高于对照组(Plt;0.01);TLR4及NF-κB的mRNA水平随哮喘天数的增加而显著增加(Plt;0.01);见表3、图2、3。
5Westernblotting检测ASM中TLR4蛋白的表达
各组电泳图经扫描发现: 哮喘4周组和哮喘8周组ASM的TLR4蛋白表达显著高于对照组(Plt;0.01);哮喘8周组的TLR4蛋白表达显著高于哮喘4周组(Plt;0.01),TLR4蛋白水平随哮喘天数的增加而显著增加,见表3、图4。
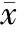
表3 各组大鼠ASM中 TLR4 mRNA 和NF-κB mRNA 以及TLR4蛋白表达比较
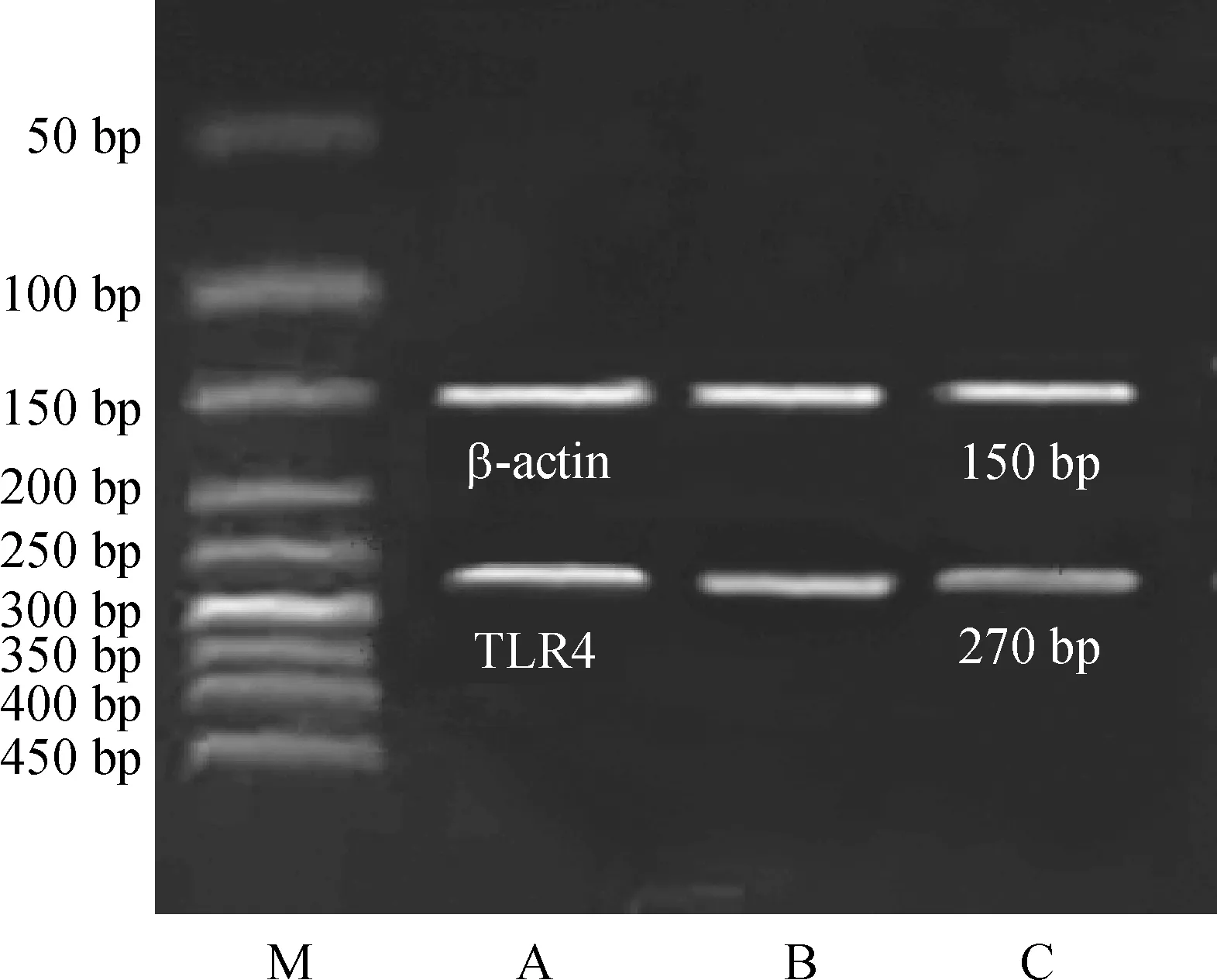
Figure 2.RT-PCR amplification of TLR4 mRNA in airway smooth muscle.M: marker; A: asthmatic 8 weeks group; B:asthmatic 4 weeks group; C: control group.
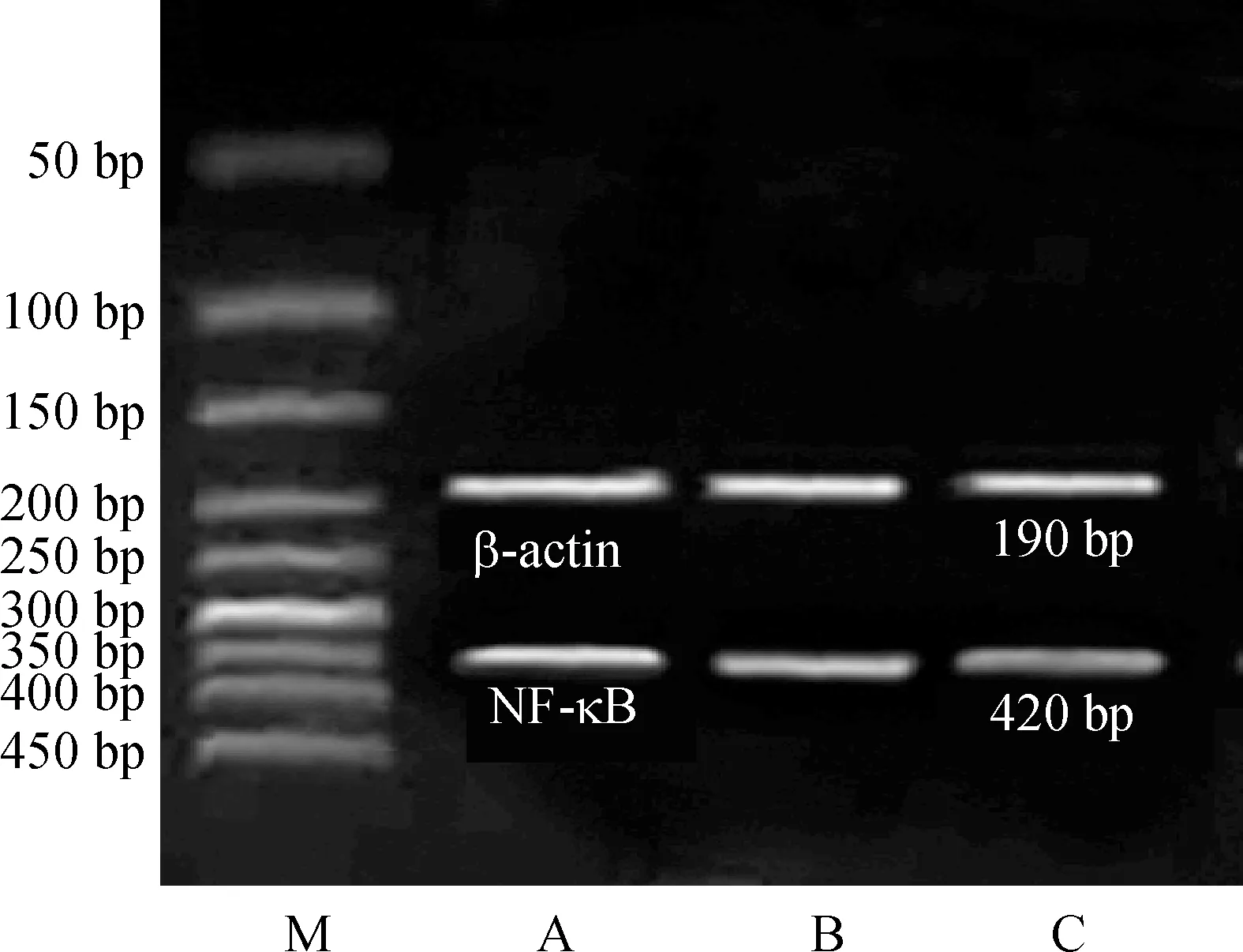
Figure 3.RT-PCR amplification of NF-κB mRNA in airway smooth muscle.M: marker; A:asthmatic 8 weeks group; B: asthmatic 4 weeks group; C: control group.
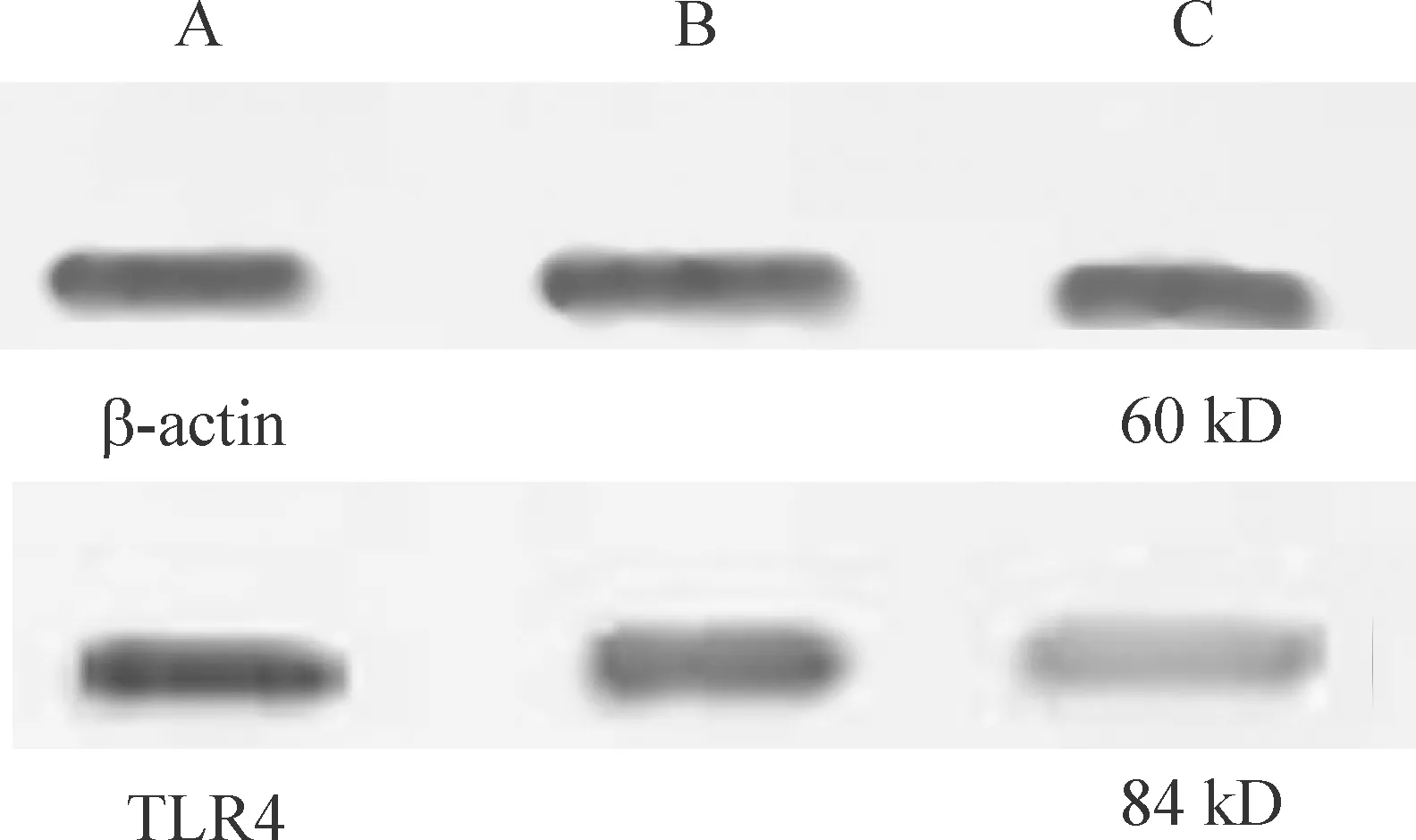
Figure 4.Western blotting amplification of TLR4 protein in airway smooth muscle.A: asthmatic 8 weeks group; B: asthmatic 4 wees group; C: control.
6ASMCsPCNA及Bcl-2免疫组化染色结果
PCNA以细胞核棕黄色染色为阳性,主要在各组大鼠气道上皮细胞和ASMCs表达。对照组气道上皮细胞和ASMCs中PCNA阳性表达数较少,哮喘4周组和哮喘8周组PCNA的蛋白表达量均显著高于正常对照组(Plt;0.01),且哮喘两组间差异显著(Plt;0.05);Bcl-2以细胞核棕黄色染色为阳性,主要在各组大鼠气道上皮细胞和ASMCs表达。哮喘4周组和哮喘8周组Bcl-2的蛋白表达与对照组相比显著增高(Plt;0.01),且哮喘两组间差异显著(Plt;0.05),见表4、图5、6。
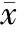
表4 各组大鼠PCNA和Bcl-2蛋白表达量比较

Figure 5.The expression of PCNA protein in airway smooth muscle in the three groups(immunohistochemical staining,×400).A:control group; B: asthmatic 4 weeks group; C: asthmatic 8 weeks group.
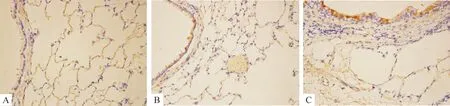
Figure 6.The expression of Bcl-2 protein in airway smooth muscle in the three groups(immunohistochemical staining,×400).A: control group ;B: asthmatic 4 weeks group;C :asthmatic 8 weeks group.
讨 论
哮喘是由多种细胞(如嗜酸粒细胞、肥大细胞、T细胞、中性粒细胞、气道上皮细胞等)和细胞组分参与的气道慢性炎症性疾患[3-5]。哮喘的特征性病理改变表现为气道炎症和气道重构。气道炎症是以嗜酸性粒细胞浸润为主的过敏反应性炎症,其可加重气道高反应性[6]。TLRs是重要的细胞膜受体,HASMCs表达TLR1-TLR10 mRNA。TLR4被激活后可以将胞外信号传入胞内从而激活下游信号分子介导炎症反应[7]。NF-κB位于TLRs下游信号通路的枢纽位置参与细胞的炎症反应。TLRs对哮喘的作用越来越受到重视,成为揭示哮喘发病机制的一个新的可能途径。
通过HE染色结果显示:发现OVA抗原致敏激发能使SD大鼠EOS数量、气道反应性显著高于对照组;且随哮喘天数的增加而明显增加。此外,经标化后的气道壁和平滑肌层厚度的测量数值可以消除不同个体及不同部位来源的支气管比较时所造成的差别,是判断气道重构的客观指标。而我们实验结果显示:哮喘4周组及哮喘8周组支气管壁厚度(WA/Pi)、支气管壁平滑肌厚度(SMA/Pi)、支气管壁平滑肌细胞核数量(N/Pi)均较正常对照组显著增加,且随哮喘天数的增加上述指标亦有增加趋势,提示哮喘SD大鼠模型复制成功,哮喘时气道存在炎症细胞的浸润、ASM组织发生增厚同时伴发气道高反应性。
通过免疫组织化学、RT-PCR、Western bloting分子生物学技术研究同时发现,哮喘4周组及哮喘8周组大鼠ASM中TLR4的阳性表达、TLR4 mRNA和TLR4蛋白的表达水平要显著高于对照组,且随哮喘天数的增加而显著增加。EOS计数、气道反应性改变与相应各组大鼠ASM中TLR4的阳性表达、TLR4 mRNA和TLR4蛋白的表达水平一致,因此我们推测,OVA作为抗原刺激能促进哮喘大鼠ASM中TLR4的表达,参与哮喘的气道炎症,并在其发生发展中起重要作用。而哮喘4周组及哮喘8周组NF-κB mRNA和蛋白的表达水平与对照组比较,显著增高,提示TLR4表达的增加可能诱导NF-κB的活化,说明NF-κB作为TLR4的下游信号分子存在。其机制可能是TLRs结合配体后,通过TIR域(Toll/ IL-1R域)招募MyD 88(Myeloid differentiation factor 88),MyD88再通过氨基端死亡区域的嗜同种反应募集下游IRAK家族成员,进而激活转录因子NF-κB和/或AP-1,引发促炎细胞因子基因的转录和表达,释放细胞因子,产生不同的生物学效应:调节炎性细胞因子分泌、细胞增殖、分化、凋亡等基因的转录[8]。国内学者证实NF-κB参与哮喘大鼠 ASMCs增殖,抑制 NF- κ B 活性能降低哮喘大鼠ASMCs增殖[9]。气道重构是顽固性哮喘的重要病理生理基础[10],而哮喘时ASMCs增殖是气道重构的重要原因,但其发病机制尚未完全明确[11]。哮喘大鼠发生气道重构,与各组大鼠ASM中TLR4、NF-κB的mRNA和TLR4蛋白的表达水平一致,我们推测TLR4/NF-κB可能通过促进ASMCs增生、增厚,参与哮喘气道重构过程。
ASMCs的增殖增加和凋亡抑制是气道壁增厚、气道重构的重要病理基础。PCNA是一种与细胞增殖有关的参与DNA合成的核蛋白,是仅能在增殖细胞中合成和表达的36 kD核内多肽链。PCNA的表达与细胞增殖状态、分化活跃程度有关,是一个被广泛应用于检测细胞增殖功能的敏感指标。Bcl-2是重要的抑制凋亡蛋白。因此,我们选用其PCNA和 Bcl-2作为ASMCs增殖和凋亡的检测指标。实验结果显示:哮喘4周组和哮喘8周组PCNA的蛋白表达量均显著高于对照组,且随哮喘天数的增加而增高,表明哮喘ASM增殖与PCNA的表达水平增加有关。哮喘4周组和哮喘8周组Bcl-2的表达量与对照组相比也显著增高,且随哮喘天数的增加而增高,提示哮喘大鼠ASM存在凋亡不足。这一结果与TLR4和NF-κB在各组ASM中的表达情况相一致,我们推测ASM的PCNA和Bcl-2的蛋白表达量受TLR4和NF-κB的调控。根据以上实验结果我们推测TLR4/NF-κB参与ASMCs的增殖、凋亡,在哮喘的气道重构中起重要作用。
综上所述,我们的研究结果初步显示TLR4/NF-κB可能参与哮喘大鼠气道炎症和气道重构;TLR4/NF-κB可能参与哮喘大鼠ASMCs增殖、凋亡的调控。
[1]Takeda K,Akira S.Toll-like receptors in innate immunity[J].Int Immunol,2005,17(1):1-14.
[2]Schröder NW,Maurer M.The role of innate immunity in asthma leads and lessons from mouse models[J].Allergy,2007,62(6):579-590.
[3]中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗和管理方案)[J].中华哮喘杂志(电子版),2008,2(1): 3-13.
[4]陈 健,戴爱国,胡瑞成,等.支气管哮喘豚鼠BALF炎症细胞中PPARγ、Nrf2和γ-GCS-h表达的变化[J].中国病理生理杂志,2010,26(4):760-765.
[5]伍 蕊,陈亚红,姚婉贞,等.硫化氢供体对急性支气管哮喘大鼠尾加压素Ⅱ表达的影响[J].中国病理生理杂志,2010,26(9):1781-1785.
[6]王吉耀.内科学[M].第1版.北京:人民卫生出版社,2005.49-50.
[7]Sukkar MB,Xie S,Khorasani NM,et al.Toll-like receptor 2,3,and 4 expression and function in human airway smooth muscle[J].J Allergy Clin Immunol,2006,118(3):641-648.
[8]Akira S,Takeda K.Toll-like receptor signalling[J].Nat Rev Immunol,2004,4 (7) : 499 - 511.
[9]许淑云,徐永健,张珍祥,等.核因子κB 在支气管哮喘模型大鼠气道平滑肌细胞增殖中的作用[J].华中科技大学学报(医学版),2006,35(5):566-569.
[10]Krymskaya VP,Goncharova EA,Ammit AJ,et al.Src is necessary and sufficient for human airway smooth muscle cell proliferation and migration[J].FASEB J,2005,19(3) : 428-430.
[11]Ammit AJ,Panettieri RA Jr.Airway smooth muscle cell hyperplasia: a therapeutic target in airway remodeling in asthma?[J].Prog Cell Cycle Res,2003,5: 49 -57.
EffectofTLR4/NF-κBonairwayinflammationandairwayremodelinginratmodelofasthma
WEI Jiang-hong,MO Bi-wen,HUANG Jian-wei
(DepartmentofRespiratoryMedicine,HospitalAffiliatedtoGuilinMedicalCollege,Guilin541001,China.E-mail:Mobiwen2002@sohu.com)
AIM: To explore the effect of TLR4/NF-κB on airway inflammation and airway remodeling in a rat asthma model.METHODSEighteen SD rats were divided into 3 groups (n=6): control group,asthmatic 4 weeks group and asthmatic 8 weeks group.The methods of HE staining,immunohistochemistry and pathology image analysis were used to detect the changes of eosinophile granulocytes (EOS),the thickness of airway wall and the expression of proliferating cell nuclear antigen(PCNA) and Bcl-2 in the airway smooth muscle in asthmatic rats.The expression of TLR4 and NF-κB at mRNA and protein levels in the airway smooth muscle was determined by RT-PCR and Western blotting.RESULTSThe EOS,the thickness of airway wall and airway reactivity in asthmatic group were significantly higher than those in control group.The expression of TLR4 and NF-κB at mRNA and protein levels in asthmatic group was significantly higher than those in control group.The protein levels of PCNA and Bcl-2 were significantly higher than those in control group.Significant difference between two asthmatic groups was observed in the above indexes.CONCLUSIONTLR4 /NF-κB may regulate the airway inflammation and airway remodeling in asthmatic rats.
Toll-like receptor 4; Asthma; Cell proliferation; Apoptosis
1000-4718(2011)05-0962-06
R562.2
A
10.3969/j.issn.1000-4718.2011.05.024
2010-10-14
2011-03-07
国家自然科学基金资助项目(No.30760083);广西科学研究与技术开发计划资助项目(No.桂科攻0719006-2-8);广西卫生厅基金资助项目(No.重200732;No.重200976);桂林市科学研究与技术开发计划资助项目(No.20080320-1);广西青年科学基金资助项目(No.桂科青0991085);桂林医学院2009年硕士研究生科研创新资助项目(No.555);广西医疗卫生自筹基金资助项目(No .Z2008266)
△通讯作者 Tel:0773-2823748;E-mail:Mobiwen2002@sohu.com
