pIRES2-EGFP-BCL11B真核表达载体体外表达的动态分析*
2011-11-20杨力建陈少华郑海涛李扬秋
陈 思, 黄 欣, 杨力建, 陈少华, 郑海涛, 沈 琦, 李 萡, 李扬秋,3△
(暨南大学1医学院血液病研究所,3教育部再生医学重点实验室,广东 广州 510632;2深圳大学医学院免疫学教研室,广东 深圳 518060)
pIRES2-EGFP-BCL11B真核表达载体体外表达的动态分析*
陈 思1,2, 黄 欣1, 杨力建1, 陈少华1, 郑海涛1, 沈 琦1, 李 萡1, 李扬秋1,3△
(暨南大学1医学院血液病研究所,3教育部再生医学重点实验室,广东 广州 510632;2深圳大学医学院免疫学教研室,广东 深圳 518060)
目的: 研究真核表达载体pIRES2-EGFP-BCL11B(B细胞白血病/淋巴瘤11B基因)在K293(人胚肾细胞株)和Raji(人Burkitt 淋巴瘤细胞株)细胞中的表达情况。方法分别利用脂质体和核转染技术将真核表达载体pIRES2-EGFP-BCL11B(pBCL11B)转染至K293和Raji细胞中,并设立空质粒组(pI2)和空转染组(MOCK)作为对照。通过荧光显微镜和流式细胞仪检测转染后48 h各组EGFP的表达,确定转染效率。通过荧光实时定量PCR(Taqman)技术检测转染后24 h各组BCL11B mRNA的表达情况,通过Western blotting技术检测转染后48 h各组BCL11B蛋白的表达情况。高分辨率活细胞成像系统动态观察转染后36-72 h重组质粒在Raji细胞增殖过程中的表达。结果K293细胞pBCL11B、pI2和MOCK组的转染效率分别为(71.23±4.62)%、(70.45±3.58)%和(0.30±0.10)%,而Raji细胞各组的转染效率分别为(23.12±5.94)%、(22.48±6.25)%和(0.30±0.10)%。实时定量PCR和Western blotting结果显示转染后pBCL11B组在mRNA和蛋白水平均能检测到BCL11B基因的有效表达,BCL11B的表达量均明显高于pI2组和MOCK组(Plt;0.05)。活细胞追踪显示转染后36-72 h重组质粒在细胞中可稳定表达且转染后的细胞可以正常分裂增殖。结论系统分析了真核表达载体pIRES2-EGFP-BCL11B转染至K293和Raji细胞的表达变化特点,转染后可以检测到该基因的有效上调,研究结果为下一步转染正常人T细胞奠定了基础。
基因,BCL11B; 真核表达载体; K293细胞; Raji细胞
B细胞淋巴瘤/白血病11B(B-cell lymphoma/leukemia 11B,BCL11B)基因是近年来发现的Bcl家族的新成员,在T细胞发育、分化和增殖中发挥重要的调节作用。动物实验已证实,BCL11B基因是小鼠胸腺细胞发育、分化和存活所必须的基因,BCL11B的缺失会导致胸腺双阳性细胞的阳性选择受阻、T细胞受体(T-cell receptor,TCR)α、β发育受阻及胸腺细胞凋亡增加[1,2]。同时,体外实验证实该基因与维持肿瘤性T细胞株(Juakat和huT-78)的生存密切相关[3]。但是,BCL11B基因对于人类T细胞的作用仍少见报道,其功能、靶基因及作用机制也尚未完全清楚。本研究将成功构建的pIRES2-EGFP-BCL11B真核表达载体分别转染至几乎不表达BCL11B基因的K293和Raji细胞中[BCL11B基因mRNA水平基础表达量分别为(6.7±0.5)/105个β2微球蛋白(β2-microglobulin,β2M)拷贝和(1.8±0.2)/105个β2M拷贝,分析其在真核细胞中表达的动态变化情况,从而为进一步转染该基因至正常人T细胞、明确该基因对正常人T细胞的影响提供基础研究。
材 料 和 方 法
1材料
1.1主要试剂和仪器 核转染仪及试剂盒(Amaxa);Chromo 4实时荧光定量PCR仪(Bio-Rad);流式细胞仪(Beckman-Coulter);Delta Vision 高分辨率显微镜系统(Applied Precision);电热恒温培养箱(上海跃进医疗器械厂);超净工作台(广兴医学生物工程研究所);电泳仪及转印系统(Bio-Rad);Trizol 试剂盒、反转录酶试剂盒和脂质体LipofectamineTM2000(Invitrogen);RPMI-1640 培养液(Gibco);小牛血清(四季青);荧光实时定量 PCR的Ampli Taq Gold 试剂盒(Roche);引物(TIB Molbiol);RIPA蛋白提取试剂盒(申能博彩);小鼠抗人β-actin单抗(博士德);兔抗人BCL11B单抗(Bethyl);兔抗人EGFP单抗、羊抗小鼠IgG和羊抗兔IgG单抗(eBioscience);DAB显影试剂盒(Tiangen);标准品由合作伙伴德国Greifswald大学血液肿瘤专科Schmidt教授惠赠。
1.2K293和Raji细胞 为本所保存。
1.3重组质粒pIRES2-EGFP-BCL11B 为合作伙伴德国Greifswald大学Schmidt教授惠赠。
2方法
2.1实验分组 转染贴壁细胞K293和悬浮细胞Raji均分为3组,分别为转染重组质粒组(pBCL11B)、空质粒组(pI2)和空转染组(MOCK)。
2.2K293和Raji细胞培养 K293细胞用含10% 小牛血清、1×105U/L青-链霉素的IMDM培养基,于37 ℃、5% CO2饱和湿度培养箱内培养,贴壁细胞达80%瓶壁面积时以0.25%胰酶消化、传代。Raji细胞用含10% 小牛血清、1×105U/L青-链霉素的RPMI-1640培养基,于37 ℃、5% CO2饱和湿度培养箱内培养。
2.3重组质粒的酶切鉴定 将重组质粒分别用XhoⅠ和BamHⅠ进行双酶切鉴定,反应体系为为20 μL,包括pIRES2-BCL11B-EGFP重组质粒5 μL、10×buffer Tango 4 μL、XhoⅠ和BamHⅠ内切酶各1 μL、超纯水9 μL,混匀后置于37 ℃作用4 h。酶切产物用1% 的琼脂糖凝胶电泳鉴定。
2.4脂质体介导重组质粒转染K293细胞株 转染前24 h将K293细胞传代、接种于25 cm2的培养瓶中。用无抗生素无血清的IMDM 培养基分别稀释5 μg 的pIRES2-BCL11B- EGFP重组质粒和15 μL脂质体 LipofectamineTM2000至终体积为300 μL,培养6 h后去上清,更换为完全培养基继续培养。
2.5核转染介导重组质粒转染Raji细胞株 收集2.5×106处于对数生长期的Raji细胞,200×g离心10 min,完全去除上清。用100 μL 预热至室温的NucleofectorTMSolution和Supplement混合液悬浮细胞,加入5 μg BCL11B重组质粒,用核转染专用的移液管混匀后加入核转杯,启动核酸转染仪细胞特异性程序(M-013),程序完成后立刻用专用的移液管将转染后的细胞液,接种于RPMI-1640培养基的培养瓶中,培养6-12 h后离心去上清,更换培养基继续培养。
2.6转染效率检测 收集转染后48 h的细胞约1×105,一方面荧光显微镜激发光下观察转染细胞增强型绿色荧光蛋白(enhanced green fluorescent proteins,EGFP)表达情况;另一方面,离心后用0.5 mL 1×PBS洗2次,重悬吹匀后用200 μL 1×PBS重悬细胞,在488 nm的激发光下,用于流式细胞仪分析EGFP表达情况。
2.7实时定量PCR检测BCL11B mRNA的表达 分别收集转染后24 h各组细胞,常规方法提取RNA,合成cDNA。荧光实时定量PCR总反应体积为25 μL,包括dATP、dCTP和dGTP各0.1 mmol/L,dUTP 0.2 mmol/L,0.75 U Ampli Taq Gold 聚合酶,0.25 U 尿嘧啶糖基酶(UNG),1×PCR缓冲液,4.5 mmol/L MgCl2以及0.5 μmol/L上、下游引物,0.1 μmol/L 6FAM-TAMRA探针和2 μL cDNA或标准品。应用于荧光实时定量PCR的引物和探针具体序列见表1。在50℃ 2 min,95℃ 5 min变性后,共进行45循环扩增,每一循环包括95℃ 15 s和64℃ 1 min。根据样本中的β2M拷贝数,计算100 000个β2M拷贝中所含BCL11B拷贝数。计算公式为:n=100 000× BCL11B/β2M。

表1 用于实时定量PCR(TaqMan)的引物和探针序列
2.8Western blotting检测BCL11B蛋白的表达 分别收集转染后48h各组约1.5×106细胞,用RIPA蛋白裂解液试剂盒提取总蛋白。将各组蛋白样品按常规方法定量,并变性后加样于10% 的SDS-PAGE胶中,恒压60 V 30 min后改为80 V 45 min。用半干转仪进行转膜,恒压15 V 15 min。用3% blocking reagent封闭NC膜1 h。根据所需要的蛋白分子量大小(β-actin蛋白42 kD,EGFP蛋白48 kD,BCL11B蛋白120 kD)和预染marker的指示位置,将NC膜剪成小条带,分别放入1∶500的小鼠抗人β-actinⅠ抗、1∶500的兔抗人EGFP单抗、1∶5 000的兔抗人BCL11BⅠ抗,4 ℃过夜。再分别放入1∶300的羊抗小鼠和羊抗兔Ⅱ抗,37 ℃孵育1 h。通过DAB试剂盒检测人内参照基因β-actin蛋白、标记基因EGFP蛋白以及目的蛋白BCL11B的表达情况。扫描图像,最后通过Image Quantition灰度分析软件分析各组条带的灰度值,以各组β-actin的灰度值为内参照,计算各组EGFP和BCL11B蛋白水平的表达情况。
2.9BCL11B基因在Raji细胞的动态检测 在转染后36-72 h利用高分辨率活细胞成像系统动态监测转染重组质粒的Raji细胞中EGFP变化情况。
3统计学处理
结 果
1pIRES2-BCL11B-EGFP重组质粒的PCR扩增和双酶切鉴定
应用XhoⅠ和BamHⅠ双酶切pIRES2-BCL11B-EGFP真核表达质粒,得到大小为2 479 bp和5 255 bp的2条片段,所得片段大小正确。应用BCL11B常规引物PCR扩增BCL11B基因,得到大小为193 bp的片段,所得到的片段大小正确,见图1。
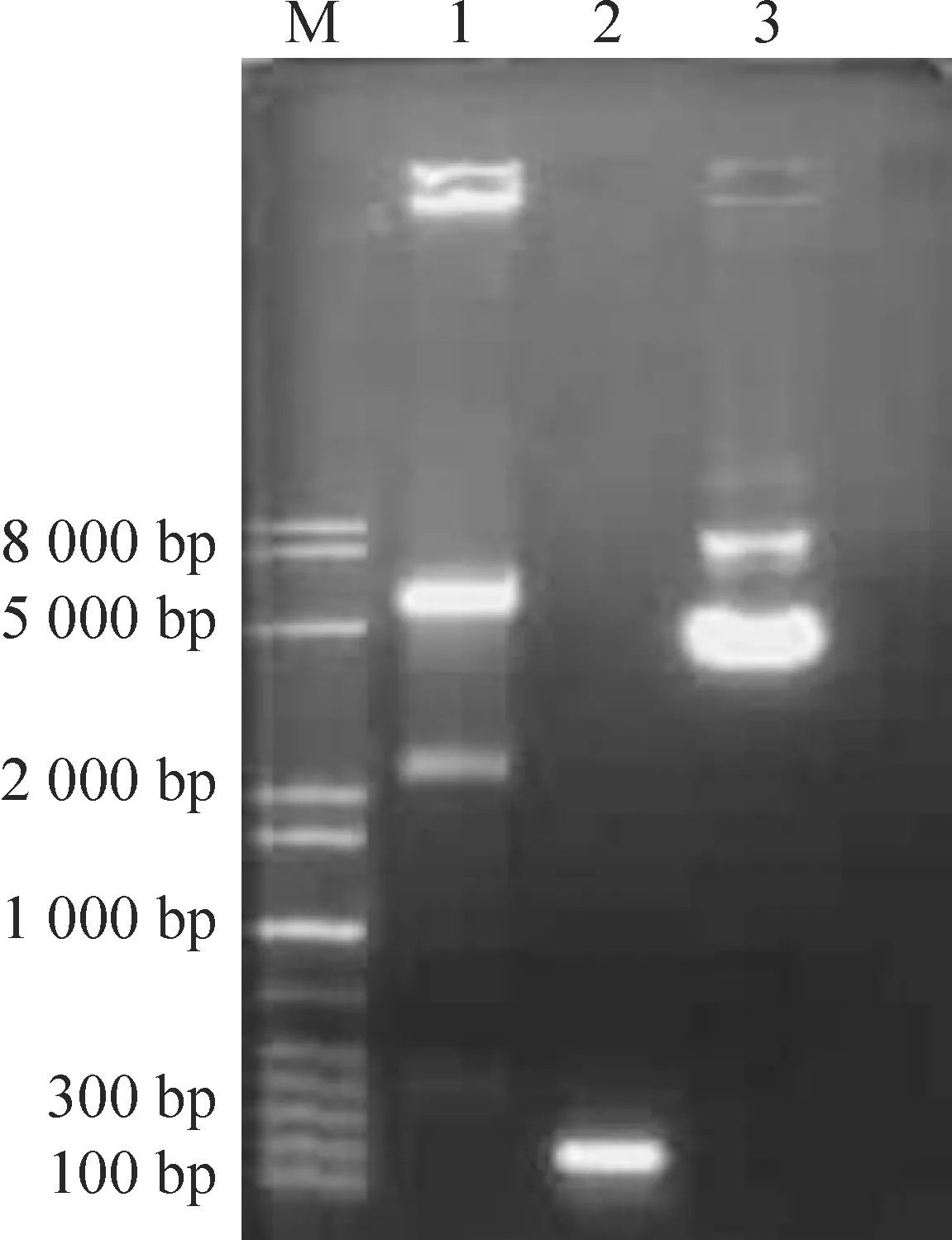
Figure 1.Identification of pIRES2-BCL11B-EGFP recombinant plasmid by electrophoresis analysis.M: 1 kb plus DNA marker; Lane 1: pIRES2-BCL11B-EGFP recombinant plasmid digested by XhoⅠ and BamHⅠ (2 479 bp and 5 255 bp); Lane 2: PCR product of BCL11B (193 bp); Lane 3: pIRES2- BCL11B-EGFP recombinant plasmid.
2重组质粒在K293细胞中的表达
2.1转染效率检测
利用荧光显微镜和流式细胞仪观察经脂质体转染48 h后,K293细胞EGFP表达情况以明确转染效率。结果表明,K293细胞的转染效率较高,其中pBCL11B组的转染效率为(71.23±4.62)%,pI2组的转染效率为(70.45±3.58)%,而MOCK组则几乎不表达EFGP,转染效率为(0.30±0.10)%,见图2。
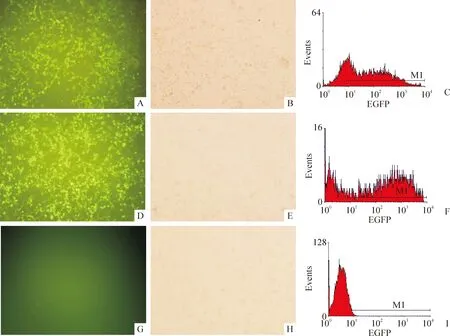
Figure 2.Detection of the transfection efficiency in K293 cells by fluorescence microscopy(×100) and flow cytometry(FCM).A and B: pBCL11B (fluorescence microscopy); C: pBCL11B (FCM); D and E: pI2 (fluorescence microscopy); F: pI2 (FCM); G and H: MOCK (fluorescence microscopy); I: MOCK (FCM).
2.2mRNA和蛋白水平鉴定BCL11B的表达 Real-time PCR和Western blotting检测结果显示,K293细胞中,转染重组质粒后pBCL11B组的BCL11B基因在mRNA和蛋白水平均能有效表达。在mRNA水平,用BCL11B在每105个β2M中的拷贝数代表BCL11B的绝对表达量,结果显示:转染后24 h pBCL11B组BCL11B的拷贝数为(1 237 167±1 32 571.0)/105个β2M拷贝,而pI2组和MOCK组BCL11B的拷贝数远远低于pBCL11B组,在30个拷贝/105个β2M拷贝以下,差异显著(Plt;0.05),见表2。在蛋白水平,经Western blotting、DAB显色及Image Quantition软件灰度分析比对,用EGFP、BCL11B与内参β-actin的灰度比值代表蛋白表达相对量。结果显示:在转染后48 h,pBCL11B组、pI2组和MOCK组的EGFP蛋白的相对表达量分别为(2.01±0.12)、(2.89±0.37)和0,pBCL11B组和pI2组EGFP蛋白的表达无明显差异,而这两组与MOCK组相比,差异均显著(Plt;0.05)。各组的BCL11B蛋白的相对表达量分别为(1.35±0.06)、(0.04±0.01)和(0.11±0.03),pBCL11B组BCL11B蛋白表达量明显高于其它2组(Plt;0.05),见表2、图3。
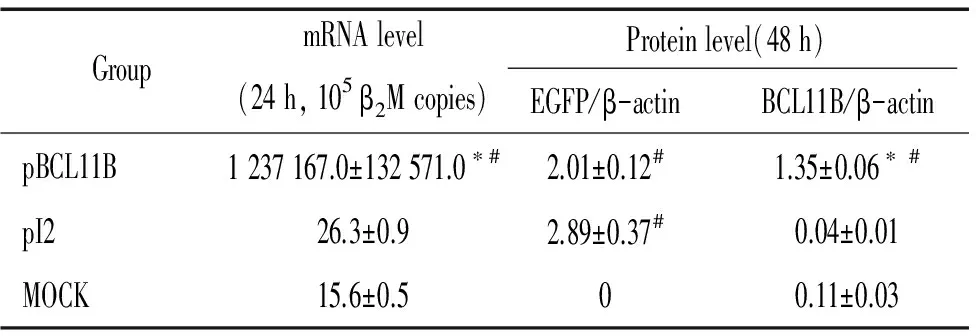
表2 K293细胞中各组BCL11B mRNA和蛋白表达情况
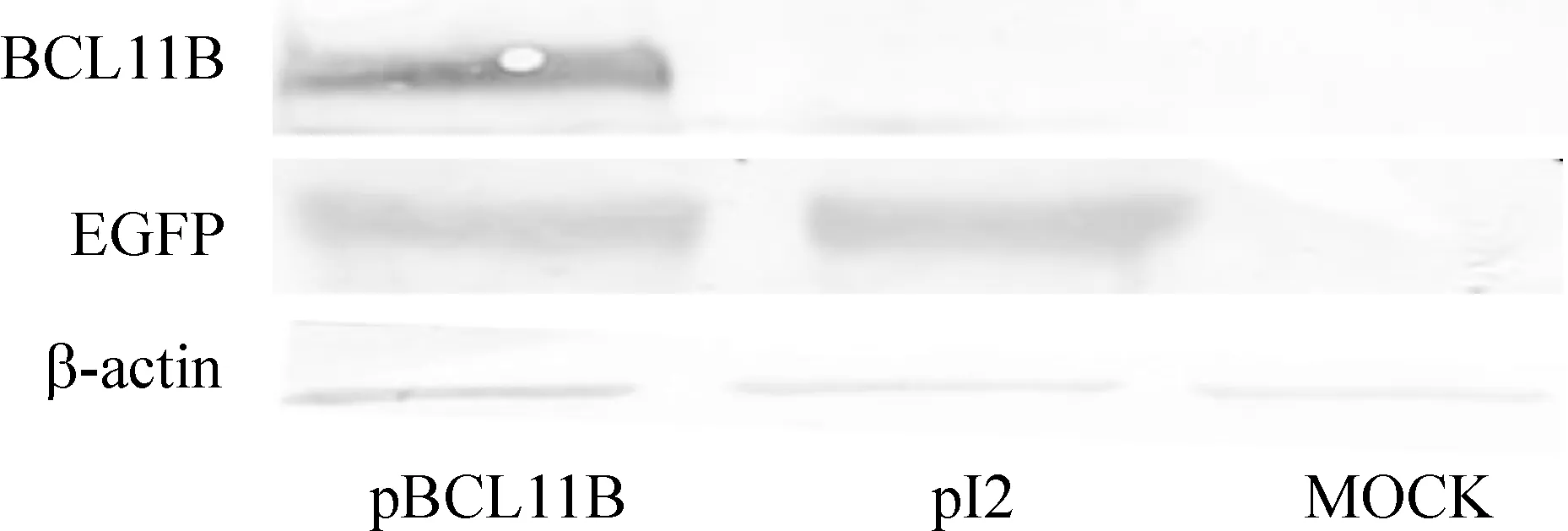
Figure 3.EGFP and BCL11B protein expression in K293 cells detected by Western blotting.
3重组质粒在Raji细胞中的表达
3.1转染效率检测 利用荧光显微镜和流式细胞仪观察经核转染24 h后Raji细胞EGFP的表达情况。结果发现,悬浮细胞Raji的转染效率要远低于贴壁细胞K293,pBCL11B组的转染效率为(23.12±5.94)%,pI2组的转染效率为(22.48±6.25)%,而MOCK组则几乎不表达EFGP,转染效率为(0.30±0.10)%,见图4。
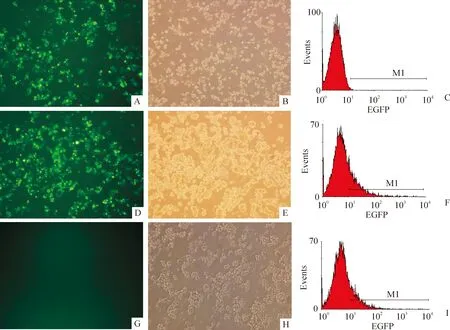
Figure 4.Detection of the transfection efficiency in Raji cells by fluorescence microscopy(×100) and flow cytometry(FCM).A and B: pBCL11B (fluorescence microscopy); C: pBCL11B (FCM); D and E: pI2 (fluorescence microscopy); F: pI2 (FCM); G and H: MOCK (fluorescence microscopy); I: MOCK (FCM).
3.2mRNA和蛋白水平鉴定BCL11B的表达 Real-time PCR和Western blotting检测结果显示,Raji细胞中,转染重组质粒后pBCL11B组的BCL11B基因在mRNA和蛋白水平均能有效表达。在mRNA水平,转染24 h后pBCL11B组BCL11B的拷贝数为(21 244±1 370)/105个β2M拷贝,而pI2组和MOCK组BCL11B的拷贝数远远低于pBCL11B组,在1个拷贝/105β2M拷贝以下,见表3。而在蛋白水平,转染后48 h,pBCL11B组、pI2组和MOCK组的EGFP蛋白的相对表达量分别为(0.40±0.03)、(0.35±0.07)和(0.02±0.01),pBCL11B组和pI2组EGFP蛋白的表达无明显差异,而这两组与MOCK组相比,差异均显著(Plt;0.05)。在转染后48 h,pBCL11B组、pI2组和MOCK组的BCL11B蛋白的相对表达量分别为(0.390±0.050)、(0.007±0.002)和0,差异显著(Plt;0.05),见表3、图5。

表3 Raji细胞中各组BCL11B mRNA和蛋白表达情况
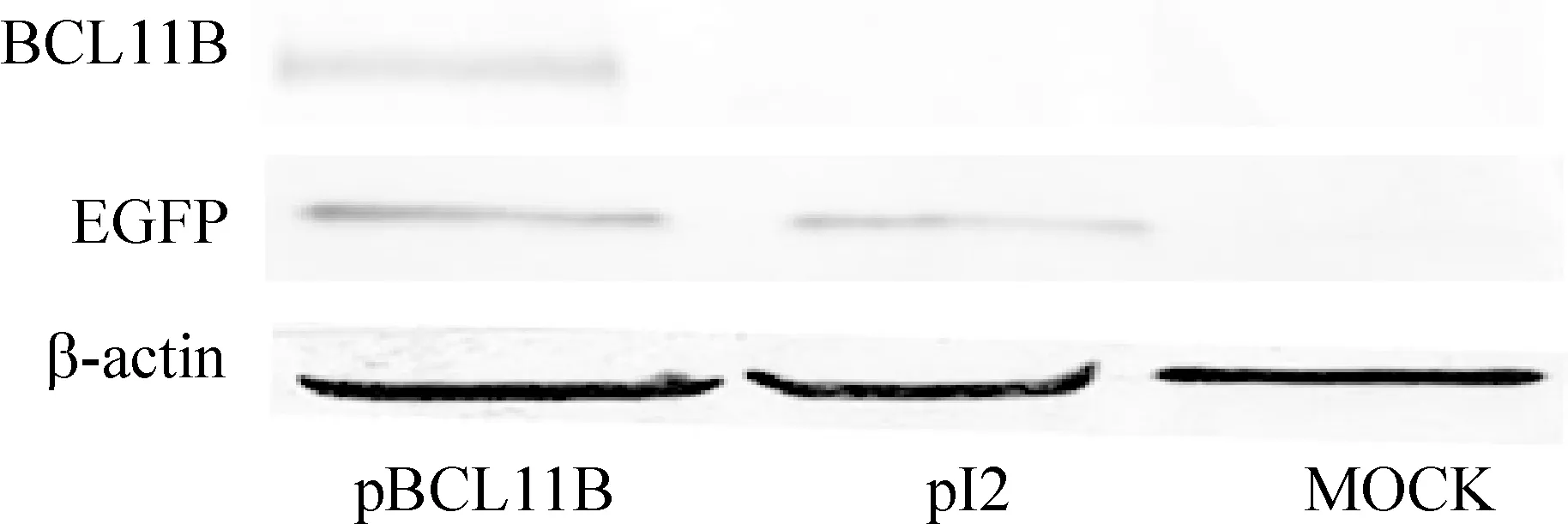
Figure 5.EGFP and BCL11B protein expression in Raji cells detected by Western blotting.
3.3高分辨率活细胞成像系统动态观测转染后36-72 h期间pBCL11B组细胞变化情况 利用高分辨率活细胞成像系统在转染后36-72 h不间断连续观测pBCL11B组Raji细胞中EGFP变化情况。图6显示,转染后36 h某一个已经表达EGFP的Raji母细胞在转染70 h后细胞形态及EGFP表达变化还不是很明显,见图6A、B,细胞处于有丝分裂前期的准备阶段。而在70-72 h间,母细胞发生有丝分裂,并且子细胞也带有EGFP,见图6C、D。说明转染了重组质粒的细胞可以正常增殖,并且,所分裂的子细胞也保留母细胞携带BCL11B重组质粒的性状。
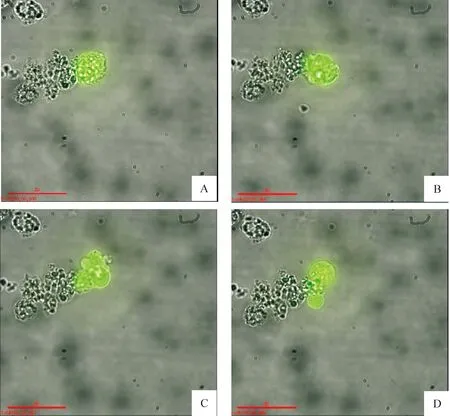
Figure 6.The changes of EGFP expression in Raji cells detected by the high-resolution live cell imaging system(×400).The arrangement of A-D presents the time course..
讨 论
BCL11B基因的首次报道见于2000年[4],10年来科研工作者对该基因的功能进行了研究。现已证实BCL11B基因编码C2H2型锌指蛋白,选择性地结合特异性靶结构,调控基因的表达,但其作为转录因子的功能及作用的靶基因尚未完全明确。BCL11B基因既可以作为转录抑制因子与COUP-TF和NuRD的某些基序结合来抑制基因的表达[4,5],也可以作为转录活化因子激活IL-2的表达[6]。最近的研究表明,BCL11B基因不仅与T细胞的发育、分化和存活密切相关,还是中枢神经系统[7]、皮肤[8]和牙齿[9]等器官发育所必须的基因。尽管动物实验研究取得了一定的进展[1,2],但BCL11B基因对于人类T细胞的作用仍少见报道,只有Grabarczyk等[3]曾利用靶向特异性siRNA下调正常人外周血BCL11B基因的表达,发现BCL11B表达的缺失对正常成熟T细胞无影响。为进一步研究BCL11B基因的功能,我们将构建成功的pIRES2-BCL11B-EGFP真核表达载体转染至几乎不表达BCL11B基因的K293和Raji细胞株中,试图了解重组质粒在真核细胞中的表达情况,从而为下一步上调正常人T细胞的BCL11B基因表达提供实验基础。同时,本课题组也设计、合成了针对BCL11B基因的序列特异性小干扰RNA(siRNA),下调高表达BCL11B基因的肿瘤性T细胞株Molt-4细胞中BCL11B基因的表达,研究对细胞增殖、凋亡产生的影响[10]。siRNA也将用于下调正常人T细胞的BCL11B基因表达,以期全面评价BCL11B基因对人T细胞的影响。
基因转染技术是将目的基因转入某一细胞中,通过观察细胞生物学功能的变化来认识目的基因的功能,是目前应用最多、技术最成熟的基因功能研究方法[11]。目前常用的基因转染系统包括病毒性表达系统和非病毒性表达系统2种。病毒性载体具有转染效率高、目的基因可稳定表达等优势,但存在生物安全性等问题。非病毒性表达载体目前主要采用质粒,通过脂质体介导和电穿孔等方法使目的基因被宿主细胞摄取。脂质体转染方法的主要问题是,不同细胞类型对外源DNA的摄取能力有所不同,对于悬浮细胞和原代细胞转染效果较差。本研究中我们首先利用脂质体转染方法转染贴壁细胞K293,效果理想,转染效率在70%以上。同时,我们尝试用脂质体方式转染悬浮细胞Raji,转染效率不超过5%。随后,我们选择了核转染的方法对Raji细胞进行转染。核转染技术是将传统的电穿孔方法和具有细胞特异性的转染缓冲液结合起来,针对不同的细胞类型,采用不同的经过优化的配套转染试剂和转染程序,在达到最理想的转染效率的同时保持细胞的活力。其最大优点是可以直接将外源核酸同时输送细胞核内,特别适用于转染原代细胞和难于转染的悬浮细胞系,且减少了使用病毒载体带来的生物安全性问题。这项技术的高转染效率和低毒性使转基因的细胞表现出较强的活力以及外源基因在细胞内稳定表达。本研究利用核转染的方法使较难转染的悬浮细胞Raji得到了较高的转染效率,证实了核转染的有效性,为今后通过此方法转染人原代T细胞提供了实验基础。
本研究共设立了2个对照组,分别是空质粒对照pI2和转染条件对照MOCK,以判断质粒本身和转染条件对细胞的影响。转染后对目的基因表达的检测时间一般在24到48 h,最佳时间取决于被表达的基因本身、可用的检测灵敏度以及在载体中调控表达的元件等,通常在24 h对mRNA水平进行检测、48 h对蛋白水平进行检测。本研究的结果显示2种细胞均能在转染后的24 h和48 h分别检测到BCL11B基因在mRNA和蛋白水平的表达,从而证明了重组质粒可以在真核细胞中有效表达。此外,本研究还首次利用了高分辨率活细胞成像系统动态监测了转染36-72 h期间Raji细胞中pBCL11B组EGFP变化情况。结果显示在某一个已经表达EGFP的Raji细胞在发生有丝分裂时,其子细胞也带有EGFP,这说明转染了重组质粒的细胞可以正常增殖,且所分裂的子细胞保留了母细胞的性状。
总之,本研究分别通过脂质体和核转染的方法比较系统地分析了pIRES2- BCL11B-EGFP重组质粒在不同细胞株转染的效率、基因和蛋白表达水平,以及随着细胞增殖BCL11B基因的表达变化等,为分析基因转导提供一些可行技术方法,更为进一步上调正常人T细胞及研究BCL11B的功能提供基础资料。
[1]Wakabayashi Y,Watanabe H,Inoue J,et al.Bcl11b is required for differentiation and survival of αβ T lymphocytes[J].Nat Immunol,2003,4(6):533-539.
[2]Albu DI,Feng D,Bhattacharya D,et al.BCL11B is required for positive selection and survival of double-positive thymocytes[J].J Exp Med,2007,204(12):3003-3015.
[3]Grabarczyk P,Przybylski GK,Depke M,et al.Inhibition of BCL11B expression leads to apoptosis of malignant but not normal mature T cells[J].Oncogene,2007,26(26):3797 -3810.
[4]Avram D,Fields A,Pretty On Top K,et al.Isolation of a novel family of C2H2zinc finger proteins implicated in transcriptional repression mediated by chicken ovalbumin upstream promoter transcription factor (COUP-TF) orphan nuclear receptors[J].J Biol Chem,2000,275(14):10315-10322.
[5]Cismasiu VB,Adamo K,Gecewicz J,et al.BCL11B functionally associates with the NuRD complex in T lymphocytes to repress targeted promoter[J].Oncogene,2005,24(45): 6753- 6764.
[6]Cismasiu VB,Ghanta S,Duque J,et al.BCL11B participates in the activation ofIL2 gene expression in CD4+T lymphocytes[J].Blood,2006,108(8):2695-2702.
[7]Desplats PA,Lambert JR,Thomas EA.Functional roles for the striatal-enriched transcription factor,Bcl11b,in the control of striatal gene expression and transcriptional dysregulation in Huntington’s disease[J].Neurobiol Dis,2008,31(3):298-308.
[8]Golonzhka O,Liang X,Messaddeq N,et al.Dual role of COUP-TF-interacting protein 2(CTIP2) in epidermal homeostasis and permeability barrier formation[J].J Invest Dermatol,2009,129(6): 1459-1470.
[9]Golonzhka O,Metzger D,Bornert JM,et al.Ctip2/Bcl11b controls ameloblast formation during mammalian odontogenesis[J].Proc Natl Acad Sci USA,2009,106(11): 4278-4283.
[10]黄 欣,陈 思,李扬秋,等.RNA干扰下调bcl11b基因表达对Molt-4细胞增殖和凋亡的影响[J].肿瘤防治研究,2010,37(3): 247-250.
[11]蒋春华,罗勇军,黄庆愿,等.缺氧诱导因子-1α基因转染对缺氧损伤HepG2细胞的保护作用[J].中国病理生理杂志,2010,26(1):1-6.
DynamicanalysisofinvitroexpressionofB-celllymphoma/leukemia11BgenebyeukaryoticexpressiveplasmidpIRES2-EGFP-BCL11B
CHEN Si1,2,HUANG Xin1,YANG Li-jian1,CHEN Shao-hua1,ZHENG Hai-tao1,SHEN Qi1,LI Bo1,LI Yang-qiu1,3
(1InstituteofHematology,SchoolofMedicine,3KeyLaboratoryforRegenerativeMedicineofMinistryofEducation,JinanUniversity,Guangzhou510632,China;2DepartmentofImmunology,ShenzhenUniversity,Shenzhen518060,China.E-mail:jnyangqiuli@163.com)
AIM: To analyze the ability of eukaryotic expressive plasmid pIRES2-EGFP-BCL11B to express B-cell lymphoma/leukemia 11B(BCL11B) gene in K293 and Raji cells.METHODSThe eukaryotic expressive plasmid pIRES2-BCL11B-EGFP (pBCL11B) was transfected into K293 cells and Raji cells by the techniques of Lipofectamine and Nucleofector transfection,respectively.Empty plasmid (pI2) and mock-transfection (MOCK) were used as controls.The transfection efficiency was examined by the methods of fluorescence microscopy and flow cytometry 48 h after transfection.The mRNA expression of BCL11B was analyzed at 24 h by real-time quantitative PCR with Taqman technique.The protein levels of BCL11B were determined at 48 h by Western blotting.The expression of recombinant plasmid during proliferation of Raji cells transfected with pIRES2-EGFP-BCL11B were observed by the high-resolution live cell imaging system from 36 h to 72 h.RESULTSThe transfection efficiency in pBCL11B,pI2 and MOCK groups in K293 cells was (71.23±4.62)%,(70.45±3.58)% and (0.30±0.10)%,respectively.Simultaneously,that in Raji cells was(23.12±5.94)%,(22.48±6.25)% and (0.30±0.10)%,respectively.Compared with pI2 and MOCK controls,the mRNA and the corresponding proteins of theBCL11Bgene were effectively in up-regulated pBCL11B group (Plt;0.05).The results of high-resolution live cell imaging system showed that the recombinant plasmid stably expressed EGFP protein from 36 h to 72 h after transfection,and the transfected cells proliferated normally.CONCLUSIONBCL11B gene is effectively up-regulated in K293 and Raji cells after transfected with pIRES2-BCL11B-EGFP eukaryotic expressive plasmid,indicating a useful way for subsequent step in human T-cells transfection.
Genes,BCL11B; Eukaryotic expression vector; K293 cells; Raji cells
1000-4718(2011)05-0944-07
R733.73
A
10.3969/j.issn.1000-4718.2011.05.021
2010-08-31
2011-03-17
国家自然科学基金资助项目(No.30771980);广东省科技计划资助项目(No.2007B030703008;No.2009B050700029)
△通讯作者 Tel: 020-85226877; E-mail: jnyangqiuli@163.com
