α7烟碱样乙酰胆碱受体拮抗剂减轻淀粉样β蛋白诱导的PC12细胞损伤的机制研究*
2011-11-20汪志刚戚仁斌朱丽红沈文娟赵彦儒陆大祥
汪志刚, 戚仁斌, 李 卫, 朱丽红, 沈文娟, 张 晶, 赵彦儒, 陆大祥△
(暨南大学1附属第一医院危重病医学科,3附属第一医院神经外科,2医学院病理生理学系,广东 广州 510632)
α7烟碱样乙酰胆碱受体拮抗剂减轻淀粉样β蛋白诱导的PC12细胞损伤的机制研究*
汪志刚1,2, 戚仁斌2, 李 卫3, 朱丽红2, 沈文娟2, 张 晶2, 赵彦儒2, 陆大祥2△
(暨南大学1附属第一医院危重病医学科,3附属第一医院神经外科,2医学院病理生理学系,广东 广州 510632)
目的: 探讨长时间应用α7烟碱样乙酰胆碱受体(α7 nAchR)拮抗剂对淀粉样β蛋白(Aβ)处理的PC12细胞的影响及其作用机制。方法采用高分化的PC12细胞作为研究对象,用Aβ25-35复制细胞损伤模型;以α7 nAchR拮抗剂(甲基牛扁亭碱,methyllycaconitine)和nAchR激动剂(尼古丁,nicotine)预处理PC12细胞。实验分4组:空白对照组、Aβ25-35组、尼古丁+ Aβ25-35组和甲基牛扁亭碱+ Aβ25-35组。用JC-1荧光分子探针通过线粒体膜电位检测PC12细胞的凋亡,用Western blotting检测α7 nAChR和凋亡调节蛋白(Bcl-2/Bax)的表达。结果在药物作用36 h后,与空白对照组比较,Aβ25-35组的凋亡率增高,Bcl-2/Bax和Bax的表达无明显差异,α7 nAChR表达增加;与Aβ25-35组比较,尼古丁+ Aβ25-35组细胞凋亡率降低,但是Bcl-2/Bax表达也无明显差异,而α7 nAChR和Bax表达均降低;与Aβ25-35组比较,甲基牛扁亭碱+ Aβ25-35组凋亡率虽然无明显差异,但是Bcl-2/Bax表达显著升高,同时α7 nAChR和Bax表达均明显降低;与尼古丁+ Aβ25-35组比较,此时甲基牛扁亭碱+ Aβ25-35组的凋亡率较高,Bcl-2/Bax显著升高,α7 nAChR和Bax表达均显著降低;除空白对照组外,α7 nAChR和Bax表达呈明显正相关。在药物作用84 h后,与空白对照组比较,Aβ25-35组的凋亡率仍然是增高的,Bcl-2/Bax表达仍然无明显差异,α7 nAChR表达降低,Bax表达明显增高;与Aβ25-35组比较,尼古丁+ Aβ25-35组细胞凋亡率和Bcl-2/Bax表达无明显差异,α7 nAChR和Bax表达仍然较低;与Aβ25-35组比较,甲基牛扁亭碱+ Aβ25-35组凋亡率有所降低,而且Bcl-2/Bax表达仍然显著升高,α7 nAChR和Bax表达仍然明显降低;与尼古丁+ Aβ25-35组比较,甲基牛扁亭碱+ Aβ25-35组的凋亡率较低,Bcl-2/Bax仍然显著升高,α7nAChR和Bax表达仍然显著降低;除空白对照组外,α7 nAChR和Bax表达呈明显正相关。结论随着作用时间的延长,尼古丁的保护作用逐渐消失,而甲基牛扁亭碱的保护作用逐渐显现。甲基牛扁亭碱可能是通过下调α7 nAChR并阻断Aβ25-35的损伤作用,显著持续升高Bcl-2/Bax,从而可能产生抑制细胞凋亡的作用。所以,nAcR激动剂也许并不适合长时间治疗阿尔茨海默病,而拮抗剂可能会为治疗提供一个新的方向。
淀粉样β蛋白; PC12细胞; 烟碱拮抗剂; 烟碱激动剂; 细胞凋亡; 线粒体膜电位
α7型烟碱样乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7 nAchR)在海马表达较为丰富[1,2],与认知和记忆密切相关。阿尔茨海默病(Alzheimer disease,AD)突出的临床症状是认知和记忆障碍,其重要病理特征是突触前神经元的丢失及其烟碱受体的减少,其中淀粉样β蛋白(Aβ)在疾病过程中具有关键作用。
目前的研究多倾向于认为nAchR激动剂对神经细胞具有保护作用[3,4],而拮抗剂不但无保护作用,而且能够阻断激动剂的保护作用[3,5]。但是,现实情况是,包括治疗AD最常用的药物胆碱酯酶抑制剂(增加激动剂乙酰胆碱),nAchR激动剂长期应用后其效果逐渐丧失[6-10]。而学界对nAchR拮抗剂的长期应用缺乏关注。同样作为受体,在治疗慢性心功能不全时,β受体激动剂短期应用具有改善症状,长期应用症状恶化,甚至增加死亡率;而β受体阻滞剂,短期内应用可能会加重症状,但是长期应用不但可以改善症状,而且降低死亡率。
在AD中,凋亡是神经元丢失的重要原因,Aβ蛋白可以引起神经细胞内钙离子失衡[11],而钙离子超载与线粒体途径凋亡有密切关系。线粒体凋亡途径涉及到Bcl-2和Bax的表达,Bcl-2/Bax[12,13]是决定细胞存活或者凋亡的重要指标。
因此,本研究提出nAchR拮抗剂长时间应用可能具有神经细胞保护作用的工作假说,并从α7 nAChR和凋亡调节蛋白的改变探讨其可能机制。
材 料 和 方 法
1细胞培养
采用高分化的PC12细胞,购自中国科学院上海生科院细胞资源中心。培养液为含10%胎牛血清的RPMI-1640,其中加入青霉素和链霉素(浓度均为1×105U/L)。于37 ℃、5%CO2条件下培养,选取对数生长期细胞进行实验。
2主要试剂和仪器
主要试剂:Aβ25-35和甲基牛扁亭碱(methyllycaconitine)购自Sigma,尼古丁(nicotine)购自日本和光纯药株式会社;培养基RPMI-1640购自ScienCell,胎牛血清购自Hyclone;线粒体膜电位检测试剂盒(JC-1) 购自上海碧云天生物技术有限公司;Bax和Bcl-2抗体购自Cell Signaling Technology,α7 nAChR抗体购自Santa Cruz,Ⅱ抗兔抗鼠IgG和羊抗兔IgG 购自Southern Biotech,内参照抗体为HRP标记的GAPDH,购自上海康成生物公司。主要仪器:IX51荧光显微镜(Olympus),Western blotting蛋白印迹电泳仪和Western blotting蛋白印迹电转仪(Bio-Rad)。
3方法
3.1药物和试剂制备 Aβ25-35母液浓度为1 000 μmol/L,使用前置于37 ℃培养箱孵育3-7d老化,作用浓度为10 μmol/L。尼古丁母液浓度2 000 μmol/L,作用浓度100 μmol/L;甲基牛扁亭碱母液浓度200 μmol/L,作用浓度10 μmol/L;二者加入到培养液中的体积相等。
3.2实验分组和药物处理 实验分4组:空白对照组、Aβ25-35组、尼古丁+Aβ25-35组和甲基牛扁亭碱+Aβ25-35组。用24孔培养板接种PC12细胞,36 h实验细胞密度为2×104cells/well,84 h实验细胞密度为1×103cells/well。接种24 h后各组用蒸馏水或相应药物预处理,12 h后全部换液加入Aβ25-35和相应药物。分别于第1次加药后36 h和84 h进行相关检测。每24或36 h半量换液并补充Aβ25-35、蒸馏水或相应药物。
3.3JC-1荧光探针检测线粒体膜电位 (1)将JC-1原液稀释200倍,混匀后为JC-1 染色工作液。(2)将细胞进行相应处理后,加入1 mL JC-1 染色工作液,充分混匀,置于细胞培养箱中37 ℃孵育20 min。(3)37 ℃孵育结束后,用JC-1 染色缓冲液洗涤2 次,加入2 mL细胞培养液,荧光显微镜下观察。检测JC-1 单体时把激发光设置为490 nm,发射光设置为530 nm;检测JC-1 聚合物时,把激发光设置为525 nm,发射光设置为590 nm。出现绿色荧光说明线粒体膜电位下降,并且该细胞很可能处于细胞凋亡早期;出现黄色荧光说明线粒体膜电位比较正常,细胞的状态也比较正常。(4)计算凋亡率:各实验组随机逐一选取5 个视野,拍照保存,计算每个视野照片的凋亡细胞所占细胞总数的比率,乘以100%,即为凋亡率。
3.4Western blotting检测Bcl-2/Bax和nAchR的表达 收集PC12细胞,抽提总蛋白,BCA 法测量蛋白浓度,上样,SDS-PAGE电泳,转膜,封闭,抗体孵育(Bax、Bcl-2和α7 nAChRⅠ抗稀释比例分别是1∶200、1∶200和1∶800),采用化学发光法显色,用专用软件对蛋白条带灰度值进行分析。
4统计学处理
结 果
1通过线粒体膜电位检测药物作用36和84h后对PC12细胞凋亡的影响
图1、2和表1结果显示:药物作用细胞36和84 h后,Aβ25-35组的凋亡率明显高于空白对照组(Plt;0.01),说明Aβ25-35损伤PC12细胞的模型是成功的。
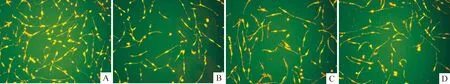
Figure 1.Apoptosis of PC12 cells treated with methyllycaconitine or nicotine and Aβ25-35 for 36 h detected by fluor molecular probe JC-1 through mitochondrial membrane potential assay (the PC12 cells with yellow color are normal,and with green color are in pristine apoptosis,× 200 ) .A: blank control group;B: Aβ25-35 group ; C: Nicotine+ Aβ25-35 group; D: methyllycaconitine + Aβ25-35 group.
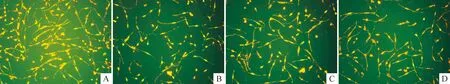
Figure 2.Apoptosis of PC12 cells treated with methyllycaconitine or nicotine and Aβ25-35 for 84 h detected by fluor molecular probe JC-1 through mitochondrial membrane potential assay (the PC12 cells with yellow color are normal,and with green color are in pristine apoptosis,× 200).A: blank control group; B: Aβ25-35 group ; C: nicotine+ Aβ25-35 group; D: methyllycaconitine + Aβ25-35 group.
表1 甲基牛扁亭碱或尼古丁+ Aβ25-35作用36和84 h后各组PC12细胞凋亡的比较
在36 h,尼古丁+ Aβ25-35组的凋亡率低于Aβ25-35组(Plt;0.01),说明尼古丁在短期内应用可抑制Aβ蛋白引起的细胞凋亡,具有细胞保护作用;甲基牛扁亭碱+Aβ25-35组和Aβ25-35组的差异无统计学意义,说明甲基牛扁亭碱短期内应用未表现出细胞保护作用;尼古丁+ Aβ25-35组的凋亡率低于甲基牛扁亭碱+Aβ25-35组(Plt;0.05),说明在短期内尼古丁对细胞的保护作用是优于甲基牛扁亭碱的。在84 h,尼古丁+ Aβ25-35组的凋亡率与Aβ25-35组的差异无统计学意义,说明随着药物作用时间的延长,尼古丁对细胞的保护作用已经丧失;甲基牛扁亭碱+Aβ25-35组的凋亡率虽然低于Aβ25-35,但是差异无统计学意义;但是,此时甲基牛扁亭碱+Aβ25-35组的凋亡率明显低于尼古丁+ Aβ25-35组(Plt;0.01),说明此时甲基牛扁亭碱对细胞的保护作用可能优于尼古丁。
2药物作用36和84h对PC12细胞Bcl-2和Bax表达的影响
2.1甲基牛扁亭碱或尼古丁+Aβ25-35作用36 h后,对PC12细胞Bcl-2和Bax表达的影响 在36 h,Aβ25-35组Bcl-2/Bax的表达与空白对照组的差异并无统计学意义,其原因还不明确。尼古丁+ Aβ25-35组Bcl-2/Bax的表达与Aβ25-35组的差异也无统计学意义,说明尼古丁此阶段在基因表达水平对PC12细胞的凋亡无抑制作用。甲基牛扁亭碱+Aβ25-35组Bcl-2/Bax的表达明显高于各组,说明甲基牛扁亭碱已经在基因表达水平具有抑制细胞凋亡的作用,见图3。
2.2甲基牛扁亭碱或尼古丁+ Aβ25-35作用84 h后,对PC12细胞Bcl-2和Bax表达的影响 在84 h,情况仍然与36 h类似,见图4。尼古丁在基因表达水平对PC12细胞的凋亡仍然无抑制作用,而甲基牛扁亭碱持续在基因表达水平具有抑制凋亡的作用。
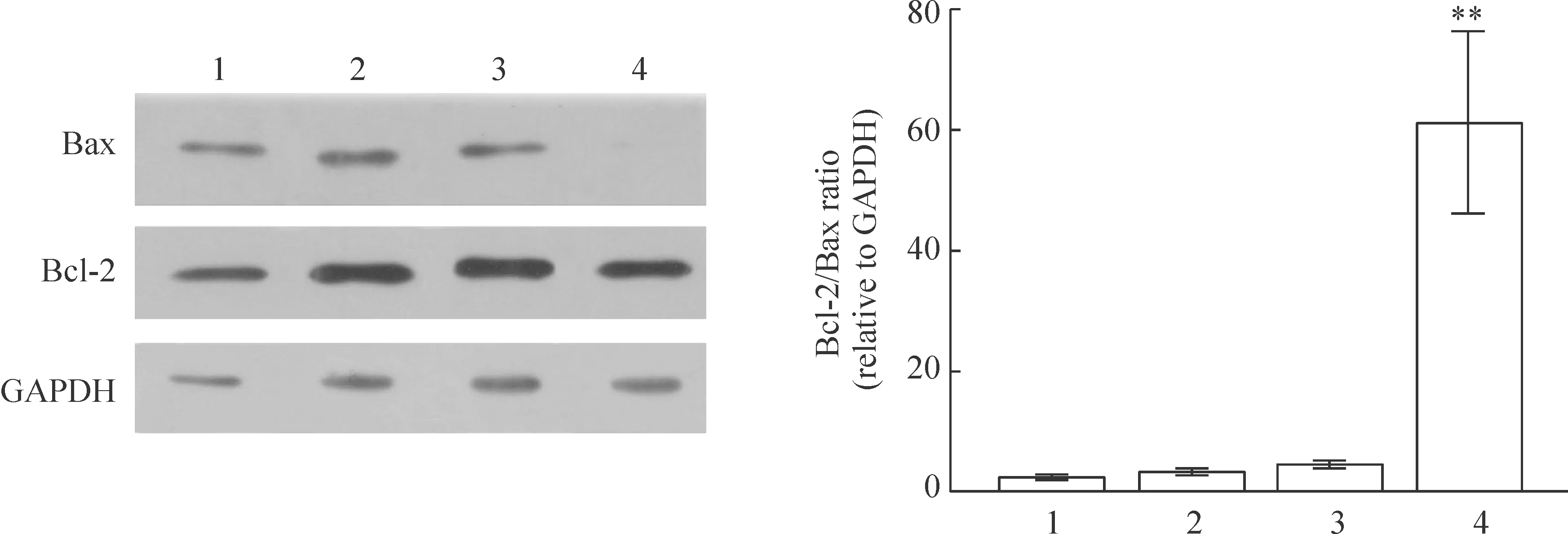
Figure 3.Bcl-2/Bax ratio in PC12 cells treated with methyllycaconitine or nicotine and Aβ25-35 for 36 h.±s.n=3.**Plt;0.01 vs other groups.1:blank control group; 2:Aβ25-35 group; 3:nicotine+ Aβ25-35 group; 4:Methyllycaconitine +Aβ25-35 group.
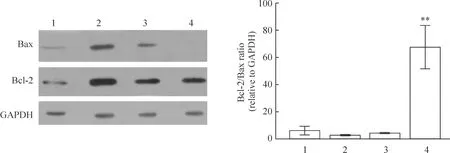
Figure 4.Bcl-2/Bax ratio in PC12 cells treated with methyllycaconitine or nicotine and Aβ25-35 for 84 h .±s.n=3.**Plt;0.01 vs other groups.1:blank control group; 2:Aβ25-35 group; 3:nicotine+ Aβ25-35 group; 4:mMethyllycaconitine +Aβ25-35 group.
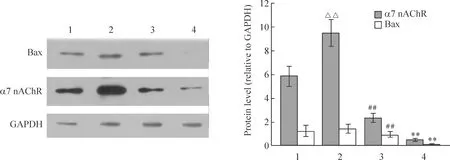
Figure 5.The protein expression of α7 nAChR and Bax in PC12 cells treated with methyllycaconitine or nicotine and Aβ25-35 for 36 h±s.n=3.**Plt;0.01 vs other groups; ##Plt;0.01 vs Aβ25-35 group; △△ Plt;0.01 vs blank control group.1:blank control group; 2:Aβ25-35 group; 3:nicotine+ Aβ25-35 group; 4:Methyllycaconitine +Aβ25-35 group.
3α7nAChR蛋白表达及其与Bax的关系
3.136 h α7烟碱受体表达及其与Bax的相关性分析 在36 h,Aβ25-35组的α7 nAChR蛋白表达高于空白对照组(Plt;0.01),说明Aβ促进了PC12细胞α7 nAChR的表达;而Bax与空白对照组差异无统计学意义,原因尚不明确。尼古丁+ Aβ25-35组的α7 nAChR和Bax蛋白表达均低于Aβ25-35组(Plt;0.01),说明尼古丁引起α7 nAChR和Bax的下调。甲基牛扁亭碱+Aβ25-35组的α7 nAChR和Bax蛋白表达均低于其它各组(Plt;0.01),说明甲基牛扁亭碱引起α7 nAChR和Bax的下调较尼古丁更加明显,见图5。
同时,除空白对照组外,各组的Bax与α7 nAChR的表达具有一致性,故对其进行相关性分析。在Aβ25-35存在的条件下,药物作用36 h后,Aβ25-35组、尼古丁+ Aβ25-35组和甲基牛扁亭碱+Aβ25-35组的Bax和α7 nAChR呈显著正相关(r=0.862,Plt;0.01)。

Figure 6.The protein expression of α7 nAChR and Bax in PC12 cells treated with methyllycaconitine or nicotine and Aβ25-35 for 84 h±s.n=3.**Plt;0.01 vs other groups; ##Plt;0.01 vs Aβ25-35 group;△△ Plt;0.01 vs blank control group.1:blank control group; 2:Aβ25-35 group; 3:nicotine+ Aβ25-35 group; 4:methyllycaconitine +Aβ25-35 group.
3.284 h α7烟碱受体表达及其与Bax的相关性分析 在84 h,Aβ25-35组的α7 nAChR蛋白表达低于空白对照组(Plt;0.01),说明Aβ最终导致了α7 nAChR的损伤和减少;而Bax明显高于空白对照组,说明Aβ25-35在基因表达水平诱导凋亡的发生。尼古丁+ Aβ25-35组的α7 nAChR和Bax蛋白表达均低于Aβ25-35组(Plt;0.01),说明尼古丁在此阶段仍然可以引起α7 nAChR和Bax的下调。甲基牛扁亭碱+Aβ25-35组的α7 nAChR和Bax蛋白表达仍然均低于其它各组(Plt;0.01),说明甲基牛扁亭碱引起α7 nAChR和Bax的下调,并且最为显著,见图6。
同样,除空白对照组外,各组的Bax与α7 nAChR的表达具有一致性,对其进行相关性分析。在Aβ25-35存在的条件下,药物作用84 h后,Aβ25-35组、尼古丁+ Aβ25-35组和甲基牛扁亭碱+Aβ25-35组的Bax和α7 nAChR显著正相关(r=0.980,Plt;0.01)。
结合相关和回归分析,发现在Aβ25-35存在的基础上,α7 nAchR和Bax密切相关,提示α7 nAchR可能介导了Aβ25-35对PC12细胞的损伤作用。
讨 论
Aβ蛋白可以诱导神经细胞凋亡,在AD的发生发展中起到重要作用[14]。实验发现Aβ25-35持续作用引起PC12细胞的凋亡,为实验成功复制了Aβ蛋白的损伤模型。相对于对照组,Aβ25-35组Bcl-2/Bax的表达与其无明显差异,机制尚不明确。可能的原因是,对照组无损伤因素,故其Bcl-2和Bax均在低水平表达,而Aβ蛋白损伤引起Bax增高的同时,也引起Bcl-2反应性升高[15]。也有可能是检测时点的问题,如在Aβ25-35刺激后12 h左右Bcl-2/Bax是否会有所下降,尚需进一步验证。Aβ25-35组的α7 nAChR在早期表达明显高于空白对照组组,有研究发现Aβ蛋白具有上调烟碱受体的作用[16];但是在较长时间后,其α7 nAChR表达又明显低于对照组,这可能是Aβ蛋白最终导致烟碱受体的损伤和减少有关,这与AD的发病机制是一致的。
在实验早期(36 h),尼古丁具有抑制细胞凋亡的作用[5],体现了细胞保护作用。有人认为尼古丁通过激活蛋白质酪氨酸激酶(Janus kinase 2,JAK2)通路抑制神经细胞的凋亡[17]。甲基牛扁亭碱早期未表现出抑制细胞凋亡的作用,传统观点认为其无细胞保护作用,甚至阻断激动剂的保护作用[5]。随着尼古丁作用时间的延长(84 h),尼古丁的保护作用逐渐丧失。有人发现,较长时间的尼古丁作用可以引起神经元的凋亡[6],但是也有相反的观点[4,18]。在本研究中,随着时间的延长,甲基牛扁亭碱的保护作用逐渐显现,其凋亡率明显低于尼古丁组。有人认为Aβ蛋白早期(6-9 d)仅仅影响神经元突起的生长,用α7受体激动剂和拮抗剂预处理大鼠神经元,发现均可以抑制Aβ的毒性作用[19]。还有人发现,α4β2烟碱受体拮抗剂刺桐定和α7烟碱受体拮抗剂甲基牛扁亭碱作用大鼠神经元2 d,均具有保护作用[20]。但是关于拮抗剂的研究较少,其保护作用并不是非常明确。
诱导凋亡是通过改变凋亡调节蛋白起作用的。本实验结果显示,无论在短时间或者长时间内,尼古丁均未升高Bcl-2/Bax的表达;虽然其在早期具有抑制凋亡和神经保护作用,但是其内在的改变,即Bcl-2/Bax的表达已经不具有抑制凋亡的趋势,而其早期抑制凋亡的作用是否是通过其它凋亡调节通路尚不清楚。而甲基牛扁亭碱的Bcl-2/Bax表达一直保持在高水平,其重要原因是Bax表达一直维持很低的水平;虽然其早期并未表现出细胞保护作用,但是其内在的改变,即Bcl-2/Bax的表达已经具有抑制凋亡的趋势,为其最终产生细胞保护作用提供了潜在条件。
尼古丁+ Aβ25-35组和甲基牛扁亭碱+Aβ25-35组的α7 nAChR和Bax均明显低于Aβ25-35组,而以后者更为明显。尽管有研究认为激动剂具有上调烟碱受体的作用[21],而对于拮抗剂多认为无上调受体的作用[22],但是对不同受体其作用并不一致,如有研究发现激动剂和拮抗剂都可以上调α4β2 nAChR及其mRNA的表达,但是对α7 nAChR及其mRNA无影响[23]。在受体下调的同时,尼古丁+ Aβ25-35组和甲基牛扁亭碱+Aβ25-35组的Bax表达也明显比Aβ25-35组低,提示二者均有减轻Aβ损伤作用,但是甲基牛扁亭碱的作用更为突出。
Bax是促进细胞凋亡的凋亡调节蛋白,其表达与损伤性因素是一致的;在本实验中损伤因素是Aβ25-35,故二者应该存在因果关系。Aβ蛋白与α7 nAChR具有高度亲和力[24],但Aβ蛋白是否通过α7 nAChR损伤神经细胞还不清楚。实验发现,除外空白对照组(无Aβ蛋白的损伤作用),Aβ25-35组、尼古丁+ Aβ25-35组和甲基牛扁亭碱+Aβ25-35组的Bax和α7 nAChR表达均依次降低, Bax和α7 nAChR表达呈现高度正相关,提示Aβ蛋白可能是通过α7 nAChR介导对PC12细胞的损伤。甲基牛扁亭碱可能通过下调α7 nAChR的表达,并阻断Aβ25-35与受体结合,从2个方面减轻Aβ蛋白的损伤作用。而尼古丁也下调α7 nAChR,故这也可能是其抑制Aβ损伤作用的一个原因。
综上所述,Aβ蛋白通过与α7 nAChR结合,促进钙离子内流,引起PC12细胞Bax表达增高,导致Bcl-2/Bax失衡,从而诱导细胞的凋亡;甲基牛扁亭碱通过下调α7 nAChR和阻断Aβ蛋白与受体结合,阻止了Bax的上升,使Bcl-2/Bax明显升高,为最终抑制细胞的凋亡提供了可能性;尼古丁也通过下调α7nAChR减少了Bax的上升,但是远不如甲基牛扁亭碱明显,故其未明显升高Bcl-2/Bax,可能是其对凋亡抑制作用逐渐丧失的原因。
因此,长期使用烟碱受体激动剂其细胞保护作用可能逐渐消失,而长期应用α7烟碱受体拮抗剂可能具有抑制神经细胞凋亡和细胞保护作用,可能为AD的治疗研究提供新的思路。
[1]Jensen AA,Frølund B,Liljefors T,et al.Neuronal nicotinic acetylcholine receptors: structural revelations,target identifications,and therapeutic inspirations[J].J Med Chem,2005,48(15): 4705-4745.
[2]Mihailescu S,Drucker-Colin R.Nicotine,brain nicotinic receptors,and neuropsychiatric disorders[J].Arch Med Res,2000,31(2): 131-144.
[3]Ohnishi M,Katsuki H,Takagi M,et al.Long-term treatment with nicotine suppresses neurotoxicity of,and microglial activation by,thrombin in corticostriatal slice cultures[J].Eur J Pharmacol,2009,602(2-3): 288-293.
[4]Marighetto A,Valerio S,Desmedt A,et al.Comparative effects of the α7 nicotinic partial agonist,S 24795,and the cholinesterase inhibitor,donepezil,against aging-related deficits in declarative and working memory in mice[J].Psychopharmacology (Berl),2008,197(3): 499-508.
[5]Parada E,Egea J,Romero A,et al.Poststress treatment with PNU282987 can rescue SH-SY5Y cells undergoing apoptosis via α7 nicotinic receptors linked to a Jak2/Akt/HO-1 signaling pathway[J].Free Radic Biol Med,2010,49(11): 1815-1821.
[6]Oliveira-da-Silva A,Manhães AC,Cristina-Rodrigues F,et al.Hippocampal increased cell death and decreased cell density elicited by nicotine and/or ethanol during adolescence are reversed during drug withdrawal[J].Neuroscience,2010,167(1): 163-173.
[7]Machaalani R,Waters KA,Tinworth KD.Effects of postnatal nicotine exposure on apoptotic markers in the developing piglet brain[J].Neuroscience,2005,132(2): 325-333.
[8]Petersen RC,Thomas RG,Grundman M,et al.Vitamin E and donepezil for the treatment of mild cognitive impairment[J].N Engl J Med,2005,352(23): 2379-2388.
[9]Rogers SL,Farlow MR,Doody RS,et al.A 24-week,double-blind,placebo-controlled trial of donepezil in patients with Alzheimer’s disease.Donepezil Study Group[J].Neurol,1998,50(1): 136-145.
[10]Rogers SL,Doody RS,Mohs RC,et al.Donepezil improves cognition and global function in Alzheimer disease: a 15-week,double-blind,placebo-controlled study.Donepezil Study Group[J].Arch Intern Med,1998,158(9): 1021-1031.
[11]Chin JH,Tse FW,Harris K,et al.β-Amyloid enhances intracellular calcium rises mediated by repeated activation of intracellular calcium stores and nicotinic receptors in acutely dissociated rat basal forebrain neurons[J].Brain Cell Biol,2007,35(2-3): 173-186.
[12]Ramin M,Azizi P,Motamedi F,et al.Inhibition of JNK phosphorylation reverses memory deficit induced by β-amyloid (1-42) associated with decrease of apoptotic factors[J].Behav Brain Res,2011,217(2): 424-431.
[13]Reed JC.Proapoptotic multidomain Bcl-2/Bax-family proteins: mechanisms,physiological roles,and therapeutic opportunities[J].Cell Death Differ,2006,13(8): 1378-1386.
[14]王 锋,韩 柏,郭建红,等.脑内Aβ沉积与AD模型大鼠学习记忆能力关系的研究[J].中国病理生理杂志.2010,26(3):584-586.
[15]Karlnoski R,Wilcock D,Dickey C,et al.Up-regulation of Bcl-2 in APP transgenic mice is associated with neuroprotection[J].Neurobiol Dis,2007,25(1): 179-188.
[16]Dineley KT,Westerman M,Bui D,et al.Beta-amyloid activates the mitogen-activated protein kinase cascade via hippocampal alpha 7 nicotinic acetylcholine receptors:invitroandinvivomechanisms related to Alzheimer’s disease[J].J Neurosci,2001,21(12): 4125-4133.
[17]Shaw S,Bencherif M,Marrero MB.Janus kinase 2,an early target of α7 nicotinic acetylcholine receptor-mediated neuroprotection against Aβ1-42amyloid[J].J Biolo Chem,2002,277(47): 44920-44924.
[18]Shim SB,Lee SH,Chae KR,et al.Nicotine ieads to improvements in behavioral impairment and an Increase in the nicotine acetylcholine receptor in transgenic mice[J].Neurochem Res,2008,33(9): 1783-1788.
[19]Hu M,Schurdak M,Puttfarcken P,et al.High content screen microscopy analysis of Aβ1-42-induced neurite outgrowth reduction in rat primary cortical neurons: Neuroprotective effects of α7 neuronal nicotinic acetylcholine receptor ligands[J].Brain Res,2007,1151: 227-235.
[20]Martin S,Defiebre N,Defiebre C.The α7 nicotinic acetylcholine receptor-selective antagonist,methyllycaconitine,partially protects against β-amyloid toxicity in primary neuron-enriched cultures[J].Brain Res,2004,1022(1-2): 254-256.
[21]Xiao Y,Kellar KJ.The comparative pharmacology and up-regulation of rat neuronal nicotinic receptor subtype binding sites stably expressed in transfected mammalian cells[J].J Pharmacol Exp Ther,2004,310(1): 98-107.
[22]Whiteaker P,Sharples CG,Wonnacott S.Agonist-induced up-regulation of α4β2 nicotinic acetylcholine receptors in M10 cells: pharmacological and spatial definition[J].Mol Pharmacol,1998,53(5): 950-962.
[23]Mehrani H,Golmanesh L.Changes in mRNA and protein levels of nicotinic acetylcholine receptors in Diazoxon exposed pC12 cells[J].Toxicol in Vitro,2008,22(5): 1257-1263.
[24]Wang HY,Lee DH,Davis CB,et al.Amyloid Peptide Aβ1-42binds selectively and with picomolar affinity to α7 nicotinic acetylcholine receptors[J].J Neurochem,2000,75(3): 1155-1161.
Antagonistofα7nAChRrelievesinjuryofPC12cellsinducedbyamyloidβ-protein
WANG Zhi-gang1,2,QI Ren-bin2,LI Wei3,ZHU Li-hong2,SHEN Wen-juan2,ZHANG Jing2,ZHAO Yan-ru2,LU Da-xiang2
(1DepartmentofCriticalCareMedicine,3DepartmentofNeurosurgery,TheFirstAffiliatedHospital,2DepartmentofPathophysiology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:ldx@jnu.edu.cn)
AIM: To investigate the effect of long-term exposure to α7 nicotinic acetylcholine receptor(α7 nAChR) antagonist on PC12 cell injury induced by amyloid β-protein(Aβ).METHODSThe well-differentiated PC12 cells were used in the study.The injury model of PC12 cells was established by treating the cells with Aβ25-35.The interventions of nicotine and methyllycaconitine were carried out.The cells were divided into blank control group,Aβ25-35group,nicotine+Aβ25-35group and methyllycaconitine +Aβ25-35group.The apoptosis of PC12 cells was detected by fluor molecular probe JC-1 through mitochondrial membrane potential assay,and the levels of Bcl-2/Bax and α7 nAChR were detected by Western blotting.RESULTSAfter treated with the related reagents for 36 h,the apoptotic rate of PC12 cells and the expression of α7 nAChR in Aβ25-35group were higher than those in blank control group.No difference of Bcl-2/Bax and Bax between the two groups was observed.Compared with Aβ25-35group,the apoptotic rate and expression of α7 nAChR and Bax in nicotine+Aβ25-35group were decreased,and no difference of Bcl-2/Bax between the two groups was detected.Compared with Aβ25-35group,the apoptotic rate in methyllycaconitine+Aβ25-35group was unchanged; however,Bcl-2/Bax was obviously increased,and the expression of α7 nAChR and Bax was decreased.The apoptotic rate of PC12 cells in methyllycaconitine+Aβ25-35group was higher than that in nicotine+Aβ25-35group.The levels of Bcl-2/Bax,α7 nAChR and Bax in methyllycaconitine +Aβ25-35group were lower than those in nicotine+Aβ25-35group.Except blank control group,there was positive correlation between α7 nAChR and Bax.After treated with the related reagents for 84 h,the apoptotic rate and the expression of Bax in Aβ25-35group were higher,and the expression of α7 nAChR was lower in Aβ25-35group than those in blank control group.Compared with Aβ25-35group,the apoptotic rate and Bcl-2/Bax in nicotine+Aβ25-35group was unchanged,and the expression of α7 nAChR and Bax was decreased.The apoptotic rate in methyllycaconitine+Aβ25-35group was unchanged;however,Bcl-2/Bax was increased persistently,and α7 nAChR and Bax remained decreasing.Compared with nicotine+Aβ25-35group,the apoptotic rate,α7 nAChR and Bax in methyllycaconitine+Aβ25-35group were decreased,and there was also an obvious decrease in Bcl-2/Bax.CONCLUSIONThe protective effect of nicotine disappears with the time of exposure.However,methyllycaconitine shows a tendency of the protective effect.Methyllycaconitine probably suppresses apoptosis of PC12 cells by increasing Bcl-2/Bax through down-regulation of α7 nAChR and blocking the injury induced by Aβ25-35.Consequently,nicotinic agonist may not be suitable for the chronic treatment of Alzheimer disease,and nicotinic antagonist may provide a new direction.
Amyloid beta-protein; PC12 cells; Nicotinic antagonist; Nicotinic agonist; Apoptosis; Mitochondrial membrane potential
1000-4718(2011)05-0916-07
R34
A
10.3969/j.issn.1000-4718.2011.05.016
2011-04-01
2011-05-03
广东省自然科学基金资助项目(No.845106320100363);暨南大学科研培育与创新基金前瞻性与基础研究资助项目(中央高校基本科研业务费专项资金资助,No.21609425)
△通讯作者 Tel:020-85220004;E-mail: ldx@jnu.edu.cn
