黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元Bcl-2和Bax表达的影响*
2011-11-20焦俊霞高维娟李玉明周晓春朱炎杰董雅洁
焦俊霞, 高维娟, 李玉明, 钱 涛, 周晓春, 朱炎杰, 董雅洁
(1承德医学院病理生理学教研室,河北 承德 067000;2河北省化工医药职业技术学院,3河北省人民医院,河北 石家庄 050026)
黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元Bcl-2和Bax表达的影响*
焦俊霞1, 高维娟2△, 李玉明1, 钱 涛3, 周晓春1, 朱炎杰1, 董雅洁1
(1承德医学院病理生理学教研室,河北 承德 067000;2河北省化工医药职业技术学院,3河北省人民医院,河北 石家庄 050026)
目的: 观察黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元凋亡相关蛋白Bcl-2、Bax及其mRNA表达的影响。方法取原代培养8 d的大鼠海马神经元,随机分为4组:正常对照组、模型组(缺氧缺糖/复氧复糖组)、溶剂对照组(缺氧缺糖/复氧复糖+黄芪注射液溶剂处理组)和黄芪注射液处理组(缺氧缺糖/复氧复糖+黄芪注射液处理组)。除正常对照组外,各组均进行缺糖缺氧0.5 h,再分别于复氧复糖后0 h、0.5 h、2 h、6 h、24 h、72 h和120 h采用Western blotting法检测海马神经元Bcl-2和Bax蛋白的表达,RT-PCR法检测海马神经元bcl-2和bax mRNA的表达。结果Western blotting结果显示:与正常对照组比,模型组Bcl-2和Bax蛋白表达明显升高,而Bcl-2/Bax比值下调(Plt;0.05);与模型组比,黄芪注射液处理组Bcl-2蛋白表达升高,Bax蛋白表达明显降低,Bcl-2/Bax比值升高(Plt;0.05),而溶剂对照组Bcl-2、Bax蛋白表达及Bcl-2/Bax比值则无显著变化(Pgt;0.05)。bcl-2 mRNA、bax mRNA表达趋势同蛋白。结论黄芪注射液可提高缺氧缺糖/复氧复糖大鼠海马神经元Bcl-2表达及Bcl-2/Bax比值,抑制Bax表达,从而抑制缺氧缺糖/复氧复糖引起的海马神经元凋亡。
缺氧缺糖/复氧; 黄芪注射液; Bcl-2; Bax; 海马神经元; 细胞凋亡。
缺血性脑血管病是目前神经内科最常见的一种疾病,严重威胁人类生命健康,致残率非常高,病理机制也十分复杂,因此对其病理过程中基因表达变化和药物干预作用的研究倍受人们关注。对这种疾病的治疗一般是以疏通堵塞的血管改善病变部位的血液供应为主,而当缺血部位的血液供应好转以后就容易发生更加严重的再灌注损伤,其中细胞凋亡发挥着重要的作用。黄芪注射液为临床治疗缺血性脑血管病的常用药物,可抑制细胞凋亡的发生[1]。本研究通过观察黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-assaciated X protein,Bax)表达的影响,探讨黄芪注射液抑制神经细胞凋亡的分子机制。
材 料 和 方 法
1材料
1.1动物 1-2 d SPF级SD大鼠,雌雄兼有,由天津山川红实验动物科技有限公司提供,许可证号为SCXK(津)2009-001。
1.2试剂和仪器 兔抗大鼠神经元特异性烯醇化酶(neuron-specific enolase,NSE)多克隆抗体购于武汉博士德公司;兔抗大鼠Bcl-2多克隆抗体购于Chemicon;小鼠抗大鼠Bax单克隆抗体购于Santa Cruz;BCA蛋白定量试剂盒购于上海申能博彩生物公司;bax和bcl-2引物是由上海生物工程有限公司设计;RT-PCR试剂盒购自大连宝生物公司;多聚赖氨酸和阿糖胞苷购自Sigma;胎牛血清和马血清由Hyclone生产;谷氨酰胺和胰蛋白酶购自华美生物工程公司;DMEM/F12培养基和B27由Gibco生产;SP免疫组化染色试剂盒购自北京中杉金桥公司;黄芪注射液由成都地奥九泓制药厂生产;其它试剂为国产分析纯。主要仪器: HERA cell 150型CO2培养箱由Heraeus生产;Leica DMIL 090-135.001型倒置显微镜由Wetzlar GmbH生产;TDL-40B离心机由上海安亭科学仪器制造厂生产;DYY-6B 型稳压稳流电泳仪购自北京六一仪器厂;MK3型酶标仪购自上海雷勃公司。
2方法
2.1海马神经元的培养 取新生24 h的乳鼠放进冰浴的75%乙醇内浸泡1 min消毒并窒息,用眼科显微镊夹取海马组织,在解剖显微镜下去除含有血管的软脑膜(以上操作均在冰上进行),沉淀后吸去上层D-Hanks液,放入0.125%胰蛋白酶消化10-15 min,同时用眼科剪剪切海马组织至1 mm×1 mm×1 mm大小,用马血清(0.125%胰蛋白酶量的10%)终止消化,把组织块混合液移入离心管,1 000 r/min离心5 min×3次,去上清后加DMEM/F12溶液5 mL,吹打离散组织,制成细胞悬液,200目滤网过滤。取10 μL细胞悬液加在计数板上,倒置显微镜下计算活细胞数,以5×108cells/L密度接种在培养瓶,提取蛋白用于Western blotting; 以5×108cells/L密度接种在直径为35mm的培养皿中,提取总mRNA,用于RT-PCR。种植液成分为80%DMEM/F12、10%胎牛血清、10%马血清、1%谷氨酰胺、青霉素和链霉素各1%。将培养皿放入37 ℃、5%CO2培养箱中培养,第2 d用无血清培养液代替种植液,培养液成分为95%DMEM/F12、2%B27、1%谷氨酰胺、青霉素和链霉素各1%。第4 d把一半培养液换成新鲜无血清培养液,并按全液量添加0.5%阿糖胞苷以抑制胶质细胞生长,24 h后替换成新鲜无血清培养液。培养8 d后建立海马神经元缺氧缺糖/复氧复糖细胞模型,并检测指标。
2.2海马神经元纯度鉴定 细胞免疫化学检测海马神经元纯度:采用SP法检测NSE表达,具体操作均按试剂盒说明书进行。兔抗大鼠NSE多克隆抗体按1∶50稀释;PBS代替Ⅰ抗作阴性对照。阳性细胞胞浆和突起呈棕黄色,胞核有少许黄色颗粒。阳性细胞计数方法:高倍镜下计数5个非连续视野阳性细胞数之和,每组重复5次。采用MiVnt图像分析系统在10×20倍显微镜下对免疫组化阳性结果进行定量分析。
2.3缺氧缺糖/复氧复糖细胞模型的建立与实验分组 把原代培养8 d 的大鼠海马神经元随机分为4 组:正常对照组、模型组、黄芪注射液处理组和溶剂对照组。除正常对照组外均参照Bossenmeyer等[2]的方法建立缺氧缺糖/复氧复糖细胞模型:用无糖Earle’s液代替培养液,随即把培养皿(瓶)置于37 ℃、CO2温箱中的缺氧装置里,快速通入高纯氮气5 min,再使气体匀速缓慢连续排出。缺氧缺糖30 min后,换正常无血清培养液继续在37 ℃、5% CO2培养箱内培养。黄芪注射液处理组于缺氧缺糖时加入黄芪注射液[0.5 g(生药)·L-1][3],直至培养结束;溶剂对照组处理方法与黄芪注射液处理组相同,只是将黄芪注射液换为pH值7.4 的等量无菌去离子水;模型组在缺氧缺糖时加入与正常培养液等量的Earle′s液,缺氧缺糖后正常培养。各组在复氧复糖后0、0.5、2、6、24、72 和120 h观察Bcl-2、Bax蛋白及其mRNA的表达。
2.4蛋白免疫印迹法检测细胞内Bcl-2和Bax蛋白的表达 收集细胞,提取胞质蛋白,用BCA法进行蛋白定量。取70 μg样品,加入蛋白体积1/4的loading buffer混匀,在100 ℃沸水中煮10 min,以12%SDS聚丙烯酰胺凝胶电泳分离,分离的蛋白用半干电转移法转移到PVDF膜上,0.5%奶粉封闭过夜后加入用封闭液稀释的兔抗Bcl-2多克隆抗体(1∶1 500稀释)和小鼠抗Bax单克隆抗体(1∶300稀释),4 ℃过夜。用生物素标记的Ⅱ抗(1∶5 000稀释) 孵育1 h,洗膜液洗后用化学发光法显色,X射线底片曝光。以β-actin为内参照,实验重复5次。用Quantity One软件对各时点蛋白条带平均吸光度值进行分析。
2.5RT-PCR法检测细胞内bcl-2和bax mRNA的表达 收集细胞,用Trizol一步法提取RNA,按TaKaRa RNA PCR kit(AMV) 说明逆转录为cDNA。内参照β-actin上游引物5’-CAT CCTGCGTCTGGACCT-3’,下游引物5’-TCAGGAGGAGCA ATGATCTTG-3’,扩增片段长度为480 bp。按照PCR amplification kit 说明进行反应,扩增条件:94 ℃预变性2 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 4 min,循环35次,目的条带在480 bp。bcl-2上游引物5’-TGGGATGCCTTTGTGGAACTAT-3’,下游引物5’-GCTGATTTGACCATTTGCCTGA-3’,扩增片段长度为328 bp;按照PCR amplification kit 说明进行反应,扩增条件:95 ℃预变性2 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 4 min,72 ℃延伸3 min,循环35次,目的条带在328 bp。bax cDNA上游引物5’-GAGCGAGTGTCTCCGGCGAATT-3’,下游引物5’-GCCACAAAGATGGTCACTGTCTGC-3’,按照PCR amplification kit 说明进行反应,扩增条件:94 ℃预变性2 min,94 ℃ 30 s,59 ℃ 30 s,72 ℃ 4min,循环35次;最后于72 ℃延伸3 min,目的条带在357 bp。用2% 琼脂糖凝胶电泳鉴定PCR产物,实验重复5次。用凝胶分析软件Quantity One进行定量分析,并计算目的基因/β-actin吸光度(A)的比值。
3统计学处理
结 果
1海马神经元原代培养纯度鉴定
细胞免疫化学染色结果显示:无血清培养8 d的海马神经元胞体饱满,突起明显,突起末端分支形成神经网络,相互支持生长,神经胶质细胞少见,5个400倍视野中阳性神经细胞的数目为775个,纯度为(92.35±0.72)%,见图1。

Figure 1.The expression of NSE protein in cultured rat hippocampal neurons.A:negative;B:NSE.
2黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元Bcl-2和Bax蛋白表达的影响
Western bloting实验结果显示: 与正常对照组比,模型组120 h Bcl-2和Bax蛋白表达无明显差别,余各时点Bcl-2蛋白表达明显升高(Plt;0.05),复氧复糖0.5 h开始升高、2 h达高峰、之后逐渐下降,仍高于正常组。与模型组比,黄芪注射液处理组除外120 h,余各时点Bcl-2蛋白表达均明显增高(Plt;0.05)。与正常对照组比,模型组120 h Bax蛋白表达无明显差别,余各时点Bax蛋白表达明显升高(Plt;0.05),复氧复糖0.5 h开始升高、6 h达高峰、之后逐渐下降,仍高于正常(Plt;0.05)。与模型组比,黄芪注射液处理组120 h Bax蛋白表达无明显差别,而余各时点Bax蛋白表达均明显降低(Plt;0.05)。溶剂对照组Bcl-2和Bax蛋白变化趋势与模型组变化相一致(Pgt;0.05)。与正常对照组比,模型组Bcl-2/Bax比值明显下调(Plt;0.05);与模型组比,黄芪注射液处理组Bcl-2/Bax比值明显升高(Plt;0.05),而溶剂对照组无明显差别,见图2-4。
3黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元bcl-2和baxmRNA表达的影响
RT-PCR结果显示,bcl-2和bax mRNA表达趋势同蛋白表达趋势相一致,见图6-8。

Figure 2.The effect of Astragalus injection on expression of Bcl-2 and Bax protein after hypoxia /hypoglycemia and reoxygenation in hippocampal neurons of rats.A:normal control group;B:model group;C:vehicle control group; D:Astragalus injection treatment group.

Figure 3.The effect of Astragalus injection on the expression of Bcl-2 protein after hypoxia /hypoglycemia and reoxygenation in hippocampal neurons of rats.±s.n=5.*Plt;0.05 vs normal control group; #Plt;0.05 vs model group and vehicle control group.
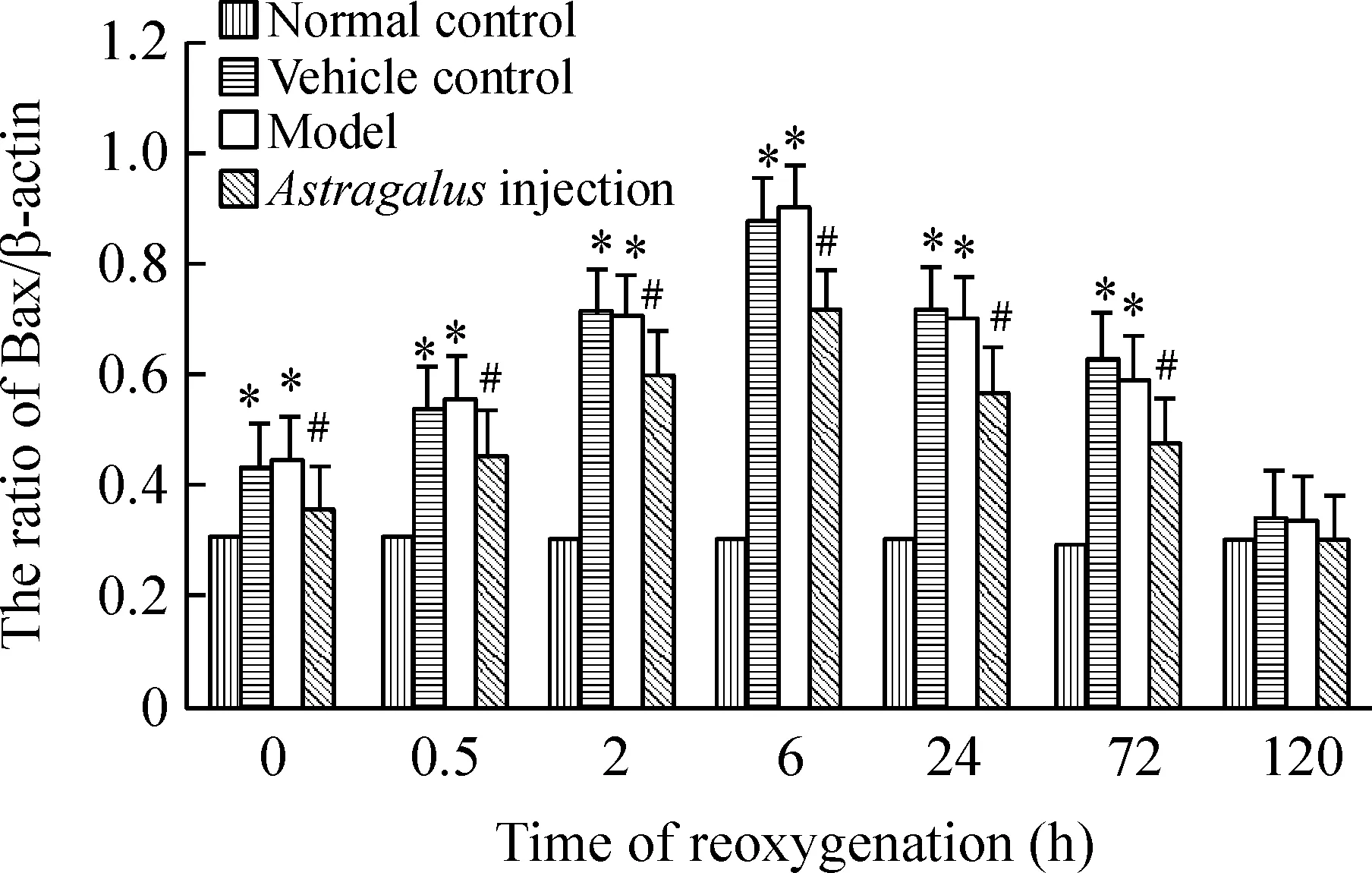
Figure 4.The effect of Astragalus injection on expression of Bax protein after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats±s.n= 5.*Plt;0.05 vs normal control group; #Plt;0.05 vs model group and vehicle control group.

Figure 5.The effect of Astragalus injection on the ratio of Bcl-2/Bax after hypoxia /hypoglycemia and reoxygenation in hippocampal neurons of rats.±s.n= 5.*Plt;0.05 vs normal control group; #Plt;0.05 vs model group and vehicle group.
讨 论
脑血管病是神经系统常见病、多发病,其致死率、致残率均高,缺血造成脑组织损伤,再灌注使可逆性缺血损伤加重,并通过各种反应将可逆性损伤转化为不可逆性损伤。大脑是对缺血缺氧十分敏感的组织,而海马则是中枢神经系统中对缺氧耐受相对较差的部位。研究表明[3],神经细胞缺氧缺糖/复氧复糖后常常发生细胞凋亡。海马神经细胞凋亡是受各种基因调控的程序化死亡过程,其病理生理机制非常复杂,其中,线粒体通路是最普遍的凋亡机制和细胞凋亡核心。另外,研究表明[4],线粒体通路主要受bcl-2基因家族调控,其中bcl-2和bax是一对在功能上相互对立的凋亡调控基因,脑缺血再灌注损伤与凋亡相关基因bcl-2、bax密切相关。bcl-2是抗凋亡基因,可阻止许多因素所诱导的细胞凋亡,而bax是促凋亡基因,二者的比例是决定细胞是否发生凋亡的重要调控因素[5]。Bax蛋白不但拮抗Bcl-2的抑制凋亡作用,而且有直接促进细胞凋亡的功能。实验表明,Bcl-2家族成员通过调节线粒体外膜的通透性和完整性起重要调控作用[6]。Bcl-2/Bax镶嵌在线粒体膜上,调控凋亡诱导蛋白的释放和线粒体功能,两者间的平衡影响凋亡的发生[5]。定位于线粒体外膜的Bcl-2可能是线粒体PT孔道的组成成份,能调节线粒体膜对一些凋亡蛋白前体的通透性。线粒体外膜上的Bax能允许一些离子和小分子物质(细胞色素C等)穿过线粒体膜,进入细胞质,从而引起细胞凋亡,而Bcl-2的作用正好相反,它能封闭Bax形成孔道的活性,使一些小分子不能自由通透,从而保护细胞免于凋亡;Bcl-2还能将凋亡蛋白前体Apaf-1等定位至线粒体膜上,使其不能发挥凋亡作用。在细胞中Bcl-2和Bax蛋白是以异二聚体的形式存在,阻止Bax插入线粒体外膜,保护线粒体电势梯度,调节细胞内Ca2+的自稳状态和氧化还原状态来抑制凋亡。如果Bcl-2和Bax的表达量相互平衡,形成的Bcl-2/Bax异二聚体占优势,则细胞的存活期正常;如果Bcl-2过表达而Bax的表达不相应增多,使形成的Bcl-2/Bcl-2同二聚体占优势,则细胞的存活期延长;如Bax过表达而Bcl-2不相应增多,使形成的Bax/Bax同二聚体占优势,则发生细胞凋亡[7]。
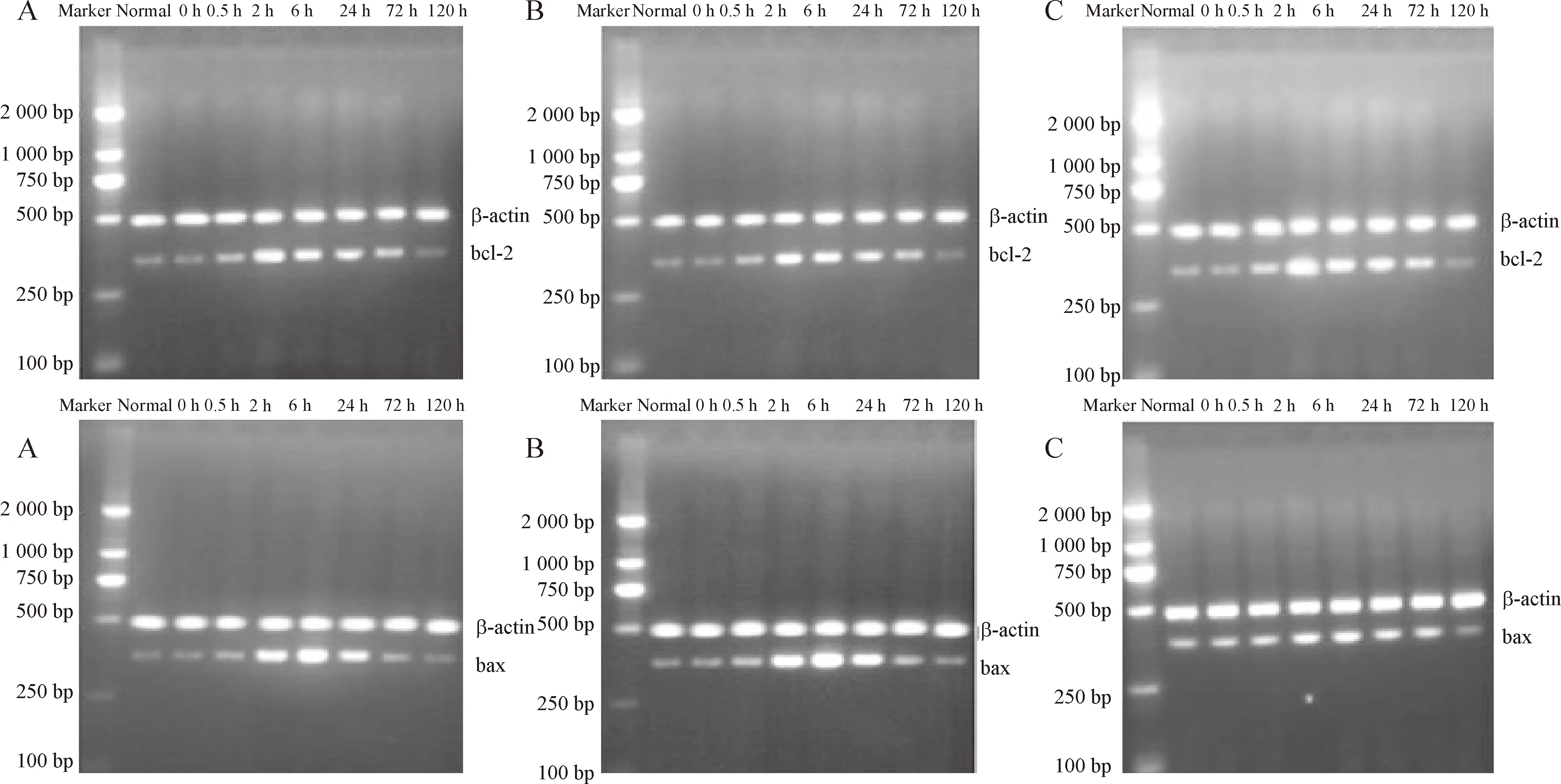
Figure 6.The effect of Astragalus injection on expression of bcl-2 and bax mRNA after hypoxia /hypoglycemia and reoxygenation in hippocampal neurons of rats.A:model group;B: vehicle control group;C:Astragalus injection treatment group.
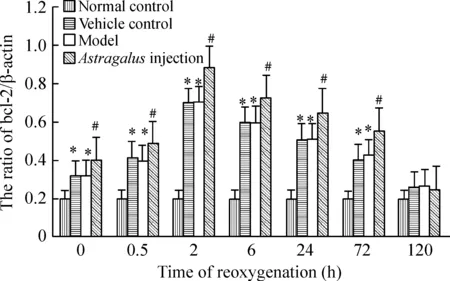
Figure 7.The effect of Astragalus injection on expression of bcl-2 mRNA after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats.±s.n=5.*Plt;0.05 vs normal control group; #Plt;0.05 vs model group and vehicle control group.

Figure 8.The effect of Astragalus injection on expression of bax mRNA after hypoxia/hypoglycemia and reoxygenation in hippocampal neurons of rats.±s.n=5.*Plt;0.05 vs normal control group; #Plt;0.05 vs model group and vehicle control group.

Figure 9.The effect of Astragalus injection on the ratio of bcl-2/bax after hypoxia /hypoglycemia and reoxygenation in hippocampal neurons of rats.±s.n= 5.*Plt;0.05 vs normal control group; #Plt;0.05 vs model group and vehicle group.
中医药对脑缺血再灌注后神经细胞凋亡干预作用的研究倍受人们关注。其中,黄芪具有补气生阳、益气固表、抗毒生肌之功能。药理学研究表明,黄芪成分复杂,生理活性多种多样。黄芪能明显提高脑缺血/再灌注鼠脑组织内超氧化物歧化酶、一氧化氮合酶和一氧化氮含量,清除氧自由基,增加微循环灌注,从而有效对抗脑缺血/再灌注损伤[8]。以黄芪的提取液为主要成分的现代中药制剂黄芪注射液,具有益气养元、扶正祛邪、养心通脉、健脾利湿之功。黄芪注射液每1 mL相当于生药2 g,叶冬青等[9]的研究证明黄芪注射液对体外培养的缺氧缺糖后复氧复糖大鼠海马神经细胞有保护作用。张雅丽等[3]黄芪注射液可以抑制缺氧缺糖后复氧复糖大鼠海马神经细胞的凋亡,提高细胞的活性,对缺氧缺糖后复氧复糖大鼠海马神经细胞有保护作用。
本实验以大鼠海马神经元原代培养为基础,通过对培养细胞施加缺氧缺糖/复氧复糖因素来模拟脑缺血/再灌注病理生理过程,建立脑缺血/再灌注的细胞模型,观察黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元Bcl-2和Bax表达的影响。研究证实,模型组和黄芪注射液溶剂对照组海马神经元内Bcl-2和Bax的表达显著高于正常组,且Bcl-2在复氧复糖后2 h表达达高峰,而Bax在复氧复糖后6 h表达达高峰;与模型组比,黄芪注射液组各时点Bcl-2表达显著增加,而Bax表达显著降低。本实验表明,海马神经元在缺氧缺糖后复氧复糖Bcl-2随细胞凋亡信号的启动而开始升高,与Bax结合成Bcl-2/Bax异二聚体,抑制细胞凋亡;而脑缺血再灌注损伤后Bax在细胞接受凋亡信号后表达增加,发挥进一步凋亡信号传递过程,故在模型组显著升高。黄芪注射液显著上调Bcl-2的表达,发挥明显的抗神经细胞凋亡的作用。本实验观察到缺氧缺糖/复氧复糖后120 h Bcl-2和Bax的表达与正常组相比差异无显著,推测可能是与磷酸化的Bcl-2和Bax半衰期密切相关[10],复氧复糖72 h后高表达的Bcl-2和Bax蛋白开始大量降解,复氧复糖后120 h表达趋近正常,与文献报道一致。
本实验结果证明,大鼠海马神经元缺氧缺糖/复氧复糖后有明显的神经细胞凋亡现象,而黄芪注射液有明显的抗凋亡作用,其作用机制可能与下调促凋亡基因bax水平,上调抗凋亡基因Bcl-2水平,提高Bcl-2/Bax比值有关。
[1]刘广义,付志新,郝娟芝,等.大鼠脑缺血再灌流后Bcl-2、Caspase-3 mRNA水平表达与大脑皮层及纹状体区炎性细胞浸润的影响[J].神经疾病与精神卫生,2004,4(4):252-525.
[2]Bossenmeyer C,Chihab R,Muller S,et al.Hypoxia/reoxygenation induces apoptosis through biphasic induction of protein synthesis in cultured rat brain neurons[J].Brain Res,1998,787(1):107-116.
[3]张雅丽,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖后复氧复糖大鼠海马神经细胞凋亡的研究[J].中国老年学杂志,2009,29(7):793-796.
[4]吴有志,徐善水.细胞凋亡及其基因调控与脑血管痉挛[J].神经疾病与精神卫生,2006,6(1):61- 64.
[5]Burguillos MA,Hajji N,Englund E,et al.Apoptosis-inducing factor mediates dopaminergic cell death in response to LPS-induced inflammatory stimulus:evidence in Parkinson’s disease patients[J].Neurobiol Dis,2011,41(1):177-188.
[6]Lin HH,Chen JH,Huang CC,et al.Apoptotic effect of 3,4-dihydroxybenzoic acid on human gastric carcinoma cells involving JNK/p38MAPK signaling activation[J].Int J Cancer,2007,120(11): 2306-2316.
[7]Tomasin R,Cintra Gomes-Marcondes MC.Oral administration ofAloeveraand honey reduces walker tumour growth by decreasing cell proliferation and increasing apoptosis in tumour tissue[J].Phytother Res,2011,25(4):619-623.
[8]陈晓春,薛 茜.大鼠脑缺血再灌注损伤及黄芪对脑细胞保护作用的实验研究[J].陕西医学杂志,2004,33(11):974-976.
[9]叶冬青,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖/复氧复糖大鼠海马神经元JNK3 mRNA的表达[J].中国病理生理杂志,2009,25 (9) : 1756-1761.
[10]Papucci L,Witort E,Bevilacqua AM,et al.Impact of targeting the adenine- and uracil-rich element ofbcl-2 mRNA with oligoribonucleotides on apoptosis,cell cycle,and neuronal differentiation in SHSY-5Y cells[J].Mol Pharmacol,2008,73(2):498-508.
AstragalusinjectionaffectsexpressionofBcl-2andBaxafterhypoxia/hypoglycemiaandreoxygenationinrathippocampalneurons
JIAO Jun-xia1,GAO Wei-juan2,LI Yu-ming1,QIAN Tao3,ZHOU Xiao-chun1,ZHU Yan-jie1,DONG Ya-jie1
(1DepartmentofPathophysiology,ChengdeMedicalCollege,Chengde067000,China;2HebeiChemicalamp;PharmaceuticalCollege,3HebeiProvincialHospital,Shijiazhuang050026,China.E-mail:gwj6088@163.com)
AIM: To investigate the effect ofAstragalusinjection on the expression of Bcl-2 and Bax after hypoxia/hypoglycemia and reoxygenation in rat hippocampal neurons.METHODSThe hippocampal neurons cultured for 8 days were divided into 4 groups: normal control group,model group (hypoxia/hypoglycemia and reoxygenation group),vehicle control group (hypoxia/hypoglycemia and reoxygenation+Astragalusvehicles control group),andAstragalusinjection treatment group (hypoxia/hypoglycemia and reoxygenation+Astragalusinjection treatment group).The rats in model group,Astragalusinjection treatment group and vehicle control group were deprived of oxygen and glucose for 30 min.The methods of Western blotting and RT-PCR were used to measure the expression of Bcl-2 and Bax at mRNA and protein levels after hypoxia/hypoglycemia and reoxygenation for 0 h,0.5 h,2 h,6 h,24 h,72 h and 120 h.RESULTSCompared to normal control group,the protein expression of Bcl-2 and Bax increased obviously and the ratio of Bcl-2/Bax decreased in model group (Plt;0.05).Compared to model group,the protein expression of Bcl-2 and Bax at each time point in vehicle control group had no obvious change (Pgt;0.05).However,the protein expression of Bcl-2 and the ratio of Bcl-2/Bax increased obviously,but the protein expression of Bax decreased obviously (Plt;0.05) inAstragalusinjection treatment group.The expression of bcl-2 and bax mRNA showed the same tendency as the proteins changed.CONCLUSIONAstragalusinjection inhibits the expression of Bax and increases the expression of Bcl-2,thus regulating the ratio of Bcl-2/Bax after hypoxia/hypoglycemia and reoxygenation and inhibiting the process of apoptosis in hippocampal neurons.
Hypoxia/hypoglycemia and reoxygenation;Astragalusinjection; Bcl-2; Bax; Hippocampal neurons; Apoptosis
1000-4718(2011)05-0905-06
R363
A
10.3969/j.issn.1000-4718.2011.05.014
2010-10-18
2011-03-04
国家自然科学基金资助项目(No.81072923)
△通讯作者 Tel:0311-85110168;E-mail:gwj6088@163.com
