结直肠腺瘤及癌变组织CHOP蛋白表达与细胞凋亡的相关性研究*
2011-11-20陈俊榕李初俊杨惠玲张君孝王苏美朱颖钰叶晓丹
陈俊榕, 李初俊△, 杨惠玲, 张君孝, 王苏美, 朱颖钰, 叶晓丹
(1中山大学附属第六医院,广东 广州 510655;2中山大学中山医学院病理生理学教研室,广东 广州 510080)
结直肠腺瘤及癌变组织CHOP蛋白表达与细胞凋亡的相关性研究*
陈俊榕1, 李初俊1△, 杨惠玲2, 张君孝1, 王苏美2, 朱颖钰1, 叶晓丹1
(1中山大学附属第六医院,广东 广州 510655;2中山大学中山医学院病理生理学教研室,广东 广州 510080)
目的: 检测和探讨结直肠腺瘤及癌变组织C/EBP同源蛋白(CHOP)表达和细胞凋亡及其与临床病理的关系,并分析CHOP与细胞凋亡指数(AI)的相关性。方法采用免疫组织化学SABC法和原位末端标记法分别检测59 例正常肠黏膜、67 例结直肠腺瘤和56 例结直肠腺癌组织CHOP表达及细胞凋亡。结果CHOP在伴高级别上皮内瘤变和恶变的腺瘤和腺癌组织阳性表达率均显著高于正常肠黏膜和早期腺瘤(Plt;0.05),且与腺瘤大小、病理类型和肠癌大小、浸润深度相关(Plt;0.05);伴高级别上皮内瘤变和恶变的腺瘤和腺癌组织AI显著高于正常肠黏膜和早期腺瘤(Plt;0.05),AI与腺瘤大小、病理类型和肠癌大小有关(Plt;0.05);伴高级别上皮内瘤变和恶变的腺瘤和腺癌组织CHOP阳性表达者AI显著高于阴性表达者(Plt;0.05),在具有某相同临床病理特征的腺瘤和肠癌组织中CHOP阳性表达者AI显著高于CHOP阴性表达者(Plt;0.05)。结论CHOP和细胞凋亡异常共同参与结直肠腺瘤癌变,CHOP表达与细胞凋亡增加有关,CHOP可能通过促细胞凋亡介导腺瘤癌变。
结直肠肿瘤; C/EBP同源蛋白质; 细胞凋亡
随着我国经济快速发展,人民生活水平不断提高,饮食结构发生巨大变化,结直肠癌(colorectal cancer,CRC)发病率逐年上升,目前我国部分地区CRC发病率和死亡率已达到发达国家水平。研究表明CRC主要起源于腺瘤[1],该过程伴随癌基因和抑癌基因的突变,且与高脂饮食等密切相关;但由于其机制尚未完全阐明,CRC早期诊断困难,过半数患者确诊时癌细胞已发生转移[2]。因此,进一步研讨和阐明结直肠腺瘤癌变机制,确立CRC早预测、早诊断和早治疗的新方法,对保障我国社会主义现代化建设的顺利进行具有重要的战略意义。细胞凋亡和增殖异常是肿瘤发生发展的细胞学机制。近年发现的除传统的线粒体和死亡受体介导的细胞凋亡途径外,新的细胞凋亡调控途径-内质网应激(endoplasmic reticulum stress,ERS)可在缺氧等病理条件下被激活,并通过转录上调其特异转录因子C/EBP同源蛋白(C/EBP homologous protein,CHOP)[3],诱导细胞凋亡。研究发现ERS参与多种肿瘤的发生、发展、侵袭、转移、治疗及预后,如反义葡萄糖调节蛋白78 (glucose-regulated protein 78,GRP78)基因可抑制乳腺癌细胞231细胞的侵袭和转移[4];转染CHOP基因可通过诱导细胞凋亡增加胃癌细胞对抗癌药的敏感性[5]。目前ERS与CRC的研究主要集中在细胞水平,国内外尚未见ERS与结直肠腺瘤癌变的相关研究。本实验采用免疫组织化学SABC法和原位末端标记法(TdT-mediated dUTP-biotin nick end labeling method,TUNEL)分别检测59 例正常肠黏膜、67 例结直肠腺瘤和56 例结直肠腺癌组织ERS关键蛋白CHOP表达及细胞凋亡情况,分析其与临床病理特征的相关性,并探讨CHOP表达及细胞凋亡指数(apoptosis index,AI)的关系,旨在探明CHOP介导结直肠腺瘤癌变的确切作用,为下一步研究ERS介导结直肠腺瘤癌变作用及机制提供依据,也有望为CRC预测和早诊新方法的确立提供新思路。
材 料 和 方 法
1材料
收集中山大学附属第六医院消化内镜中心2009 年1 月至12 月电子结肠镜下全瘤切除的结直肠腺瘤组织标本67 例,其中男37 例,女30 例;年龄26-81岁,平均年龄53.7岁;腺瘤直径lt;1 cm者26例,≥1 cm者41 例;参照WHO新分类标准[6],分类分别为管状腺瘤30 例,绒毛状腺瘤37 例;早期腺瘤38 例,腺瘤伴高级别上皮内瘤变16 例,腺瘤伴恶变13 例(早期腺瘤:指伴轻、中度异型增生的腺瘤;腺瘤伴高级别上皮内瘤变:包括伴重度异型增生的腺瘤、原位癌和黏膜内癌);无蒂腺瘤22 例,有蒂腺瘤45 例。收集中山大学附属第六医院病理科同期外科手术标本结直肠腺癌56 例(患者术前均未接受放疗和化疗),其中男30 例,女26 例;年龄30-80岁,平均年龄56岁;肿瘤直径lt;3 cm者15例,≥3 cm者41 例;参照WHO新分类标准[6],分类分别为:高分化腺癌17 例,中分化腺癌31 例,低分化腺癌8 例;肿瘤浸润深度未及肠壁全层者11 例,已浸润肠壁全层者17 例,突破浆膜层远处转移者28 例;较早期21 例,较晚期35例(较早期肠癌:指按Duke’s分期为A期和B期的肠癌;较晚期肠癌:指按Duke’s分期为C期和D期的肠癌[6]);无肠周淋巴结转移26 例,有肠周淋巴结转移30 例。另收集中山大学附属第六医院病理科保存的同期正常肠黏膜组织标本59 例,性别及年龄均与结直肠腺瘤和腺癌标本匹配。所有标本均经10%甲醛固定、脱水、常规石蜡包埋,4 μm连续切片,贴在涂有3-氨丙基三乙氧基硅烷(APES)黏附剂的载玻片上,烘箱烤干备用。HE染色病理确诊。
2方法
2.1免疫组织化学SABC法 CHOP多抗(F-168:sc575)购自Santa Cruz;SABC试剂盒(SA1022)购自武汉博士德生物工程有限公司;二氨基联苯胺(diaminobenizidine,DAB)显色试剂盒(ZLI-9032)购自北京中杉金桥生物技术有限公司。主要步骤包括:(1)烤片,常规脱蜡及水合;(2)枸橼酸盐缓冲液pH 6.0微波修复4×6 min,冷却至室温,蒸馏水漂洗10 min;(3)3%H2O2室温封闭10 min,以阻断其内源酶,TBST漂洗10 min;(4)细胞通透30 min,TBST漂洗10 min;(5)血清封闭20 min,甩干;(6)滴加CHOPⅠ抗(工作浓度1∶100),4 ℃孵育过夜,TBST漂洗10 min;(7)滴加Ⅱ抗,室温60 min,TBST漂洗10 min;(8)滴加SABC工作液,室温30 min,TBST漂洗10 min; (9)DAB显色2 min,自来水漂洗;(10)苏木素复染30 s,1%盐酸乙醇分化3 s,自来水漂洗,脱水、透明、封片、光学显微镜观察。用已知CHOP阳性乳腺癌组织作阳性对照,PBS代替CHOPⅠ抗作阴性对照。如CHOP表达阳性,则可见棕黄色细颗粒状分布于细胞核及细胞浆。根据DAB显色结果,双盲法光学显微镜观察,参照Formwitz评分方法进行评分:阳性细胞百分比评分标准为:lt;5%者计0 分,5%-24%者1 分,25%-49%者2 分,50%-74%者3 分,≥75%者4 分;染色强度评分标准为:无色计0 分,淡黄色1 分,黄色2 分,棕黄色3 分。以上2项得分的乘积即该样本的染色得分。根据上述得分评价样本染色情况:≤3 分为阴性,gt;3 分为阳性[7]。
2.2TUNEL法 根据凯基TUNEL细胞凋亡检测试剂盒(FITC标记POD法)说明书进行染色。主要步骤包括:(1)烤片,常规脱蜡及水合;(2)蛋白酶K21-37 ℃消化30 min,PBS漂洗10 min;(3)3%H2O215-25 ℃封闭10 min,以阻断其内源酶,PBS漂洗10 min;(4)滴加TdT酶反应液,加盖玻片37 ℃避光湿润反应60 min,PBS漂洗15 min;(5)荧光显微镜观察:激发波长450-500 nm,发射波长515-565 nm;(6)滴加anti-fluorescein antibody工作液,加盖玻片37 ℃湿润避光反应30 min,PBS漂洗15 min;(7)DAB显色10 min,自来水漂洗;(8)苏木素复染30 s,1%盐酸乙醇分化3 s,自来水漂洗,脱水、透明、封片、光学显微镜观察和计数。用已知阳性肝癌组织作阳性对照,省去TdT酶的TdT反应液作阴性对照。荧光显微镜下可见凋亡阳性的细胞激发出绿色荧光;光学显微镜下可见凋亡细胞的细胞核呈棕色,连续观察5个高倍视野(×400),随机计数1 000个细胞中凋亡阳性细胞数,求出平均每100个细胞中的凋亡阳性细胞数,即凋亡指数(apoptotic index,AI)[8]。
3统计学处理
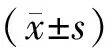
结 果
1结直肠腺瘤及癌变组织CHOP表达及其与临床病理的关系
正常肠黏膜组织CHOP不表达或少量表达在细胞浆;PBS代替Ⅰ抗组染色呈阴性。腺瘤和腺癌组织CHOP表达明显增加,可分布于细胞核和细胞浆,见图1。早期腺瘤、伴高级别上皮内瘤变的腺瘤、伴恶变的腺瘤和腺癌组织CHOP阳性表达率分别为15.79%、56.25%、69.23%和76.79%(2=56.361,Plt;0.01)。与正常肠黏膜和早期腺瘤比较,伴高级别上皮内瘤变和恶变的腺瘤组织CHOP阳性表达率均显著增加(Plt;0.05),而与腺癌无显著差异(Pgt;0.05);早期腺瘤CHOP阳性表达率与正常肠黏膜无显著差异(Pgt;0.05),见表1。

Figure 1.CHOP expression detected by immunohistochemistry.A: colorectal adenocarcinomas (HE staining,×400);B: negative control(×200);C: normal colonic mucosas(×200);D: colorectal adenomas at the early stages(×200);E: adenomas with malignant transformation(×200);F: colorectal adenocarcinomas(×200).
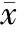
表1 结直肠腺瘤癌变不同阶段组织CHOP表达和AI
CHOP表达与结直肠腺瘤的大小和病理类型有关。直径≥1 cm的腺瘤CHOP阳性表达率显著高于直径lt;1 cm的腺瘤(2=9.240,Plt;0.01);绒毛状腺瘤CHOP阳性表达率显著高于管状腺瘤(2=17.854,Plt;0.01);未发现CHOP表达与患者年龄、性别、腺瘤形态和腺瘤部位相关(Pgt;0.05),见表2。
CHOP表达与肠癌的大小和浸润深度有关。直径≥3 cm的肠癌组织CHOP阳性表达率显著高于直径lt;3 cm者(2=4.652,Plt;0.05);与未及肠壁全层者相比,浸润肠壁全层和突破浆膜层的肠癌组织CHOP阳性表达率均显著增高(2=6.601,Plt;0.05),两者之间无显著差异(Pgt;0.05);未发现CHOP表达与患者年龄、性别、肿瘤形态、部位、分化、淋巴结转移、脏器转移、分期等相关(Pgt;0.05),见表3。
2结直肠腺瘤及癌变组织AI及其与临床病理的关系
所有正常肠黏膜、腺瘤、腺癌组织均可检测到凋亡细胞。荧光显微镜可见凋亡细胞激发出绿色荧光,见图2;正常肠黏膜组织可见极少绿色荧光点,阴性对照组未见绿色荧光点;伴恶变的腺瘤和腺癌组织绿色荧光点显著增加,有时可成簇存在。光学显微镜可见凋亡细胞的细胞核呈棕色,固缩成团,聚集成环状或碎裂,形成凋亡小体;正常肠黏膜少见细胞凋亡,伴高级别上皮内瘤变的腺瘤、伴恶变的腺瘤以及腺癌组织凋亡阳性细胞数成倍增加。正常肠黏膜、早期腺瘤、腺瘤伴高级别上皮内瘤变、腺瘤伴恶变和腺癌AI分别为(0.89 ± 0.79)%、(1.61 ± 1.18)%、(3.96 ± 2.38)%、(5.84 ± 2.14)%、(5.43 ± 2.73)%;与正常肠黏膜和早期腺瘤相比,伴高级别上皮内瘤变的腺瘤、伴恶变的腺瘤和腺癌AI显著增加(Plt;0.05),但三者之间无显著差异(Pgt;0.05);正常肠黏膜和早期腺瘤AI无显著差异(Pgt;0.05),见表1。
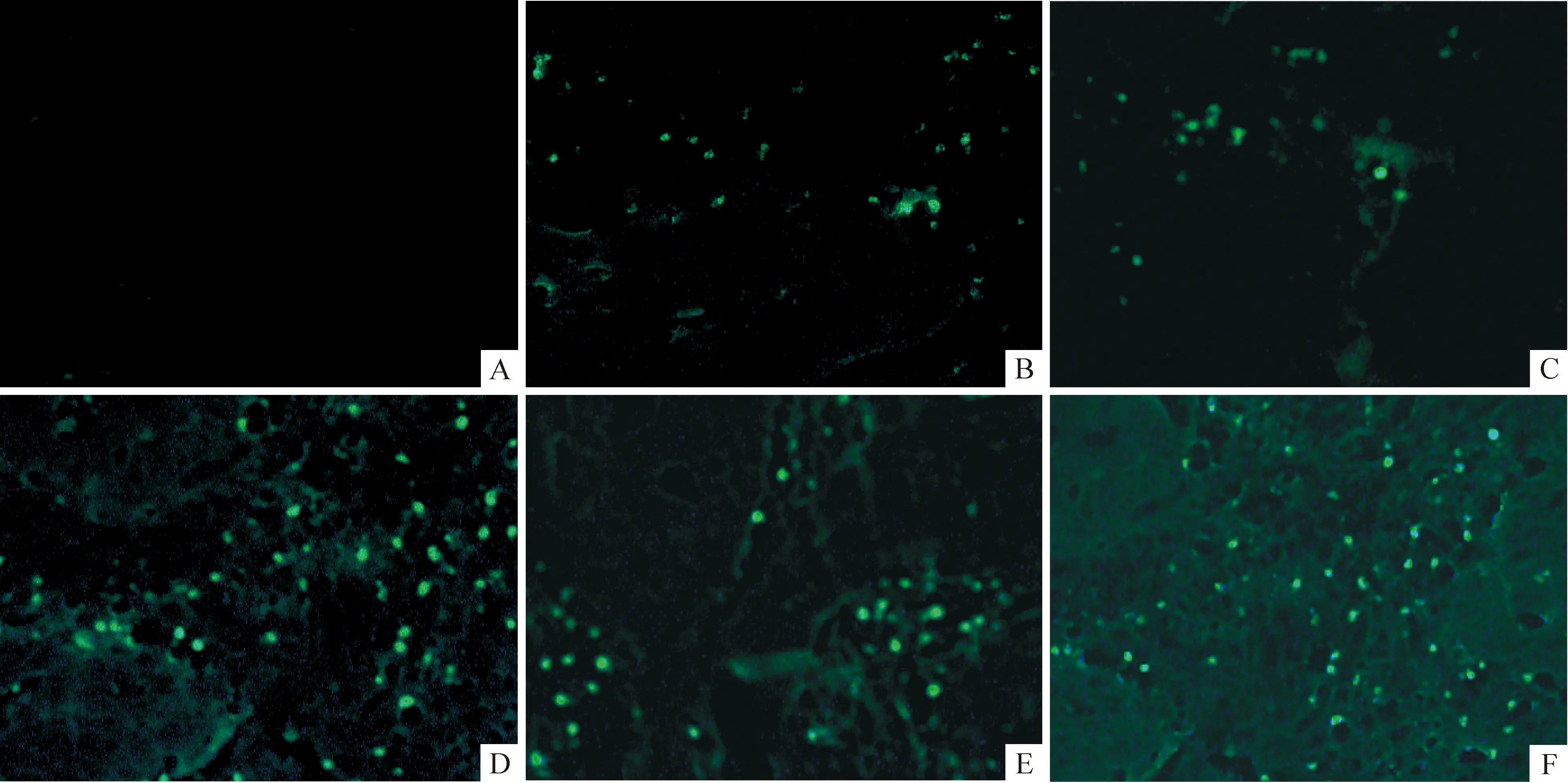
Figure 2.The apoptotic index (AI) determined by TUNEL(×400).A: negative control;B: normal colonic mucosas;C: colorectal adenomas at the early stages;D: adenomas with high-grade intraepithelial neoplasia;E: adenomas with malignant transformation;F: colorectal adenocarcinomas.
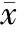
表2 结直肠腺瘤组织CHOP表达或AI与临床病理的关系
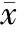
表3 结直肠癌组织CHOP表达或AI与临床病理的关系
AI与结直肠腺瘤的大小和病理类型有关。直径≥1 cm的腺瘤AI显著高于直径lt;1 cm的腺瘤(F=7.483,Plt;0.01);绒毛状腺瘤AI显著高于管状腺瘤(F=15.599,Plt;0.01);未发现AI与患者年龄、性别、腺瘤形态和腺瘤部位相关(Pgt;0.05),见表2。
AI与肠癌的大小有关。直径≥3 cm的肠癌组织AI显著高于直径lt;3 cm者(F=4.859,Plt;0.05);未发现AI与患者年龄、性别、肿瘤形态、部位、分化、浸润深度、淋巴结转移、脏器转移、分期等相关(Pgt;0.05),见表3。
3结直肠腺瘤及癌变组织CHOP表达与AI的关系
伴高级别上皮内瘤变和恶变的腺瘤和腺癌组织CHOP阳性表达者AI显著高于CHOP阴性表达者(Plt;0.05);正常肠黏膜和早期腺瘤组织CHOP阳性表达者AI与CHOP阴性表达者之间无显著性差异(Pgt;0.05),见表4。
将与CHOP表达有关的腺瘤大小和病理类型、肠癌的大小和浸润深度等临床病理特征作为分组依据,分析具有某相同临床病理特征的结直肠腺瘤和肠癌组织CHOP阳性表达者AI与CHOP阴性表达者AI之间的差异。在直径lt;1 cm、直径≥1 cm、管状腺瘤和绒毛状腺瘤等各组结直肠腺瘤组织中CHOP阳性表达的组织AI均显著高于CHOP阴性表达者(Plt;0.05);在直径lt;3 cm、直径≥3 cm和浸润深度未及肠壁全层及突破浆膜层的各组肠癌组织中CHOP阳性表达的组织AI均显著高于CHOP阴性表达者(Plt;0.05),侵润肠壁全层的肠癌组织CHOP阳性表达的组织AI明显高于CHOP阴性表达者,但无显著差异(Pgt;0.05),见表4。
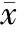
表4 结直肠腺瘤癌变不同阶段组织CHOP表达与AI的关系
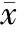
表5 具有某相同临床病理特征的结直肠腺瘤及肠癌组织CHOP表达与AI的关系
讨 论
ERS是最新提出的有别于由死亡受体和线粒体介导的传统细胞凋亡途径之外的第3条重要的细胞凋亡调控途径,缺氧、糖剥夺[9,10]等病理因素均可导致ERS。其中缺氧是激发ERS的主要因素[11]。内质网是机体内蛋白折叠的重要场所,缺氧可直接导致二硫键形成受阻和ATP生成不足,影响肽链折叠,未折叠蛋白在内质网腔内积聚,从而促发未折叠蛋白反应(unfolded protein response,UPR),激活ERS。在哺乳动物细胞中,ERS有抑制物阻抗性酯酶1(inositol requirement 1,IRE-1)、活化转录因子-6(activating transcription factor-6,ATF-6)和双链RNA激活蛋白激酶样内质网激酶(double-stranded RNA-activated protein kinase-like endoplasmic reticulum kinase,PERK)介导的3条通路。当存在缺氧等应激时,活化的内质网跨膜蛋白(PERK、IRE1和ATF6)胞浆部分进入核内,与ERS反应元件(ERS response element,ERSE)保守基序CCAAT(N9)GCACG中的GCACG结合,启动CHOP转录与表达[3]。CHOP属于C/EBP转录因子家族成员,也叫DNA损伤诱导转录因子3(DNA damage-inducible transcript 3,DDIT3),或生长抑制DNA损伤基因153(growth arrest and DNA damage- inducible gene 153,GADD153),分子量为29 kD,人CHOP由169 个氨基酸残基构成,含有一个N端转录激活域和C端的碱性锌指(bZIP)结构域。CHOP是ERS特异转录因子;静息状态下,即不存在ERS时,在多种类型的细胞胞浆中低水平表达;当ERS通路被激活,其表达显著增加。在结直肠腺瘤癌变-肠癌形成过程中,由于癌细胞失控性生长消耗大量的营养和氧气,而新生血管网又不能及时建立,氧供应远少于氧需求,癌细胞常处于缺氧微环境。研究发现缺氧在CRC恶性进展中起着至关重要的作用[12]。本研究通过对结直肠腺瘤及癌变组织CHOP蛋白的检测发现,伴高级别上皮内瘤变和恶变的腺瘤和腺癌CHOP阳性表达率均显著高于正常肠黏膜和早期腺瘤,提示在结直肠腺瘤癌变过程ERS被激活。其他学者通过研究也发现实体肿瘤缺氧可激活PERK-eIF2α、IRE1-XBP1和ATF6通路,如Shuda等[13]研究发现人肝癌组织中ATF6、IRE1-XBP1通路被激活,使肿瘤细胞适应缺氧环境,肿瘤向恶性方向发展。研究发现CHOP表达与腺瘤的大小、病理类型以及肠癌的大小、浸润深度相关。随着腺瘤癌变-肠癌发生-肿瘤进展,CHOP表达逐渐增加,提示CHOP与腺瘤和肠癌的恶性程度有关,与Zheng等[14]和Zhang等[15]报道的胃癌高侵袭性和预后差与内质网分子伴侣GRP78高表达有关结果一致。可能机制是由于肿瘤逐渐增大,恶性转化的细胞增殖速度加快,导致血管供应不足和缺氧加重,从而激发更严重的ERS。
细胞凋亡与增殖在正常生理状态下维持动态平衡,任一环节出现障碍都可导致肿瘤的发生和发展[16]。多数研究认为结直肠上皮恶性转化过程中存在“细胞选择性增殖”现象,腺瘤癌变过程细胞凋亡逐渐减少而细胞增殖逐渐增多,细胞过度增殖和凋亡受抑共同参与肿瘤的发生和发展[17]。另有学者则观点相反,认为肿瘤组织存在细胞过度增殖的同时,亦伴随着肿瘤细胞的凋亡活跃,并提出可能机制是细胞恶性转化过程中,机体通过增加细胞凋亡以淘汰具有突变倾向的细胞,以尽力防止恶变[18]。本研究通过对结直肠腺瘤癌变不同阶段组织细胞凋亡检测发现,高级别上皮内瘤变和恶变的腺瘤和腺癌AI显著高于正常肠黏膜和早期腺瘤,提示CRC癌前病变阶段(包括高级别上皮内瘤变和恶变的腺瘤)细胞凋亡已非常活跃;研究还发现AI与结直肠腺瘤的大小、病理类型和肠癌的大小明显相关。肿瘤越大、恶性度越高,细胞凋亡越频繁。可能机制是在腺瘤癌变-细胞恶性转化过程中,恶性细胞过度增殖使得局部血供和营养供应相对不足导致缺氧,从而激活ERS,通过转录上调CHOP蛋白诱导细胞凋亡增加以维持机体平衡[19],肿瘤才得以在缺氧应激下继续生存并发展。然而,这种推测有待于进一步考证。
细胞凋亡是多基因多环节调控的一个严密完整的、主动有序的死亡过程[20]。ERS是重要的细胞凋亡调控通路。有学者研究发现ERS可抑制细胞凋亡[21],参与肿瘤耐药机制;但更多的研究则表明ERS通过转录上调CHOP诱导细胞凋亡,从而抑制癌细胞生长,如Woo[22]研究发现白藜芦醇能通过上调CHOP诱导人类结肠癌细胞凋亡;硒通过诱导CHOP抑制甲状腺癌细胞生长[23]。本研究发现伴高级别上皮内瘤变和恶变的腺瘤和腺癌组织CHOP阳性表达者AI显著高于阴性表达者,在具有某相同临床病理特征的腺瘤和肠癌组织中CHOP阳性表达者AI明显高于CHOP阴性表达者,提示CHOP表达与细胞凋亡增加有关,CHOP可能通过诱导细胞凋亡介导腺瘤癌变。CHOP诱导细胞凋亡的机制未明,有研究认为可能是通过增加其靶蛋白TRB3表达,减少Akt磷酸化,诱导细胞凋亡[24];CHOP有死亡受体DR5结合位点,因此也可通过上调DR5激活死亡受体途径[25]诱导细胞凋亡。
本研究结果提示CHOP和细胞凋亡异常共同参与结直肠腺瘤癌变-肠癌发生过程,CHOP表达与细胞凋亡增加有关,CHOP可能通过促细胞凋亡介导结直肠腺瘤癌变。该结论初步揭示了腺瘤癌变过程ERS通路可能被激活并通过干预细胞凋亡介导腺瘤癌变,为下一步研究ERS对腺瘤癌变的确切作用及信号通路提供依据,实验结果也有望为CRC的预测和早诊新方法的确立提供新思路。
[1]Kuramitsu Y,Nakamura K.Proteomic analysis of cancer tissues: shedding light on carcinogenesis and possible biomarkers[J].Proteomics,2006,6(20):5650-5661.
[2]Law WL,Choi HK,Lee YM,et al.The impact of postoperative complications on long-term outcomes following curative resection for colorectal cancer[J].Ann Surg Oncol,2007,14(9):2559-2566.
[3]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death Differ,2004,11(4):381-389.
[4]刘荣华,王世宣,马湘一,等.葡萄糖调节蛋白78在乳腺癌细胞侵袭及转移中的作用[J].广东医学,2008,29(10):1617-1619.
[5]Kim R,Ohi Y,Inoue H,et al.Introduction of gadd153 gene into gastric cancer cells can modulate sensitivity to anticancer agents in association with apoptosis[J].Anticancer Res,1999,19(3A):1779-1783.
[6]来茂德.WHO新的结直肠肿瘤分类的特点[J].中华病理学杂志,2003,32(2):170-172.
[7]刘 芳,邢晓明,李玉军,等.结直肠腺癌组织Grp78表达及意义[J].青岛大学医学院学报,2009,45(3):252-254.
[8]周 琪,阎晓初,梁后杰,等.大肠腺瘤及癌变组织hMLH1和hMSH2表达与细胞凋亡的研究[J].现代肿瘤医学,2009,17(7):1280-1283.
[9]Verkhratsky A,Toescu EC.Endoplasmic reticulum Ca2+homeostasis and neuronal death[J].J Cell Mol Med,2003,7(4):351-361.
[10]Kaufman RJ.Stress signaling from the lumen of the endoplasmic reticulum: coordination of gene transcriptional and translational controls[J].Genes Dev,1999,13(10):1211-1233.
[11]郝小燕,边云飞,李茂莲,等.脂联素通过减轻内质网应激抑制缺氧复氧诱导的心肌细胞损伤[J].中国病理生理杂志,2010,26(6):1075-1079.
[12]Zheng J,Sun X,Wang W,et al.Hypoxia-inducible factor-1α modulates the down-regulation of the homeodomain protein CDX2 in colorectal cancer[J].Oncol Rep,2010,24(1):97-104.
[13]Shuda M,Kondoh N,Imazeki N,et al.Activation of the ATF6,XBP1 and grp78 genes in human hepatocellular carcinoma: a possible involvement of the ER stress pathway in hepatocarcinogenesis[J].J Hepatol,2003,38(5):605-614.
[14]Zheng HC,Takahashi H,Li XH,et al.Overexpression of GRP78 and GRP94 are markers for aggressive behavior and poor prognosis in gastric carcinomas[J].Hum Pathol,2008,39(7):1042-1049.
[15]Zhang J,Jiang Y,Jia Z,et al.Association of elevated GRP78 expression with increased lymph node metastasis and poor prognosis in patients with gastric cancer[J].Clin Exp Metastasis,2006,23(7-8):401-410.
[16]Kutanzi KR,Koturbash I,Bronson RT,et al.Imbalance between apoptosis and cell proliferation during early stages of mammary gland carcinogenesis in ACI rats[J].Mutat Res,2010,694(1-2):1-6.
[17]孙保存,赵秀兰.大肠癌及其癌前病变中细胞凋亡与细胞增殖间关系的原位观察[J].中华医学杂志,1996,76(11):848-851.
[18]曾浩然,刘学勇,陈德志,等.Caspase-3基因在大肠癌、大肠腺瘤中的表达及其与细胞凋亡的关系[J].中国厂矿医学,2008,21(5):515-517.
[19]Lipponen PK,Aaltomaa S.Apoptosis in bladder cancer as related to standard prognostic factors and prognosis[J].J Pathol,1994,173(4):333-339.
[20]Vermeulen K,Van Bockstaele DR,Berneman ZN.Apoptosis: mechanisms and relevance in cancer[J].Ann Hematol,2005,84(10):627-639.
[21]Rahmani M,Mayo M,Dash R,et al.Melanoma differentiation associated gene-7/interleukin-24 potently induces apoptosis in human myeloid leukemia cells through a process regulated by endoplasmic reticulum stress[J].Mol Pharmacol,2010,78(6):1096-1104.
[22]Woo KJ,Lee TJ,Lee SH,et al.Elevated gadd153/chop expression during resveratrol-induced apoptosis in human colon cancer cells[J].Biochem Pharmacol,2007,73(1):68-76.
[23]Kato MA,Finley DJ,Lubitz CC,et al.Selenium decreases thyroid cancer cell growth by increasing expression of GADD153 and GADD34[J].Nutr Cancer,2010,62(1):66-73.
[24]Bromati CR,Lellis-Santos C,Yamanaka TS,et al.UPR induces transient burst of apoptosis in islets of early lactating rats through reduced AKT phosphorylation via ATF4/CHOP stimulation of TRB3 expression[J].Am J Physiol Regul Integr Comp Physiol,2011,300(1):R92-R100.
[25]Su RY,Chi KH,Huang DY,et al.15-deoxy-Δ12,14-prostaglandin J2 up-regulates death receptor 5 gene expression in HCT116 cells: involvement of reactive oxygen species and C/EBP homologous transcription factor gene transcription[J].Mol Cancer Ther,2008,7(10):3429-3440.
RelationshipbetweenCHOPexpressionandapoptosisincolorectaladenomasandcanceroustissues
CHEN Jun-rong1,LI Chu-jun1,YANG Hui-ling2,ZHANG Jun-xiao1,WANG Su-mei2,ZHU Ying-yu1,YE Xiao-dan1
(1TheSixthAffiliatedHospitalofSunYat-senUniversity,Guangzhou510655,China;2DepartmentofPathophysiology,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China.E-mail:lichujun@mail.sysu.edu.cn)
AIM: To study the expression of C/EBP homologous protein (CHOP) and cell apoptosis in colorectal adenomas and cancerous tissues,and investigate their relationship with clinicopathological characteristics.METHODSImmunohistochemistry[with Streptococcus avidin-biotin complex (SABC) method]and terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end-labeling (TUNEL) were used to detect CHOP expression and cell apoptosis,respectively,in 59 cases of normal colonic mucosae,67 cases of colorectal adenomas and 56 cases of colorectal adenocarcinomas.RESULTSThe CHOP-positive rates in adenomas with high-grade intraepithelial neoplasia,adenomas with malignant transformation and colorectal adenocarcinomas were significantly higher than those in normal colonic mucosas and colorectal adenomas in the early stage (Plt;0.05).The expression of CHOP was related with the adenoma size and pathological type,as well as the size and infiltration depth in colorectal cancer.The apoptotic index (AI) in adenomas with high-grade intraepithelial neoplasia,adenomas with malignant transformation and colorectal adenocarcinomas was significantly higher than that in normal colonic mucosas and colorectal adenomas in the early stage (Plt;0.05).The AI was related with the adenomas size,stage and pathological type,as well as the size of colorectal cancer.The AI of tumors with CHOP overexpression was significantly higher than that of the tumors with negative CHOP in adenomas with high-grade intraepithelial neoplasia,adenomas with malignant transformation and colorectal adenocarcinomas (Plt;0.05).The AI of tumors with CHOP overexpression was significantly higher than that of the tumors with negative CHOP in colorectal adenomas or adenocarcinomas with the same clinicopathological characteristics (Plt;0.05).CONCLUSIONThe abnormality of CHOP expression and cell apoptosis might participate in the carcinogenesis of colorectal adenomas.The expression of CHOP is related with AI.CHOP may mediate the carcinogenesis of colorectal adenomas through promoting cell apoptosis.
Colorectal neoplasms; C/EBP homologous protein; Apoptosis
1000-4718(2011)05-0875-08
R735.3+4
A
10.3969/j.issn.1000-4718.2011.05.009
2011-01-21
2011-04-07
广东省科技攻关资助项目(No.2005B30501004)
△通讯作者 Tel:020-38254116;E-mail:lichujun@mail.sysu.edu.cn
