U0126增强索拉非尼对K562细胞增殖抑制、凋亡及诱导分化作用*
2011-11-20肖若芝王立琳何程明阮星星熊慕珺林东军
陈 琰, 肖若芝△, 王立琳, 何程明, 阮星星, 熊慕珺, 林东军
(中山大学 1附属第三医院血液科,2血液病研究所,广东 广州 510630)
U0126增强索拉非尼对K562细胞增殖抑制、凋亡及诱导分化作用*
陈 琰1,2, 肖若芝1,2△, 王立琳1,2, 何程明1, 阮星星1, 熊慕珺1,2, 林东军1,2
(中山大学1附属第三医院血液科,2血液病研究所,广东 广州 510630)
目的: 观察索拉非尼、索拉非尼联合MEK激酶抑制剂U0126对人慢性粒细胞白血病K562细胞株增殖、凋亡及分化的影响,并初步探讨其机制。方法CCK-8法观察索拉非尼、U0126单用及不同浓度索拉非尼联合10 μmol/L U0126作用K562细胞48 h后细胞增殖活力变化;PI单染法及Hoechst 33342染色法观察索拉非尼、U0126单用及索拉非尼联合U0126对K562细胞株的凋亡诱导作用;细胞周期分析及联苯胺染色观察索拉非尼、U0126单用及低浓度索拉非尼联合U0126是否诱导K562细胞株向红系分化;采用免疫印迹法检测c-Myc蛋白表达。结果MEK抑制剂U0126增强了索拉非尼对K562细胞增殖抑制、促凋亡及诱导分化作用。两药联用显著下调K562细胞c-Myc蛋白水平。结论MEK抑制剂U0126增强索拉非尼对K562细胞增殖抑制、凋亡及诱导分化作用,这可能与其协同下调c-Myc蛋白有关。
索拉非尼; U0126; K562细胞; 细胞凋亡; c-Myc
慢性粒细胞白血病特征性的分子生物学异常为BCR-ABL融合基因,其编码的BCR-ABL蛋白可持续活化多条同细胞增殖有关的信号通路分子。尽管伊马替尼治疗慢性粒细胞白血病疗效显著,但是还有部分病人出现伊马替尼耐药,尤其是在慢性粒细胞白血病加速期。因此,克服伊马替尼耐药成为亟待解决的问题。阻断BCR-ABL活化的下游信号为当前克服伊马替尼耐药的热点研究之一。索拉非尼(sorafeinb) 为多靶点抗肿瘤药物,最初设计为Raf(丝裂原活化蛋白激酶信号转导的关键调节者)激酶抑制剂,后来研究发现其能同时抑制其它多种酪氨酸激酶,如血管内皮生长因子、血小板衍化生长因子、受体酪氨酸激酶c-Kit、Fms样酪氨酸激酶等多种受体酪氨酸激酶[1]。U0126为MEK激酶抑制剂,特异性抑制MEKK1激活,抑制MAPKs级联反应。本研究以U0126联合索拉非尼作用于体外培养的BCR-ABL阳性人慢性粒细胞白血病K562细胞株,探讨U0126是否增强索拉非尼对K562细胞的增殖抑制、凋亡及分化诱导作用。
材 料 和 方 法
1材料
索拉非尼购于拜耳医药公司;U0126购于Alexis;小牛血清购于杭州四季青公司;逆转录试剂盒购于Fermentas;Trizol试剂为Invitrogen产品;RPMI-1640培养基、CCK-8细胞毒力和细胞活性检测试剂盒、细胞周期试剂盒均购于南京凯基生物发展有限公司;Hoechst 33342购于Sigma;鼠抗GAPDH和兔抗c-Myc单克隆抗体购自Cell Signaling Technology。
2方法
2.1细胞培养 K562、U937细胞株为中山大学附属第三医院中心实验室保留。使用添加10%小牛血清的RPMI-1640培养基培养,置于37 ℃、5%CO2孵育箱内。根据细胞生长情况,每天换液1次,取对数生长期细胞进行实验。
2.2PCR法检测b3a2BCR-ABL融合基因 对K562细胞BCR-ABL融合基因进行检测,并以U937细胞株作为阴性对照。应用Trizol试剂提取K562和U937细胞总RNA,核酸蛋白分析仪检测含量。0.5 μg总RNA按逆转录试剂盒说明逆转录为cDNA。b3a2BCR-ABL上游引物5’-GGAGCTGCAGATGCTGACCAAC-3’,下游引物5’-TCAGACCCTGAGGCCCTGAGGCTCAAAGTC-3’,扩增产物的长度为200bp。β-actin上游引物5’- TCACCCACACTGTGCCCATCTACGA-3’,下游引物5’- CAGCGGAACCGCTCATTGCCAATGG -3’,扩增产物的长度为294 bp。PCR扩增条件:PCR热循环仪中,94 ℃预变性5 min,然后94 ℃ 45 s,58 ℃ 45 s,72 ℃ 45 s,扩增30个循环,最后72 ℃ 10 min。琼脂糖凝胶电泳观察结果。
2.3CCK-8法测定细胞增殖抑制率 取对数生长期的K562细胞,1×104cells/well接种于96孔板,每孔体积100 μL。置于37 ℃、5%CO2孵育箱内培养12 h后,空白对照组以不含索拉非尼的培养基常规培养,实验组以含不同浓度的索拉非尼、U0126及不同浓度索拉非尼联合10 μmol/L U0126培养,并设3个复孔。培养48 h后,每孔加入CCK-8溶液10 μL,37 ℃、5%CO2孵育箱内继续培养4 h后终止。用酶联免疫检测仪在450 nm波长处测定吸其光(A值),增殖抑制率=(1-实验组A值/对照组A值)×100%。
2.4PI单染法检测细胞周期及凋亡 K562细胞以 1×106cells/well,每孔体积2 mL接种于12孔板,实验组以含不同浓度的索拉非尼或是联合10 μmol/L U0126的培养基培养。48 h后收集细胞,PBS洗涤2次,缓慢滴入1 mL 70%预冷的乙醇固定过夜,第2 d检测前离心除去乙醇,500 μL PBS重悬,加入RNase至终浓度为100 mg/L,37 ℃水浴30 min,加入PI染液至终浓度为50 mg/L,4 ℃避光染色30 min,流式细胞仪检测,记录激发波长为488 nm的红色荧光,结果用细胞周期拟合软件进行分析,记录亚二倍体峰,即凋亡细胞峰sub-G1期、G0/G1期、S期、G2/M期细胞比例,实验重复3次。
2.5Hoechst 33342染色观察K562细胞凋亡形态 K562细胞以1×106cells/well,每孔体积3 mL接种于6孔板,分别用5 μmol/L索拉非尼、10 μmol/L U0126及5 μmol/L索拉非尼联合10 μmol/L U0126培养,并设置空白对照,48 h后加入Hoechst 33342,使其终浓度为10 mg/L,培养箱内继续孵育30 min后收集细胞,避光。PBS洗涤后以甲醛固定,并调整细胞浓度为2×109cells/L,将细胞悬液滴于载玻片,加盖盖玻片,稍干燥后用有紫外光的荧光显微镜观察,正常活细胞体积较大、形态完整、染色均一、蓝色荧光相对较弱,凋亡细胞体积变小、核固缩、核裂解、形状不规则、荧光强度增强,每个样品计数200个细胞,计出凋亡细胞百分数,实验重复3次。
2.6联苯胺染色检测K562细胞向红系方向分化 K562细胞以1×109cells/L,每孔体积5 mL接种于6孔板,分别用5 μmol/L索拉非尼、10 μmol/L U0126及5 μmol/L索拉非尼联合10 μmol/L U0126培养,并设置空白对照,48 h后收集细胞,PBS洗涤并调整细胞浓度为2×109cells/L,取出50 μL。0.5 mol/L冰乙酸配置的0.2%(W/V)联苯胺液0.5 mL加入30 μL H2O2混匀后取出10 μL加入到细胞中,2 min后加入5%(W/V)亚硝基铁氰化钠1 μL摇匀,室温避光放置10 min,5 min内显微镜拍摄观察,计数200个细胞,染为蓝色的即是联苯胺阳性细胞,提示药物诱导K562细胞合成血红蛋白,向红系分化,未染色的为阴性细胞,求联苯胺染色阳性细胞率,实验重复3次。
2.7Western blotting法检测c-Myc蛋白 K562细胞以1×109cells/L,每孔体积2 mL接种于6孔板,以含不同浓度索拉非尼或联合10 μmoL/L的U0126的培养基培养,并设空白对照。48 h后收集细胞,冰上裂解,静置10 min后以12 000 r/min 4 ℃离心20 min,取上清。制作蛋白标准曲线后测定样品蛋白实际浓度,置于-80 ℃。固定好电泳装置,灌制分离胶及浓缩胶,凝固后,将电泳装置放入装有电泳液的槽中,取40 μg的样品加入6×SDS上样缓冲液后沸煮5 min,冷却后于上样孔加样。加样完毕后,电泳至溴酚蓝线到达浓缩胶最下缘结束。根据蛋白分子量切取合适大小的分离胶及PV膜于转膜液中进行转膜。转膜完毕后,室温下以5%牛血清蛋白封闭1 h。膜与Ⅰ抗(1∶1 000)4 ℃孵育过夜,Ⅱ抗室温下孵育1 h,化学发光,X胶片显影,扫描后用Quantity One软件分析。
3统计学处理
结 果
1K562细胞BCR-ABL融合基因的鉴定
PCR法显示K562细胞为b3a2BCR-ABL阳性细胞株,BCR-ABL有多连接方式,最常见的为b3a2型,该基因经转录后翻译成相对分子量为210 kD的蛋白质,即P210BCR-ABL。对照组U937细胞则不表达BCR-ABL融合基因,见图1。

Figure 1.Detection of b3a2 BCR-ABL in K562 cell line by PCR.
2U0126增强索拉非尼对K562细胞株的增殖抑制作用
CCK-8检测结果显示索拉非尼单药对K562细胞具有增殖抑制作用,并呈现出浓度依赖性,48 h索拉非尼作用于K562细胞的IC50浓度为14.02 μmol/L,U0126单用增殖抑制趋势不明显。索拉非尼5 μmol/L、7.5 μmol/L、10 μmol/L、12.5 μmol/L联合10 μmol/L的U0126后,K562细胞增殖抑制率明显高于索拉非尼单用(Plt;0.01),见图2。
3U0126增强索拉非尼对K562细胞株的诱导凋亡作用
选择小于IC50浓度的索拉非尼观察单用及联合U0126作用K562细胞的效果。PI单染法测定药物作用后Sub-G1细胞比例,即凋亡细胞比例。结果显示10 μmol/L索拉非尼联合10 μmol/L U0126作用K562细胞48 h后,细胞凋亡率明显高于索拉非尼、U0126单用(Plt;0.01),见图3。Hoechst 33342染色法观察10 μmol/L索拉非尼联合10 μmol/L U0126作用K562细胞48 h后,核固缩和核碎裂阳性细胞比例明显高于索拉非尼、U0126单用(Plt;0.01),见图4,从形态学上证实了U0126增强了索拉非尼对K562细胞的诱导凋亡作用。
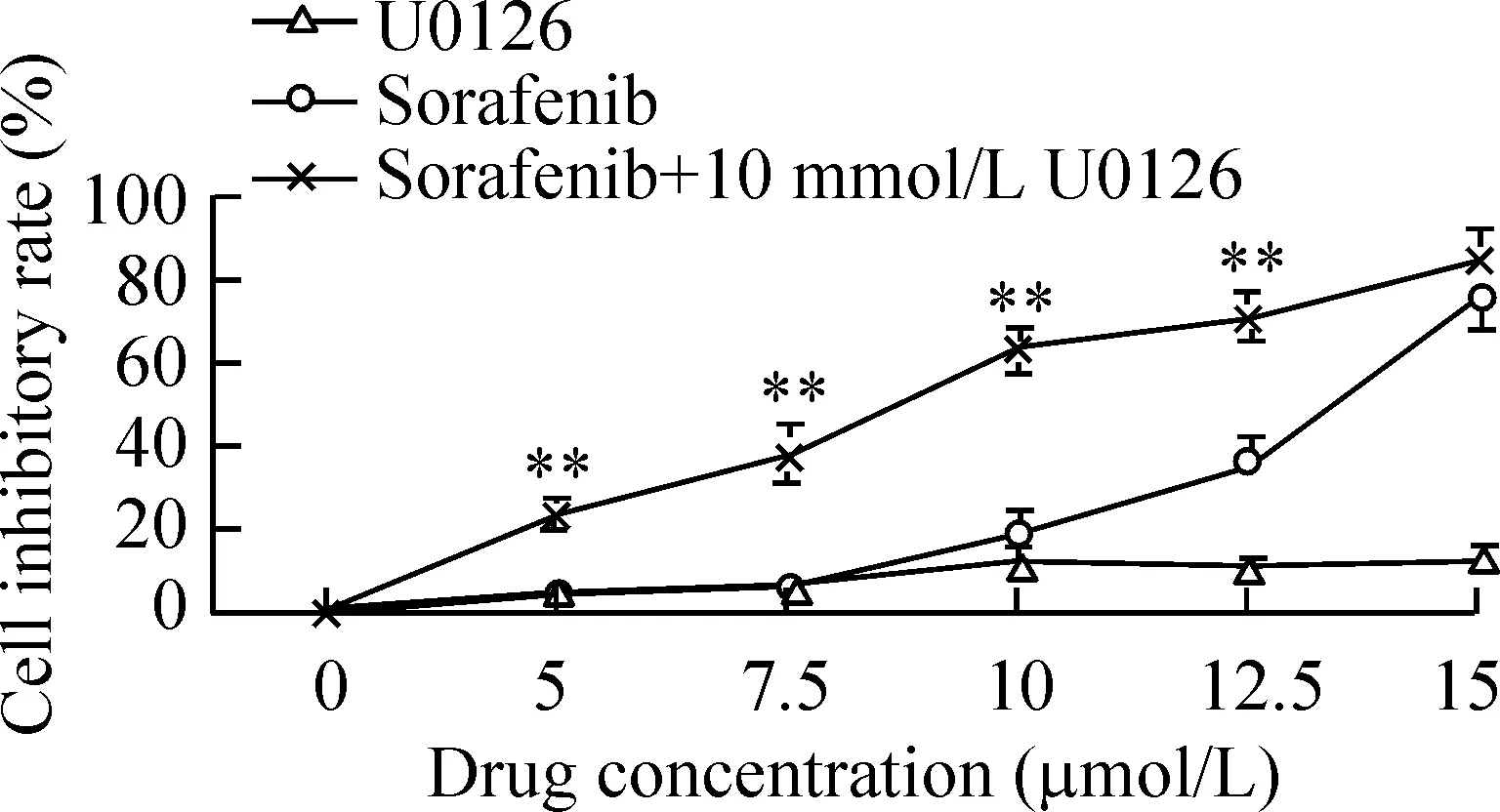
Figure 2.Growth inhibitory effect of sorafenib,U0126 or sorafenib combined 10 μmol/L U0126 on K562 cells for 48 h±s.n=3.**Plt;0.01 vs sorafenib.
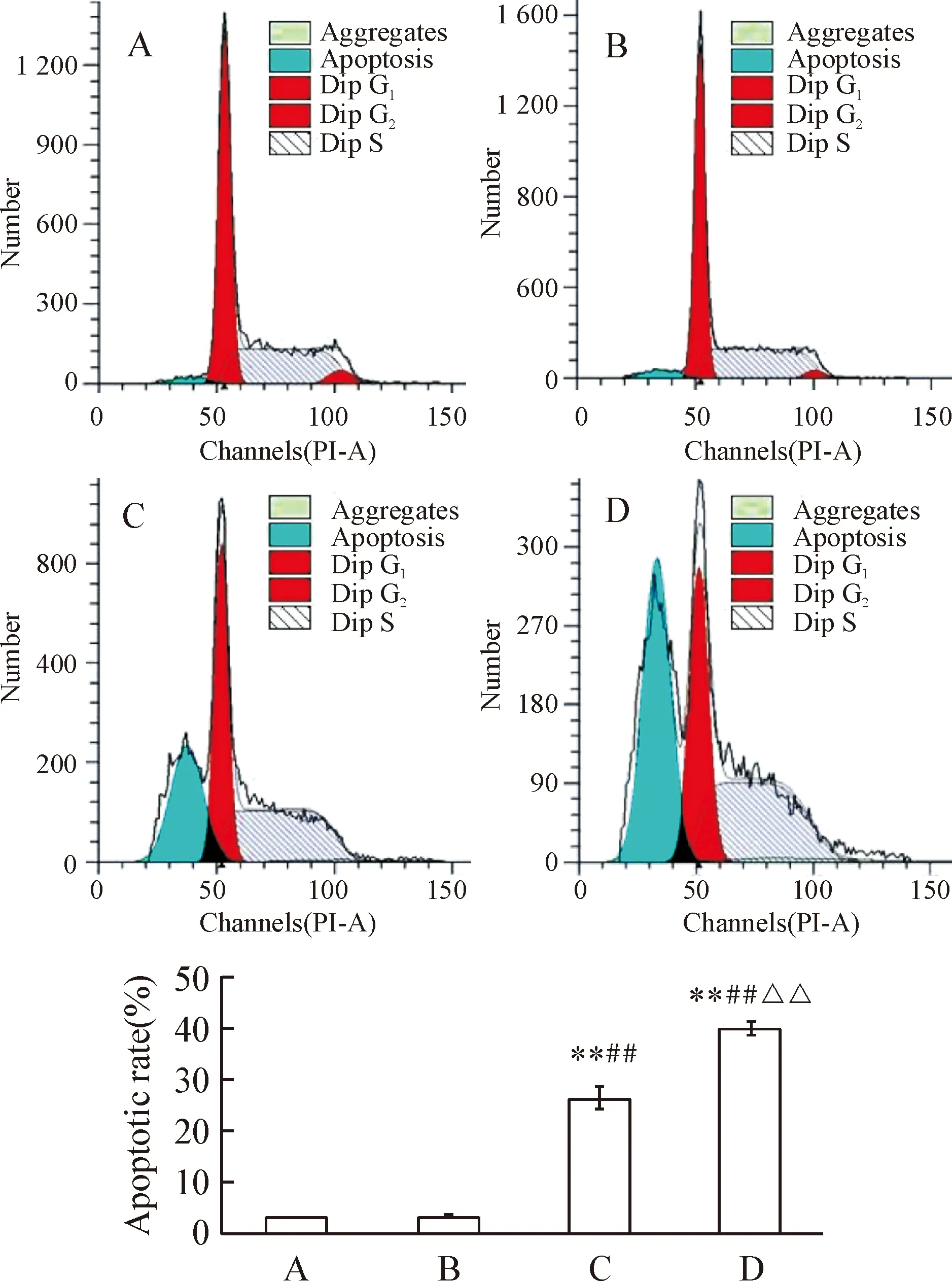
Figure 3.The apoptotic rate of K562 cells was determined with PI staining after exposure to indicated drugs for 48 h.A:control;B:U0126(10 μmol/L);C:sorafenib(10 μmol/L);D:U0126(10 μmol/L)+sorafenib(10 μmol/L).±s.n=3.**Plt;0.01 vs control;##Plt;0.01 vs U0126;△△Plt;0.01 vs sorafenib.
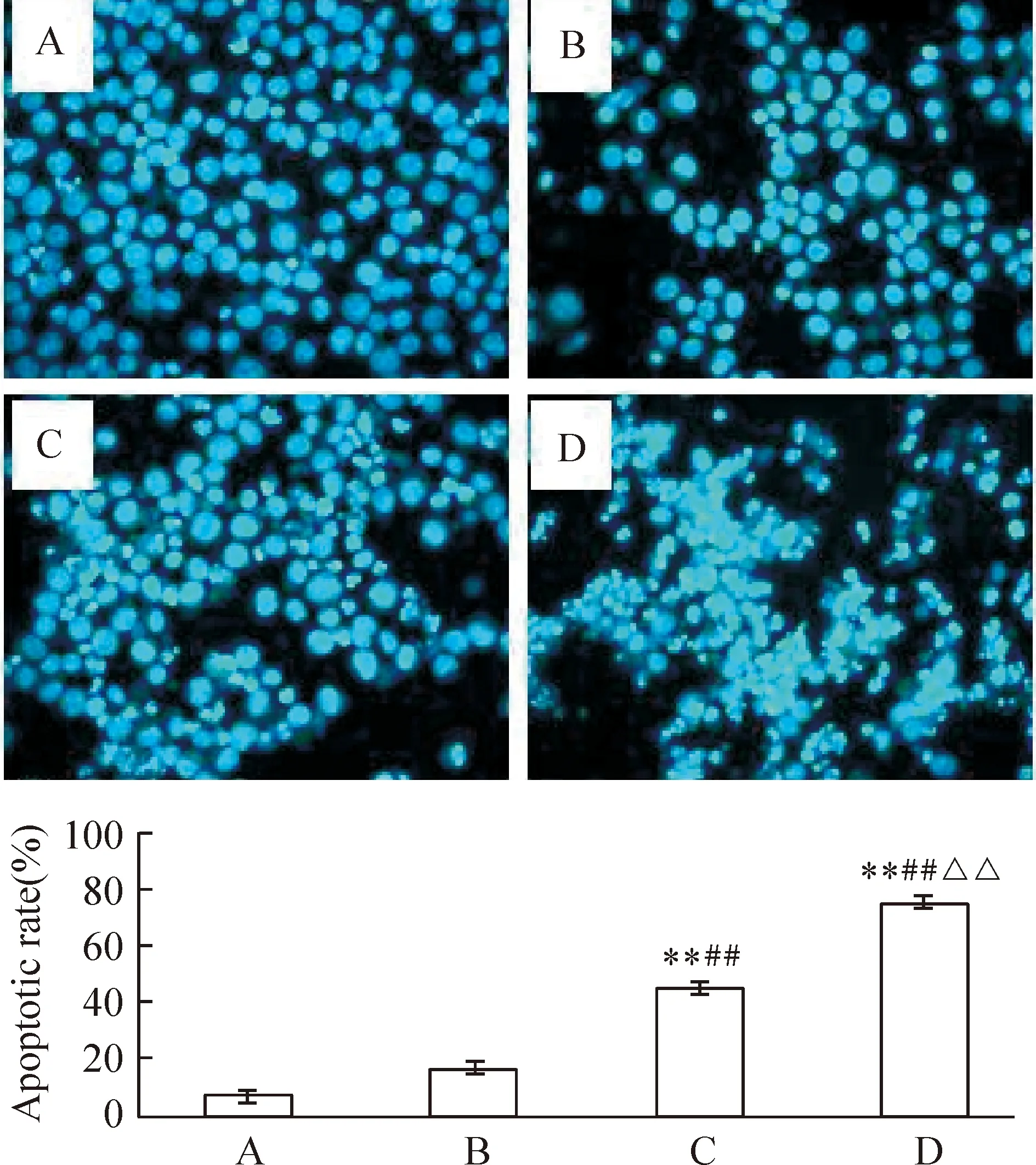
Figure 4.K562 cells were stained with Hoechst 33342 to identify condensed apoptotic nuclei after exposure to indicated drugs for 48 h.A:control;B:U0126(10 μmol/L);C:sorafenib(10 μmol/L);D:U0126(10 μmol/L)+sorafenib(10 μmol/L).±s.n=3.**Plt;0.01 vs control;##Plt;0.01 vs U0126;△△Plt;0.01 vs sorafenib.
4U0126增强索拉非尼对K562细胞株的周期及诱导分化影响
索拉非尼5 μmol/L、U0126 10 μmol/L单用及联合作用K562细胞48 h后,细胞周期分析结果显示:5 μmol/L索拉非尼联合10 μmol/L U0126组G0/G1期细胞比例(62.22%±2.88%)高于对照(46.14%±2.38%)、索拉非尼(47.20%±1.15%)及U0126(42.00%±1.84%)单用,而两药联合S期细胞比例(37.38%±2.75%)低于对照(47.27%±2.63%)、索拉非尼(48.29%±0.92%)及U0126(55.85%±1.86%)单用(Plt;0.05),见表1,提示两药联合较单药引起更明显的G0/G1期阻滞,K562细胞分裂及增殖活性降低,在G0/G1检测点聚集最终走向分化或者凋亡。而5 μmol/L索拉非尼联合10 μmol/L U0126未导致明显凋亡,说明低浓度索拉非尼联合U0126主要以诱导肿瘤细胞分化为主。联苯胺染色证实U0126联合低浓度索拉非尼更明显地促进K562细胞产生血红蛋白并向红系方向分化,联苯胺染色阳性率上升(Plt;0.05),见图5。
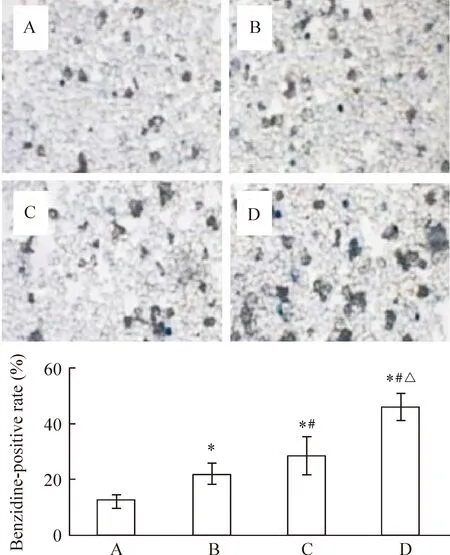
Figure 5.K562 cells were stained with benzidine after exposured to lower concentrations of sorafenib,U0126 or combination of both for 48 h.A:control;B:U0126(10 μmol/L);C:sorafenib(5 μmol/L);D:U0126(10 μmol/L)+sorafenib(5 μmol/L).*Plt;0.05 vs control;#Plt;0.05 vs U0126;△Plt;0.05 vs sorafenib.
5索拉非尼联合U0126显著下调c-Myc蛋白水平
Western blotting法显示索拉非尼联用U0126作用48 h后,c-Myc蛋白水平较之索拉非尼、U0126单用明显降低(Plt;0.05),见图6,提示U0126增强索拉非尼对K562细胞增殖抑制、凋亡及分化诱导作用可能与其协同下调c-Myc蛋白有关。
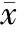
表1 索拉非尼、U0126单药及联合作用于K562细胞48 h后细胞周期分布
Figure 6.Western blotting analysis of c-Myc protein expression in K562 cells treated with sorafenib,U0126 or combination of both for 48 h.*Plt;0.05 vs control;#Plt;0.05 vs U0126;△Plt;0.05 vs sorafenib.
讨 论
慢性粒细胞白血病(CML)起源于造血干细胞的致癌性转变,其标志性的遗传学异常为t(9;22)(q34;q11)染色体易位,此易位形成了BCR-ABL融合基因,编码BCR-ABL融合蛋白。BCR-ABL融合蛋白具有组成性酪氨酸激酶活性,可活化一系列胞内信号通路并激活RAS、PI3K、AKT、JNK、SRC家族激酶及各自的下游靶点,如转录因子STATs、NF-κB、Myc等[2]。伊马替尼可有效抑制P210 BCR-ABL融合蛋白,诱导95%慢性期CML患者血液学的完全缓解,尽管如此,患者骨髓中仍持续产生BCR-ABL基因转录产物。另外,还有部分病人出现伊马替尼耐药,尤其是在慢性粒细胞白血病加速期。伊马替尼耐药最主要的原因为ABL激酶区域的点突变改变了ATP口袋结构构象,影响了药物同其靶点结合[3]。当前,克服伊马替尼耐药的治疗策略包括运用第二代激酶抑制剂、造血干细胞移植及靶向BCR-ABL依赖的信号转导途径。异基因造血干细胞移植是唯一治愈CML的手段,但是大多数病人不适宜采用此种疗法,主要原因在于患者年龄过大难以耐受治疗带来的副反应或是缺乏合适的干细胞供者。第二代酪氨酸激酶抑制剂达沙替尼及尼诺替尼虽然能抑制大部分不同形式突变后的激酶活性,但其对T315I突变无效。因此,开发及研究以BCR-ABL活化的下游信号为靶点的药物具有潜在的前景,尤其是对T315I突变所致的耐药。
目前,较多研究证明多激酶抑制剂索拉非尼可在体外诱导多种白血病细胞株凋亡,包括BCR-ABL阳性的白血病细胞[4],抑制生存及增殖的机制包括阻断Raf/MEK/ERK通路,下调Mcl-1表达以及诱导内质网应激[4-6]。U0126为高效MEK激酶抑制剂,直接抑制ERK1/2上游激活物MEK蛋白的活性而抑制ERK磷酸化。有研究显示U0126联合伊马替尼协同诱导BCR-ABL阳性细胞株凋亡[7]。另外,其联合雷帕霉素、Bcl-2抑制剂GX15070可在体外诱导伊马替尼耐药细胞株凋亡[8]。
本实验中,U0126增强索拉非尼对K562细胞增殖抑制作用,低浓度索拉非尼联合U0126促进K562细胞向分化方向发展,而高浓度索拉非尼联合U0126诱导K562细胞凋亡。索拉非尼、U0126联用后c-Myc蛋白明显下调,提示U0126增强索拉非尼增殖抑制、诱导凋亡及分化的机制可能在于两药协同下调c-Myc蛋白。c-myc为细胞增殖调控的早期反应基因,其编码的c-Myc蛋白为一种转录因子。当细胞向分化方向发展时,c-Myc表达下调。染色体异位、点突变及上游调节因子缺乏可过度活化c-Myc导致细胞致癌性转变,促进白血病及一些实体肿瘤形成。慢性粒细胞白血病患者急性变时,常有c-Myc过表达[9]。BCR-ABL可通过其组成性活化胞内多种信号转导分子诱导c-Myc过表达。索拉非尼可能通过抑制多种细胞表面及细胞内激酶阻断BCR-ABL活化的生存信号下调c-myc基因表达,进而下调c-Myc蛋白。U0126通过抑制MEK蛋白减少活性形式的ERK蛋白产生,进而减少ERK磷酸化其下游靶点c-Myc,弱化其活化转录能力。两者联用协同下调了具有转录活性的c-Myc蛋白水平。另外,Myc蛋白可与Miz-1蛋白相互作用抑制P21的表达从而阻断P53诱导的细胞周期阻滞[10,11],索拉非尼可能通过下调c-Myc而稳定P21导致细胞周期阻滞,而U0126则刚好强化了此作用,促进K562向红系方向分化。因此,索拉非尼联合U0126则可能成为治疗伊马替尼耐药的CML的可行方案。
[1]肖若芝,何程明,王立琳,等.索拉非尼联合柔红霉素对白血病K562细胞抑制作用[J].中国病理生理杂志,2010,26 (7): 1356-1361.
[2]Ren R.Mechanisms of BCR-ABL in the pathogenesis of chronic myelogenous leukaemia[J].Nat Rev Cancer,2005,5(3):172-183.
[3]Azam M,Latek RR,Daley GQ.Mechanisms of autoinhibition and STI-571/imatinib resistance revealed by mutagenesis ofBCR-ABL[J].Cell,2003,112(6):831-843.
[4]Rahmani M,Nguyen TK,Dent P,et al.The multikinase inhibitor sorafenib induces apoptosis in highly imatinib mesylate-resistant Bcr/Abl+human leukemia cells in association with signal transducer and activator of transcription 5 inhibition and myeloid cell leukemia-1 down-regulation[J].Mol Pharmacol,2007,72(3):788-795.
[5]Wilhelm S,Carter C,Lynch M,et al.Discovery and development of sorafenib:a multikinase inhibitor for treating cancer[J].Nat Rev Drug Discov,2006,5(3):835-844.
[6]Zhang W,Konopleva M,Ruvolo VR,et al.Sorafenib induces apoptosis of AML cells via Bim-mediated activation of the intrinsic apoptotic pathway[J].Leukemia,2008,22(4):808-818.
[7]Yu C,Krystal G,Varticovksi L,et al.Pharmacologic mitogen-activated protein/extracellular signal-regulated kinase kinase/mitogen-activated protein kinase inhibitors interact synergistically with STI571 to induce apoptosis in Bcr/Abl-expressing human leukemia cells[J].Cancer Res,2002,62(1):188-199.
[8]Dong S,Kang S,Lonial S,et al.Targeting 14-3-3 sensitizes native and mutant BCR-ABL to inhibition with U0126,rapamycin and Bcl-2 inhibitor GX15-070[J].Leukemia,2008,22(3):572-577.
[9]Advani AS,Pendergast AM.Bcr-Ablvariants: biological and clinical aspects[J].Leuk Res,2002,26(8):713-720.
[10]Seoane J,Le HV,Massagué J.Myc suppression of the p21Cip1Cdk inhibitor influences the outcome of the p53 response to DNA damage[J].Nature,2002,419 (6908):729-734.
[11]Wu S,Cetinkaya C,Munoz-Alonso MJ,et al.Myc represses differentiation -inducedp21CIP1 expression via Miz-1-dependent interaction with thep21 core promoter[J].Oncogene,2003,22(3):351-360.
U0126enhancessorafenib-inducedproliferationinhibition,apoptosisanddifferentiationinK562cells
CHEN Yan1,2,XIAO Ruo-zhi1,2,WANG Li-lin1,2,HE Cheng-ming1,RUAN Xing-xing1,XIONG Mu-jun1,2,LIN Dong-jun1,2
(1DepartmentofHematology,TheThirdAffiliatedHospital,2InstituteofHematology,SunYat-senUniversity,Guangzhou510630,China.E-mail:E-mail:ruozhi_xiao@yahoo.com)
AIM: To observe the effects of sorafenib and sorafenib combined with an MEK kinase inhibitor U0126 on the proliferation,apoptosis and differentiation in human chronic myelogenous leukemia cell line K562.METHODSK562 cells were treated with different concentrations of sorafenib and U0126 or 10 μmol/L U0126 combined with different concentrations of sorafenib for 48 h.Cell inhibitory rate was determined by CCK-8 assay.Apoptosis analysis was conducted by Hoechst 33342 and PI staining.Cell cycle analysis and benzidine staining were used to confirm K562 cells towards erythroid differentiation.The protein expression of c-Myc was detected by Western blotting.RESULTSU0126 enhanced sorafenib-induced proliferation inhibition,apoptosis and differentiation in K562 cells.Sorafenib combined with U0126 remarkably reduced the protein level of c-Myc.CONCLUSIONU0126 synergistically enhances sorafenib-induced proliferation inhibition,apoptosis and differentiation in K562 cells through reducing c-Myc protein level.
Sorafenib; U0126; K562 cells; Apoptosis; c-Myc
1000-4718(2011)05-0859-06
R733.7
A
10.3969/j.issn.1000-4718.2011.05.006
2010-11-30
2011-03-21
广东省科技计划资助项目 (No.2006B35501008)
△通讯作者Tel: 020-85252227; E-mail: ruozhi_xiao@yahoo.com
