AFP-L3阳性肝细胞癌患者肿瘤分期和外周血淋巴细胞亚群的研究*
2011-11-20廖慧芳黎东明沈顺利彭宝岗
陈 斌, 廖慧芳, 黎东明, 周 奇, 匡 铭, 沈顺利, 彭宝岗△
(中山大学附属第一医院 1肝胆外科, 2检验科, 广东 广州 510080)
AFP-L3阳性肝细胞癌患者肿瘤分期和外周血淋巴细胞亚群的研究*
陈 斌1, 廖慧芳2, 黎东明1, 周 奇1, 匡 铭1, 沈顺利1, 彭宝岗1△
(中山大学附属第一医院1肝胆外科,2检验科, 广东 广州 510080)
目的: 分析小扁豆凝素结合型甲胎蛋白(AFP-L3)阳性的肝细胞癌患者肿瘤分期及外周血淋巴细胞的改变,探讨AFP-L3水平与肿瘤分期及免疫状态的关系。方法采集60例肝细胞癌患者外周血,检测AFP及AFP-L3含量。根据外周血AFP-L3比例将60例原发性肝细胞癌患者分为2组:AFP-L3(+)组和AFP-L3(-)组。流式细胞术检测外周血中各淋巴细胞亚群(NK、CD4+、CD8+、CD4/CD8、Treg)的比例。结果AFP-L3(+)组患者UICC分期Ⅲ+Ⅳ期为29例,AFP-L3(-)组为7例;AFP-L3(+)组患者BCLC分期C+D期为20例,AFP-L3(-)组为3例。AFP-L3(+)组患者发生血管侵犯为17例,远高于AFP-L3(-)组(1例)。AFP-L3(+)组患者外周血中NK细胞比例及CD4/CD8比值下降,CD8+T和Treg细胞显著比例上升。结论外周血AFP-L3阳性的肝癌患者容易发生血管侵犯,且分期较差,可能与淋巴细胞亚群发生变化、免疫系统受到抑制有关。
肝细胞癌; 小扁豆凝集素结合型甲胎蛋白; 肿瘤分期; 淋巴细胞亚群
肝细胞癌(hepatocellular carcinoma,HCC)的发病率在我国居恶性肿瘤发病率的第2位。外科手术切除、局部消融和肝移植是目前能够使肝癌获得根治的措施,但是多数患者诊断时已届入中晚期,总体手术切除率不足30%[1]。因此早期诊断对于提高肝癌的总体疗效具有重要意义。
甲胎蛋白(alpha-fetoprotein,AFP)是当前普遍用于肝癌早期诊断的肿瘤标记物。近年来,研究发现AFP存在多种异质体,其中小扁豆凝集素结合型AFP(Lensculinarisagglutinin-reactive AFP,AFP-L3)被认为是原发性肝癌的特异性标记物,有助于肝癌的早期诊断。同时有研究提示AFP-L3和肝癌的恶性程度及预后有关,AFP-L3升高者肿瘤具有更强的侵袭性,预后较差,但具体原因不明[2-8]。本研究拟分析AFP-L3阳性肝细胞癌患者的肿瘤分期和外周血中淋巴细胞亚群变化特点,研究外周血AFP-L3水平与肿瘤分期以及机体的免疫状态间的关系,从免疫机制方面探讨AFP-L3阳性肝癌患者肿瘤恶性程度更高的原因。
材 料 和 方 法
1临床资料
选取2009年8月至2010年11月间于中山大学附属第一医院肝胆外科诊治的肝细胞癌患者共60例。男48例,女12例,年龄18-75岁。排除合并妊娠、自身免疫性疾病、糖尿病、营养不良及使用免疫抑制剂患者。所有患者均经病理确诊。
2临床分期
采用国际防癌联盟(UICC,第7版)肝癌TNM分期及巴塞罗那临床分期(BCLC)对所有入选的肝细胞癌病例进行分期。
3病例分组
入选的肝细胞癌病例分为2组:(1) AFP-L3(+)组: AFP-L3≥10%;(2) AFP-L3(-)组:AFP-L3lt;10%。
4主要试剂
AFP-L3亲和吸附离心管(产品编号YZB/国1343-2008)购自北京热景生物技术有限公司。单克隆抗体FITC-CD3、APC-CD56、PE-CD16、PE-CD3、FITC -CD4、APC-CD8、FITC -CD4、APC-CD25、PE-Foxp3及Human FoxP3 Buffer Set和Stain Buffer (FBS)均购自BD。Ficoll-Paque PLUS(编号:17-1440-02)淋巴细胞分离液购自GE Healthcare。
5方法
5.1AFP及AFP-L3的测定 按AFP-L3亲和吸附离心管操作说明书进行:患者取空腹静脉血,离心后取400 μL血清,以试剂盒所配的清洗液600 μL稀释后,加入亲和吸附离心管中,室温静置10 min,加入1.2 mL的清洗液清洗,3 000 r /min离心20 s。更换离心管外管,再加入600 μL试剂盒所配的洗脱液,3 000 r/min离心20 s,获得含有AFP-L3的洗脱液。将未稀释的血清及含有AFP-L3的洗脱液一起送检验科,以化学发光法检测AFP及AFP-L3的含量。AFP-L3含量×2.5即为血清中AFP-L3含量。AFP-L3比例=血清AFP-L3/总AFP。
5.2流式细胞术分析 用PBS按1∶1比例稀释静脉血,加到淋巴细胞分离液上层,淋巴细胞分离液和稀释静脉血比例为3∶4(按淋巴细胞分离液说明书),400×g离心30 min,获得外周血单个核细胞(PBMC)。PBS洗涤2次,计数,行台盼蓝实验证明细胞活性gt;95%。加入适当剂量的抗体染色后,以FACS 流式细胞仪检测外周血淋巴细胞亚群:NK细胞(CD3+CD16+CD56+)、CD4+细胞(CD3+CD4+)、CD8+细胞(CD3+CD8+)和Treg细胞 (CD4+CD25+Foxp3+)。
6统计学处理
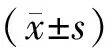
结 果
1AFP-L3阳性组的患者较AFP-L3阴性的患者肿瘤更容易发生血管侵犯
AFP-L3(+)组(n=35)和AFP-L3(-)组(n=25)肿瘤发生血管侵犯、胆管侵犯、淋巴结转移、邻近器官侵犯、远处转移、合并肝内转移的例数和比例分别为17例(48.57%)vs1例(4.00%)、1例(2.86%)vs2例(8.00%)、0例(0%)vs2例(8.00%)、4例(11.43%)vs2例(8.00%)、2例(5.71%)vs0例(0.00%)、17例(48.57%)vs6例(24.00%)。各组间比较结果提示AFP-L3升高的患者更容易发生血管侵犯(Plt;0.01),见表1。而胆管侵犯、淋巴结转移、邻近器官侵犯、远处转移等特征组间均无明显差异(Pgt;0.05)。虽然AFP-L3(+)组肝内转移发生率高于AFP-L3(-)组,但亦无明显差异(Pgt;0.05),见表1。
2AFP-L3阳性组患者肿瘤分期较差
按UICC发表的第7版肝癌TNM分期方法对所有病例进行分期。AFP-L3(+)组35例患者中Ⅰ+Ⅱ期6例(17.14%),Ⅲ+Ⅳ期29例(82.86%)。AFP-L3(-)组25例患者中Ⅰ+Ⅱ期18例(72.00%),Ⅲ+Ⅳ期7例(28.00%)。AFP-L3(+)组Ⅲ+Ⅳ期比例高于AFP-L3(-)组(Plt;0.01),见表2。

表1 AFP-L3阳性和阴性肿瘤临床特征的比较
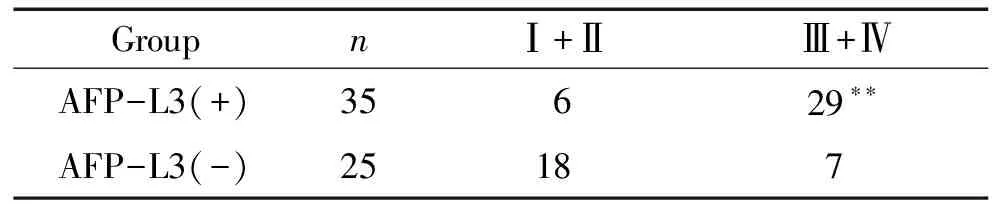
表2 AFP-L3阳性和阴性组肿瘤分期的比较(UICC)
按BCLC方法对所有病例进行分期。AFP-L3(+)组35例患者中A+B期15例(42.86%),C+D期20例(57.14%)。AFP-L3(-)组25例患者中A+B期22例(88.00%),C+D期3例(12.00%)。AFP-L3(+)组C+D期比例高于AFP-L3(-)组(Plt;0.01),见表3。

表3 AFP-L3阳性和阴性肿瘤按BCLC分期的比较
3AFP-L3阳性组患者外周血中NK细胞比例和CD4/CD8比值降低,CD8+细胞和Treg细胞比例上升
AFP-L3(+)组患者外周血中NK细胞占外周血淋巴细胞比例较AFP-L3(-)组显著降低(Plt;0.05),见表4、图1,分别为(10.56±8.35)%vs(15.59±9.78)%。AFP-L3(+)组和AFP-L3(-)组患者外周血中CD4+细胞、CD8+细胞占外周血淋巴细胞的比例分别为(32.84±9.46)%vs(37.61±9.38)%、(25.48±10.24)%vs(18.55±8.35)%,CD4/CD8比值分别为1.63±1.19vs2.44±1.29。AFP-L3(+)组CD4+细胞比例减少,但与AFP-L3(-)组相比无显著差异(Pgt;0.05),CD8+细胞显著比例升高(Plt;0.01),CD4/CD8比值显著升高(Plt;0.01),见表4、图2。此外,两组外周血中Treg细胞占CD4+细胞比例分别为(9.27±2.95)%和(7.20±1.09)%,AFP-L3(+)组Treg细胞比例明显升高(Plt;0.01),见表4、图3。
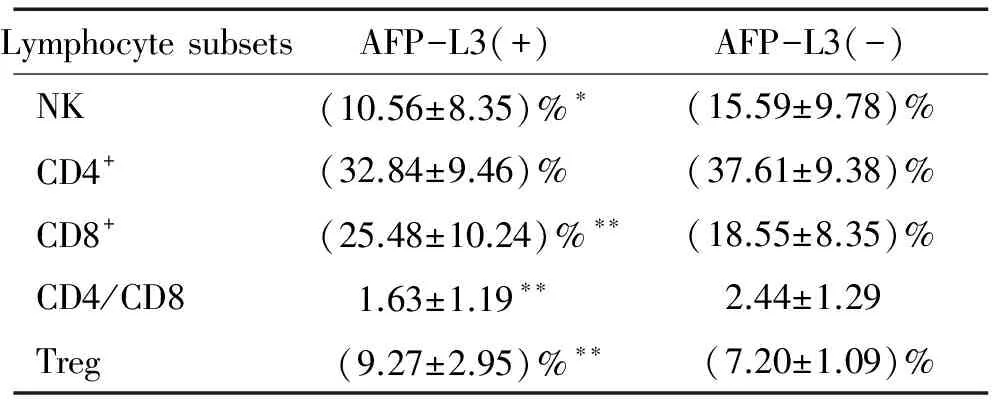
表4 AFP-L3阳性和阴性患者外周血淋巴细胞亚群的比较
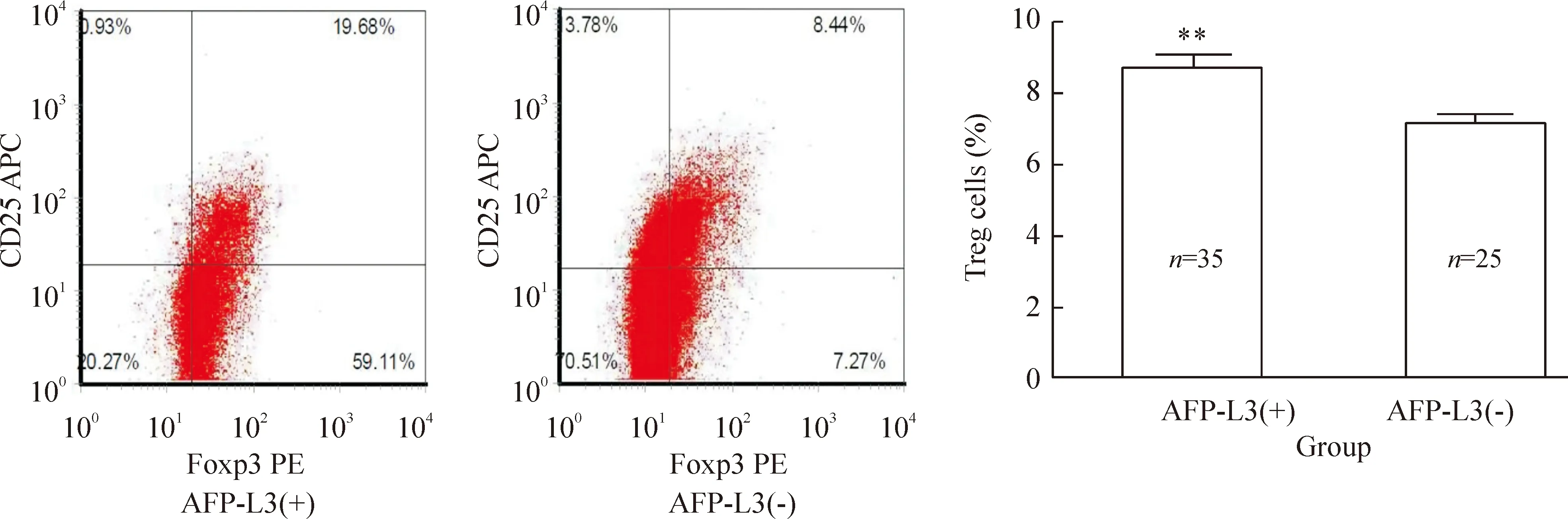
Figure 3.Treg cells in peripheral blood of patients in AFP-L3(+) group and AFP-L3(-) group.±s.**Plt;0.01 vs AFP-L3(-).
讨 论
AFP很早就作为肝癌的筛查和诊断的指标。近年来,研究者发现多种AFP异质体,其中AFP-L3是原发性肝癌的特异性指标,能够早期诊断肝癌,甚至可以早于影像学检查[2,3],且和肝癌的恶性程度及预后有联系。AFP-L3水平升高者多伴有肿瘤分化偏低、更容易发生门静脉侵犯的特征,但与肿瘤的大小和AFP水平无关。AFP-L3阳性的肿瘤更具侵袭性,且AFP-L3水平与静脉侵犯呈正相关[4-6]。此外,AFP-L3还是行TACE和消融治疗的预后指标,AFP-L3阳性患者TACE治疗后2年生存率明显低于AFP-L3阴性患者( 21.2%vs78.6%)[7],而AFP-L3阳性患者消融治疗后5年生存率由62.9%下降至50.0%[8]。我们通过对临床资料分析发现,AFP-L3阳性患者肿瘤无论按照UICC还是BCLC分期,分期均较AFP-L3阴性的患者更差,更容易产生血管侵犯和肝内转移,说明AFP-L3阳性的肿瘤更具侵袭性,与之前其它报道结果一致。
免疫耐受和免疫抑制是机体不能产生有效抗肿瘤免疫反应、肿瘤无限制增殖并发生转移的重要原因,影响着肿瘤的发展和生物学特性,也影响着肿瘤的治疗效果[9]。肝癌可以诱发机体免疫抑制状态,如外周血中CD3+和CD4+细胞数目下降,CD4/CD8比值下降[10];而外周血以及肿瘤组织的Treg增加也严重地影响了机体抗肿瘤免疫效应[11]。肿瘤诱发的机体免疫耐受状态和微环境紊乱使得机体产生的抗肿瘤免疫效应不能有效地控制肝癌的进展。
本研究提示AFP-L3阳性肝细胞癌患者的外周血淋巴细胞亚群紊乱和肝癌侵袭性有一定关系。AFP-L3阳性肝细胞癌患者外周血NK细胞比例下降,CD8+淋巴细胞比例上升,CD4/CD8比值下降,Treg比例上升。NK细胞是和T细胞、B细胞不同的免疫细胞,为非特异性杀伤细胞,在肿瘤免疫中起重要作用。进展期肝癌的可溶性MHCⅠ抗原可以影响NK细胞的功能[12],致使外周血和局部的NK细胞比例和功能都有所下降[13]。动物实验显示激活NK细胞可以延缓肿瘤的发展[14]。我们发现AFP-L3阳性的患者外周血中NK细胞占外周血淋巴细胞比例明显降低,肿瘤恶性程度更高。CD4+和CD8+淋巴细胞在细胞介导的抗肿瘤免疫反应中发挥重要作用[15,16]。而调节性T淋巴细胞(Treg)是一种有负性调节作用的CD4+淋巴细胞亚群,可以抑制机体的抗肿瘤免疫,清除或抑制Treg后具有抑制肿瘤生长的作用[17]。本研究中AFP-L3阳性患者外周血中NK细胞比例以及CD4/CD8比值下降提示各淋巴细胞亚群的比例失衡,患者抗肿瘤免疫反应受到抑制。肿瘤有可能通过上调Treg细胞、下调NK细胞抑制了机体的抗肿瘤免疫反应。虽然CD8+T细胞比例有所上升,但Treg细胞的上调有可能对其杀伤能力产生了抑制,从而使其抗肿瘤作用减弱。
[1]Bruix J,Sherman M.Management of hepatocellular carcinoma[J].Hepatology,2005,42(5): 1208-1236.
[2]Taketa K,Endo Y,Sekiya C,et al.A collaborative study for the evaluation of lectin-reactive α-fetoproteins in early detection of hepatocellular carcinoma[J].Cancer Res,1993,53(22):5419-5423.
[3]Oka H,Saito A,Ito K,et al.Multicenter prospective analysis of newly diagnosed hepatocellular carcinoma with respect to the percentage of AFP-L3[J].J Gastroenterol Hepatol,2001,16(12):1378-1383.
[4]Okuda H,Nakanishi T,Takatsu K,et al.Clinicopathologic features of patients with hepatocellular carcinoma seropositive for α-fetoprotein-L3 and seronegative for des- γ-carboxy prothrombin in comparison with those seropositive for des-γ-carboxy prothrombin alone[J].J Gastroenterol Hepatol,2002,17(7):772-778.
[5]Hagiwara S,Kudo M,Kawasaki T,et al.Prognostic factors for portal venous invasion in patients with hepatocellular carcinoma[J].J Gastroenterol,2006,41(12):1214-1219.
[6]Carr BI,Kanke F,Wise M,et al.Clinical evaluation of lens culinaris agglutinin-reactive alpha-fetoprotein and des-gamma-carboxy prothrombin in histologically proven hepatocellular carcinoma in the United States[J].Dig Dis Sci,2007,52(3):776-782.
[7]Song BC,Suh DJ,Yang SH,et al.Lens culinaris agglutinin-reactive alpha-fetoprotein as a prognostic marker in patients with hepatocellular carcinoma undergoing transcatheter arterial chemoembolization[J].J Clin Gastroenterol,2002,35(5):398-402.
[8]Toyoda H,Kumada T,Kaneoka YJ,et al.Prognostic value of pretreatment levels of tumor markers for hepatocellular carcinoma on survival after curative treatment of patients with HCC[J].J Hepatol,2008,49(2):223-232.
[9]汪礼坤, 匡 铭, 彭宝岗, 等.Tregs调节小鼠肝癌局部引流淋巴结内免疫效应细胞的功能[J].中国病理生理杂志,2010,26(5):922-927.
[10]Attallah AM,Tabll AA,El-Sadany M,et al.Dysregulation of blood lymphocyte subsets and natural killer cells in schistosomal liver cirrhosis and hepatocellular carcinoma[J].Clin Exp Med,2003,3(3):181-185.
[11]Ormandy LA,Hillemann T,Wedemeyer H,et al.Increased populations of regulatory T cells in peripheral blood of patients with hepatocellular carcinoma[J].Cancer Res,2005,65(6):2457-2464.
[12]Jinushi M,Takehara T,Tatsumi T,et al.Impairment of natural killer cell and dendritic cell functions by the soluble form of MHC class I-related chain A in advanced human hepatocellular carcinomas[J].J Hepatol,2005,43(6):1013-1020.
[13]Cai L,Zhang Z,Zhou L,et al.Functional impairment in circulating and intrahepatic NK cells and relative mechanism in hepatocellular carcinoma patients[J].Clin Immunol,2008,129(3):428-437.
[14]Elinav E,Abd-Elnabi A,Pappo O,et al.Suppression of hepatocellular carcinoma growth in mice via leptin,is associated with inhibition of tumor cell growth and natural killer cell activation[J].J Hepatol,2006,44(3):529-536.
[15]Mumber GD,Monach PA,Wanderling S,et al.CD4+T cells eliminate MHC class II-negative cancer cellsinvivoby indirect effects of IFN-γ[J].Proc Natl Acad Sci USA,1999,96(15): 8633-8638.
[16]Bricard G,Bouzourene H,Martinet O,et al.Naturally acquired MAGE-A10- and SSX-2-specific CD8+T cell responses in patients with hepatocellular carcinoma[J].J Immunol,2005,174(3): 1709-1716.
[17]Shen XH,Li N,Li H,et al.Increased prevalence of regulatory T cells in the tumor microenvironment and its correlation with TNM stage of hepatocellular carcinoma[J].J Cancer Res Clin Oncol,2010,136(11):1745-1754.
TumorstagesandperipheralbloodlymphocytesubsetsinpatientswithAFP-L3-positivehepatocellularcarcinoma
CHEN Bin1,LIAO Hui-fang2,LI Dong-ming1,ZHOU Qi1,KUANG Ming1,SHEN Shun-li1,PENG Bao-gang1
(1DepartmentofHepatobiliarySurgery,2ClinicalLaboratory,TheFirstAffiliateHospitalofSunYat-senUniversity,Guangzhou510080,China.E-mail:pengbaogang@medmail.com.cn)
AIM: To analyze the variations of tumor stages and peripheral blood lymphocyte subsets inLensculinarisagglutinin-reactive alpha-fetoprotein (AFP-L3) -positive hepatocellular carcinoma (HCC) and to explore the relationship between tumor stage,immune state and AFP-L3.METHODSPeripheral blood of sixty HCC patients was collected.The concentrations of AFP and AFP-L3 were detected.The patients were divided into 2 groups according to the expression of AFP-L3: AFP-L3 (+) group and AFP-L3 (-) group.The variations of T-lymphocyte subsets,natural killer T-cells (NK,CD3+CD16+CD56+),CD4+T-cells (CD3+CD4+),CD8+T-cells (CD3+CD8+),CD4/CD8 ratio and regulatory T-cells (Treg,CD4+CD25+Foxp3+),were analyzed by flow cytometry.RESULTSAccording to the International Union against Cancer (UICC) staging system,29 patients in AFP-L3 (+) group were in stage III and IV,while only 7 patients in AFP-L3 (-) group were in stage III and IV.According to the Barcelona Clinic Liver Cancer (BCLC) staging system,20 patients in AFP-L3 (+) group were in stage C and D,while only 3 patients in AFP-L3(-) group were in stage C and D.Seventeen patients in AFP-L3 (+) group suffered vascular invasion,significantly more than those in AFP-L3 (-) group.The percentage of NK cells and CD4/CD8 ratio decreased in AFP-L3 (+) group,while the percentages of CD8+and Treg cells significantly increased.CONCLUSIONThe AFP-L3 (+) patients have liability to vascular invasion and worse tumor stages,which may relate to variations of lymphocyte subsets and suppression of the immune system.
Hepatocellular carcinoma;Lensculinarisagglutinin-reactive alpha-fetoprotein; Tumor staging; Lymphocyte subsets
1000-4718(2011)05-0843-05
R735.7
A
10.3969/j.issn.1000-4718.2011.05.003
2011-03-09
2011-04-12
国家自然科学基金资助项目(No.81071892);广东省科技计划资助项目(No.2008B080703031;No.2010B031500026)
△通讯作者 Tel:020-87755766-8214;E-mail:pengbaogang@medmail.com.cn
