神经生长因子对肝星状细胞胶原分泌及形态学的影响*
2011-11-20舒建昌朱海燕何雅军陈莲香叶国荣
舒建昌, 朱海燕, 吕 霞, 何雅军, 陈莲香, 叶国荣
(暨南大学附属广州红十字会医院 消化内科,广东 广州 510220)
神经生长因子对肝星状细胞胶原分泌及形态学的影响*
舒建昌△, 朱海燕, 吕 霞, 何雅军, 陈莲香, 叶国荣
(暨南大学附属广州红十字会医院 消化内科,广东 广州 510220)
目的: 观察神经生长因子(NGF)对大鼠肝星状细胞(HSCs)胶原分泌功能和形态学的影响,探讨NGF抗肝纤维化的作用机制。方法大鼠肝星状细胞株(HSCs-T6)经不同浓度NGF作用24 h后,ELISA法检测上清液中Ⅰ、Ⅲ型胶原的含量;通过倒置显微镜、吖啶橙染色及透射电镜观察形态学变化。结果NGF作用HSCs 24 h后培养上清中Ⅰ、Ⅲ型胶原的含量与对照组相比明显减少(Plt;0.05),但无剂量依赖性。倒置显微镜下可见细胞数目变少,细胞变小,形态向椭圆形或圆形改变;吖啶橙染色及透射电镜可以见到细胞凋亡的形态学变化。结论NGF可抑制HSCs合成Ⅰ、Ⅲ型胶原,诱导HSCs凋亡,抑制HSCs胶原分泌,可能是NGF抗肝纤维化的作用机制。
肝星状细胞; 胶原; 形态学; 神经生长因子
肝星状细胞(hepatic stellate cells,HSCs)又名Ito细胞、窦周细胞等,其激活是肝纤维化发生的中心环节。活化的HSCs大量合成和分泌胶原等细胞外基质(extracellular matrix,ECM),由于细胞外基质的合成与降解失平衡,合成增多,降解减少,使大量细胞外基质沉积,最终引起肝纤维化、肝硬化。近年来神经生长因子(nerve growth factor,NGF)在肝纤维化中的作用越来越受到关注[1-3]。本研究观察了NGF对HSCs胶原分泌及形态学的影响,以帮助探讨NGF抗肝纤维化作用的机制。
材 料 和 方 法
1材料
NGF购自Ramp;D;吖啶橙购自Sigma;DMEM培养液、胎牛血清购自Gibco;ELx800酶标仪购自BioTek;LSM 510 META激光共聚焦显微镜购自Zeiss。HSCs - T6 由上海中医药大学徐列明教授提供,系SV40 转染的大鼠肝星状细胞,具有活化HSCs 的表型。
2方法
2.1NGF贮存液 NGF粉末用含0.1% BSA的无菌PBS溶解,配制成100 mg/L的贮存液,-20 ℃保存,1个月内有效。使用时用含10%血清的DMEM培养液稀释至所需浓度。
2.2细胞的培养与传代 采用含1×105U/L青霉素、1×105U/L链霉素、10 %胎牛血清的DMEM 培养液,在37 ℃、5 %CO2及饱和湿度下培养,隔天换液,待细胞长至80 %~90 %密度时,用0.02 %EDTA 和0.25 %胰蛋白酶消化, 按1∶4传代。
2.3Ⅰ、Ⅲ型胶原的检测 采用双抗夹心ELISA方法检测,取对数生长期细胞,以5×108/L细胞密度接种于T-25培养瓶中,24 h后各加入不同浓度(0、100、200、400 μg/L)的NGF培养24 h后,收集培养上清液,分别取已包被抗大鼠Ⅰ、Ⅲ型胶原单抗的96孔酶标板,每孔按照上清液编号分别加入100 μL上清液和100 μL标准品,37 ℃孵育60 min;每孔内加入350 μL洗涤液洗涤反应板,反复洗涤5次;每孔分别加入新鲜稀释的生物素化抗大鼠Ⅰ、Ⅲ型胶原,37 ℃孵育60 min;同上洗涤5次;每孔加入HRP稀释液,37 ℃孵育30 min;同上洗涤5次;再加入TMD显色液,37 ℃暗处孵育20 min;每孔加入终止液,轻轻混匀30 s,30 min内在450 nm处读取A值;以A值为纵坐标,以标准品浓度为横坐标,绘制标准曲线,根据培养液上清样品的A值在标准曲线上查出其浓度。
2.4吖啶橙染色 提前消毒6孔板及以多聚赖氨酸处理的盖玻片(面积约4 cm2),在6孔板每孔放置盖玻片1张。取对数生长期细胞,以7×107/L细胞密度滴加于提前处理好的置于6孔板内的盖玻片上,每孔滴加0.4 mL细胞悬液,培养箱中孵育24 h,以100 μg/L NGF为实验浓度作用于培养细胞,再培养24 h后,倒置显微镜下观察细胞形态学变化并拍照,每孔加入PBS洗涤玻片10 min×3次,加入4%多聚甲醛2 mL固定30 min,弃去固定液,每孔再加入蒸馏水洗涤玻片。精确称取吖啶橙10 mg,溶于100 mL三蒸水中,配制成100 g/L的吖啶橙染液,取染液2 mL将每张盖玻片浸泡染色7 min, 再于0.01 mol/L PBS中洗涤5 min×3次,直接在载玻片上封片,即在共聚焦显微镜下观察并拍照。
2.5透射电镜观察 取对数生长期细胞,将5×108/L细胞接种于T-25培养瓶中,取100 μg/L NGF作为实验浓度,与HSCs共同孵育24 h后,收集悬浮与贴壁细胞,1 000 r/min离心5 min,0.01 mol/L PBS重悬细胞,2.5%戊二醛固定15 min,1%四氧化锇固定30 min,常规电镜样品制备程序脱水、包埋、超薄切片和铀铅染色,透射电镜观察并照相。
3统计学处理
结 果
1HSCs分泌Ⅰ、Ⅲ型胶原的检测结果
各浓度NGF对HSCs合成Ⅰ、Ⅲ型胶原均有抑制作用(Plt;0.05),但各浓度间无显著差异(Pgt;0.05),见表1。
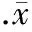
表1 不同浓度NGF对HSCs合成Ⅰ、Ⅲ型胶原的影响
2倒置显微镜观察结果
倒置显微镜下,可见对照组HSCs呈梭形、星形或形态不规则,胞体近中央处有椭圆形的胞核,呈成纤维细胞样表型。而100 μg/L NGF与HSCs作用24 h后,倒置显微镜下可见细胞增殖减慢,细胞数量变少,细胞体积变小,部分细胞脱落,见图1。
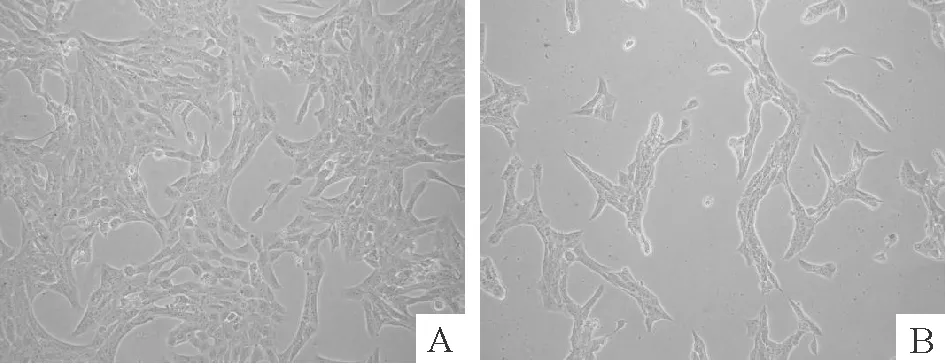
Figure 1. Effect of 100 μg/L NGF on the morphological changes of HSCs observed by inverted microscopy (×200).A:control;B:NGF 100 μg/L.
3吖啶橙染色结果
对照组细胞多呈梭形、星形,胞体舒展,形态较一致;胞核规整,为圆形或类圆形,为均匀一致的绿色荧光;胞浆发桔红色荧光。100 μg/L NGF作用HSCs后细胞数量减少,且细胞体积缩小、形态不规整,细胞核固缩,荧光增强,可见浓缩致密的暗绿色或黄绿色荧光,见图2。

Figure 2. Effect of 100 μg/L NGF on the morphological changes of HSCs observed by acridine orange staining (×200).A:control;B:NGF 100 μg/L.
4透射电镜观察结果
100 μg/L NGF作用HSCs后,凋亡细胞体积较正常细胞明显缩小,核染色质浓缩,沿核膜排列,细胞器也发生浓缩,并可以见到凋亡小体形成,见图3。
Figure 3. Effect of 100 μg/L NGF on the morphological changes of apoptosis of HSCs observed by TEM.A: normal HSCs(×6 200); B: chromatin condensation and margination inside the nuclear membrane(×8 900); C: nuclear chromatin condensation and shrinkage(×15 000); D: reduced nuclear volume, cleavage into multiple dense bodies, and apoptotic body formation with complete membrane framework (×8 900).B,C,D:100 μg/L NGF group.
讨 论
肝纤维化是所有慢性肝病共有的病理改变。HSCs激活是肝纤维化的中心环节,正常的HSCs处于静止状态,激活后发生表型转换成为肌成纤维样细胞,细胞大量增殖,进而分泌Ⅰ、Ⅲ、Ⅳ型胶原、层黏连蛋白等多种ECM成分,造成以Ⅰ、Ⅲ型胶原为主要成分的ECM 合成增多、降解相对不足,甚至降解被抑制,最终可造成ECM在肝内过量沉积,导致肝纤维化的发生发展[4]。
NGF除了具有神经营养因子的一般功能外,还可以诱导细胞凋亡,多是通过低亲和力受体——p75神经营养因子受体(p75 neurotrophin receptor,p75NTR)来介导。当仅有p75NTR单独存在,而无高亲和力受体(TrkA)表达时,NGF与p75NTR结合可引起细胞凋亡[5]。核转录因子-κB ( nuclear factor-κB,NF-κB)普遍存在于多种细胞中,在受到氧自由基、内毒素等刺激时NF - κB 可被激活,启动一些相应的基因,导致机体一系列的改变[6],研究发现:肝脏受损时肝细胞可表达NGF;用重组体NGF培养HSCs,细胞凋亡明显增多,且具有剂量依赖性,NGF能降低P50/P65 NF - κB异源二聚体活性,其中NF-κB的降低伴随着caspase-3活性的显著增高[7]。给予外源性NGF(0.1~100 μg/L)干预HSCs后,以吖啶橙染色观察细胞凋亡数目,发现NGF浓度为100 μg/L时,HSCs表现明显的凋亡[2]。本小组前期研究也发现HSCs在100 μg/L的NGF作用下,细胞增殖被抑制并出现凋亡(结果另文发表)。
目前尚未见有关NGF作用HSCs后对Ⅰ、Ⅲ型胶原表达影响的研究报道,本研究采用ELISA方法检测经过NGF作用前、后HSCs培养基上清液中Ⅰ、Ⅲ型胶原含量的变化,发现与对照组比较,各浓度NGF作用HSCs后上清液Ⅰ、Ⅲ型胶原表达减少,这可能与NGF抑制HSCs增殖、诱导其凋亡,从而影响Ⅰ、Ⅲ型胶原的基因表达、抑制Ⅰ、Ⅲ型胶原的分泌等有关,具体分子生物学机制以及对其它ECM的分泌有无影响还有待进一步研究。
吖啶橙荧光染色是观察细胞凋亡形态学变化的一种简便可靠的方法[8],吖啶橙能够透过细胞膜,把细胞核内的DNA染成绿色,细胞浆内的RNA染成桔红色,凋亡细胞的细胞核固缩或碎裂,因此呈现致密浓染的黄绿色,有时可见碎块状[9]。本实验结果显示:NGF作用HSCs后倒置显微镜和吖啶橙染色显示细胞数量减少,细胞体积缩小、形态不规整,细胞核固缩,吖啶橙染色显示实验组荧光增强,可见浓缩致密的暗绿色或黄绿色荧光;透射电镜可见凋亡细胞体积较正常细胞明显缩小,核染色质浓缩,沿核膜排列,细胞器也发生浓缩,并可以见到凋亡小体形成,出现了典型的细胞凋亡形态学变化,进一步说明经NGF作用后HSCs发生了细胞凋亡,NGF可能由此而发挥抗肝纤维化作用。
NGF的作用特点是针对不同靶细胞可能发挥完全相反的两种作用,有关NGF对HSCs的增殖、凋亡及对肝纤维化的影响等方面的相关研究较少。本研究观察到NGF可抑制HSCs分泌胶原,引起HSCs出现细胞凋亡的形态学改变,有助于明确NGF抗肝纤维化的相关作用机制。关于NGF在肝损伤、肝纤维化发病过程中对HSCs的具体作用机制、NGF抗肝纤维化的确切作用机理等如何,尚需进一步深入研究。
[1]Kendall TJ,Hennedige S,Aucott RL, et al. p75 neurotrophin receptor signaling regulates hepatic myofibroblast proliferation and apoptosis in recovery from rodent Liver fibrosis[J]. Hepatology, 2009, 49(3): 901-910.
[2]Trim N, Morgan S, Evans M, et al. Hepatic stellate cells express the low affinity nerve growth factor receptor p75 and undergo apoptosis in response to nerve growth factor stimulation [J]. Am J Pathol, 2000, 156(4): 1235-1243.
[3]陈 新, 王玉珍, 修贺明, 等. 神经生长因子在肝纤维化大鼠肝星状细胞凋亡中的作用[J].中华医学杂志, 2006, 86(28): 1985-1988.
[4]Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Gastroenterology, 2008, 134(6): 1655-1669.
[5]Fridma WJ ,Greene LA. Neurotrophin signaling via Trks and p75[J]. Exp Cell Res, 1999, 253(1): 131-142.
[6]马晓燕, 司英奎, 韩雪霖. 脂肪性肝病中NF - κB活性变化及其意义[J].中国病理生理杂志, 2007, 23(11): 2276-2277.
[7] Oakley F, Trim N, Constandinou CM, et al. Hepatocytes express nerve growth factor during liver injury[J]. Am J Pathol, 2003 ,163(5): 1849-1858.
[8]胡 野,凌志强,单小云. 细胞凋亡的分子医学[M]. 第1版.北京:军事医学出版社,2002.464-474.
[9]de Villiers WJ, Song Z,Nasser MS, et al. 4-Hydroxynonenal-induced apoptosis in rat hepatic stellate cells: mechanistic approach[J]. J Gastroenterol Hepatol, 2007, 22(3): 414-422.
EffectsofNGFoncollagensecretionandmorphologyofhepaticstalletecells
SHU Jian-chang, ZHU Hai-yan, LÜ Xia, HE Ya-jun, CHEN Lian-xiang, YE Guo-rong
(DepartmentofGastroenterology,GuangzhouRedCrossHospitalAffiliatedtoJinanUniversity,Guangzhou510220,China.E-mail:shujc62@hotmail.com)
AIM: To investigate the effects of nerve growth factor (NGF) on the changes of collagen secretion and morphology of hepatic stallete cells(HSCs).METHODSRat HSCs were incubated with different concentrations of NGF for 24 h. Collagen I and III in the supernatants of culture medium secreted by HSCs were detected by enzyme-linked immunosorbent assay. The morphological changes of HSCs were observed under inverted microscope with acridine orange staining and under transmission electronic microscope.RESULTSWhen HSCs was incubated with NGF at concentrations of 100, 200 or 400 μg/L for 24 h, the content of collagen I and collagen III in the culture supernatants were significantly reduced compared with control group (Plt;0.05). After stimulated with NGF at the concentration of 100 μg/L for 24 h, the growth of the HSCs was inhibited and the morphous of the cells became round or oval gradually. The morphological changes of apoptotic cells were also observed by acridine orange staining and transmission electronic microscopy.CONCLUSIONNGF inhibits HSCs to synthesize collagen I and collagen III. Inhibition of collagen production and promotion of apoptosis in HSCs may be the possible mechanisms of NGF to reverse liver fibrosis.
Hepatic stellate cells; Collagen; Morphology; Nerve growth factor
1000-4718(2011)12-2396-03
R363
A
10.3969/j.issn.1000-4718.2011.12.030
2011-07-08
2011-11-20
广东省自然科学基金资助项目(No.9151051501000083);广州市科技局计划(No.2010Y1-C691)
△通讯作者 Tel:020-34403828;E-mail:shujc62@hotmail.com
