淫羊藿素通过雌激素受体和骨形态发生蛋白信号诱导MC3T3-E1 subclone 14细胞分化*
2011-11-20朱晓峰张荣华孙升云王攀攀
朱晓峰, 张荣华, 孙升云, 王攀攀, 杨 丽, 韩 莉, 金 玲
(暨南大学 1附属第一医院中医科,2药学院中药学教研室,广东 广州 510630)
淫羊藿素通过雌激素受体和骨形态发生蛋白信号诱导MC3T3-E1 subclone 14细胞分化*
朱晓峰1, 张荣华2△, 孙升云1, 王攀攀2, 杨 丽2, 韩 莉1, 金 玲1
(暨南大学1附属第一医院中医科,2药学院中药学教研室,广东 广州 510630)
目的: 观察淫羊藿素(ICT)对MC3T3-E1 subclone 14前体成骨细胞株增殖、分化的影响,以及雌激素受体(ER)和骨形态发生蛋白(BMP)信号在分化中的作用。方法WST-8、BrdU法检测ICT对MC3T3-E1 subclone 14细胞活力和增殖的影响;ICI182780阻断ER受体信号后,检测ICT和noggin对MC3T3-E1 subclone 14细胞碱性磷酸酶(ALP)活性、I型胶原(Col I)和骨钙素(BGP)的影响;实时荧光PCR检测ICT对BMP-2、4、7 mRNA表达的影响;Western blotting检测ER受体信号阻断后,ICT对Smad1/5/8蛋白磷酸化的影响。结果ICT(0.1 μmol/L、1 μmol/L)可以提高MC3T3-E1 subclone 14细胞ALP、Col I、BGP和矿化结节数量(Plt;0.01或Plt;0.05),表明ICT有促分化的作用,但对细胞活力和增殖指数无明显影响;阻断ER受体信号后,ICT促分化作用明显下降(Plt;0.01);ICT可以提高BMP-2、4 mRNA的表达(Plt;0.01),但对BMP-7 mRNA无作用(Pgt;0.01);阻断ER信号后,ICT 促Smad1/5/8磷酸化明显减弱(Plt;0.01)。进一步阻断BMP/Smad信号可以抑制ICT促分化的作用(Plt;0.01)。结论ICT可以通过ER受体激活BMP/Smad信号通路,进而促进MC3T3-E1 subclone 14细胞的分化。
淫羊藿素; 成骨细胞; 受体,雌激素; 骨形态发生蛋白
淫羊藿素(icaritin,ICT)为补肾壮骨中药淫羊藿的主要成分淫羊藿苷的体内代谢产物,已有研究显示ICT可以促进成骨细胞(osteoblasts,OB)分化[1],但对其具体作用靶点和作用机制缺乏进一步研究。传统认为补肾中药的黄酮类、香豆素类等活性成分具有类雌激素生物活性,ICT的化学结构上3、7位羟基化使其具有了类雌激素的活性结构,那么ICT影响OB分化是否依赖雌激素受体(estrogen receptor,ER)信号通路?另有研究发现骨形态发生蛋白(bone morphogenetic protein,BMP)/Smad是多种植物活性成分影响OB分化的重要信号通路[2],ICT是否也是通过BMP/Smad信号转导途径促进OB分化,它和ER信号有无关系?本研究以小鼠颅顶前骨细胞亚克隆14 (MC3T3-E1 subclone 14)为细胞模型,研究ICT对其分化以及ER信号、BMP/Smad信号在其中的作用,为淫羊藿应用于骨质疏松等骨代谢病提供部分细胞分子生物学依据。
材 料 和 方 法
1主要试剂
无酚红的αMEM购于Gibco;碳吸附的胎牛血清(fetal bovine serum,FBS)购于Biological Industries;抗坏血酸(vitamin C,Vit C)、二甲基亚砜(dimethyl sulfoxide,DMSO)、茜素红和对硝基苯磷酸(p-nitrophenyl phosphate,pNPP)购于Sigma;Triton X-100购于Amresco;ICI182780购于Tocris Cookson;WST-8试剂盒和BrdU流式细胞术细胞增殖检测试剂盒购于Gemed;二辛可宁酸(bicinchoninic acid,BCA)蛋白检测试剂盒购于凯基生物科技公司;Ⅰ型胶原(ColⅠ)ELISA试剂盒购于森雄科技实业有限公司;骨钙素(bone Gla protein,BGP)ELISA试剂盒购于西唐生物科技有限公司;ECL发光试剂盒购于Pierce;β-tubulin兔抗小鼠 Ⅰ 抗和p-Smad1/5/8多克隆兔抗小鼠 Ⅰ 抗购于Cell Signal;noggin购于Ramp;D;Smad1/5/8多克隆兔抗小鼠 Ⅰ 抗和羊抗兔 Ⅱ 抗购于Santa Cruz公司。
2药物
淫羊藿素,分子式C21H22O7,分子量386.4,黄色结晶,购于上海顺勃生物工程技术有限公司,批号为071201,含量99.8%(HPLC检测)。
3细胞
MC3T3-E1 subclone 14细胞购于中国科学院细胞库(ATCC CRL-2594)。
4主要方法
4.1实验药物的制备 取ICT 10 mg,先用少量DMSO溶解,然后再配制成含有不同浓度的培养基,对照组培养基中添加同等浓度的DMSO,各实验组DMSO的量均小于0.1%。
4.2MC3T3-E1 subclone 14细胞培养 MC3T3-E1 subclone 14细胞复苏,置于37 ℃、5% CO2培养箱培养,细胞分化实验培养液条件为含有10%碳吸附的FBS以去除血清中激素类活性因子、20 mmol/L HEPES、50 mg/L Vit C、1 mmol/L β-甘油磷酸钠(sodium β-glycerophosphate,β-GP)、1×105U/L青霉素、100 mg/L链霉素的无酚红的αMEM培养基[3],每3 d换液1次。
4.3WST-8检测细胞活力 细胞每孔5×103个接种至96孔板内,贴壁后换无血清的无酚红αMEM培养液培养24 h,再更换含ICT(0.01 μmol/L、0.1 μmol/L、1 μmol/L)的培养液或对照液(根据ICT细胞毒性的检测结果),培养48 h,每孔加入10 μL的WST-8,孵育1 h,酶标仪490 nm波长处检测吸光度(A)值。
4.4BrdU法流式细胞仪检测细胞增殖 细胞每孔2×106个接种至6孔板内,贴壁后换无血清无酚红的αMEM培养液培养24 h,再更换含ICT(0.01 μmol/L、0.1 μmol/L、1 μmol/L)的培养液或对照液48 h,BrdU法流式细胞仪检测细胞增殖,具体操作按试剂盒步骤进行,波长488 nm氩离子激光器,观察50 000个细胞以上。
4.5pNPP法检测细胞碱性磷酸酶(alkaline phosphatase,ALP)活性 细胞以5×107/L的密度3 mL接种到6孔板中,含10%碳吸附的FBS的αMEM培养6 d,细胞同步化后更换为含药培养液或对照液,48 h后吸弃培养液,每孔加细胞裂解液1 mL(0.1%Triton X-100),4 ℃作用20 min,收集裂解液pNPP法测定ALP浓度。BCA法检测细胞总蛋白进行蛋白浓度校正,ALP活性以103U/g蛋白表示。阻断ER信号组将细胞用1 μmol/L ICI182780培养基预处理2 h[4],阻断BMP信号组将细胞先用100 μg/L noggin培养基预处理2 h[5],然后分别和药物共培养。
4.6ELISA法检测细胞Col Ⅰ和BGP的表达 细胞接种方法同ALP检测,细胞同步化后更换为含药培养液或对照液,72 h后吸弃培养液,每孔加细胞裂解液750 μL,裂解20 min,收集裂解液ELISA法测BGP和ColⅠ,包括标准曲线的绘制,加样,温育,洗涤,加底物,温育,加终止液,酶标仪测A值,具体步骤按说明书进行。BCA法检测细胞总蛋白进行蛋白浓度校正。阻断ER信号和BMP信号方法同ALP检测。
4.7茜素红染色计数细胞矿化结节 细胞接种方法同ALP检测,细胞同步化后更换为各组含药培养液或对照液,培养14 d后,吸去培养液,95%乙醇固定20 min,吸去固定液,加入0.1%的茜素红染色液,染色30 min,祛除染色液;在低倍镜视野(×40)下进行矿化结节计数,每孔细胞随机计数10个视野的矿化结节数。
4.8实时荧光定量PCR检测BMP-2、BMP-4、BMP-7 mRNA表达 细胞悬液以每瓶2×107接种于25 cm2的培养瓶内,不同条件干预12 h后,Trizol法提取总RNA,然后逆转录;PCR反应;染料法(SYBR Green I)相对定量分析,实验按照ΔΔCt解析法设计。扩增条件:95 ℃预变性10 min,95 ℃ 10 s, 60 ℃ 30 s, 72 ℃ 15 s,40个循环。设定GAPDH为内参照。BMP-2引物序列:正义链5’-CAG TAG TTT CCA GCA CCG AAT-3’,反义链5’-ATA CTC AGC ACC GGC CTC ACC C-3’,扩增产物长度为646 bp;BMP-4引物序列:正义链5’-AAG TTT GTT CAA GAT TGG CTC C-3’,反义链5’-CGA CCA TCA GCA TTC GGT TA-3’,扩增产物长度为359 bp;BMP-7引物序列:正义链5’-TTC GGA TTG TGC TGT CCA TA-3’,反义链5’-GTT TCC CAC ATC AAG CTG GT-3’,扩增产物长度为159 bp;GAPDH引物序列:正义链5’-CAC GGC AAA TTC AAC GGC ACA-3’,反义链5’-ATA CTC AGC ACC GGC CTC ACC C -3’,扩增产物长度为201 bp。反应结束后根据Ct值,进行计算和统计。
4.9Western blotting检测Smad1/5/8的表达 细胞接种方法同ALP检测,细胞同步化后分成对照组、ICT(1 μmol/L)组、ICI182780(1 μmol/L)组、ICT(1 μmol/L)+ ICI182780(1 μmol/L)组,干预24 h后,检测Smad1/5/8和磷酸化的Smads1/5/8蛋白的表达。包括:细胞总蛋白的提取,考马斯亮蓝法测定蛋白浓度,根据蛋白浓度确定上样体积;SDS-PAGE电泳;转膜、洗膜;免疫反应;分别孵育Ⅰ抗(1∶1 500)和β-tubulin抗体(1∶1 000),加Ⅱ抗洗膜(1∶3 000);ECL发光显色,曝光,显影,定影,标定marker,扫描与分析。
5统计学处理
结 果
1ICT对MC3T3-E1subclone14细胞活力和增殖的影响
ICT各组和对照组比较,细胞活力上无显著差异(Pgt;0.05);BrdU流式细胞术检测结果发现ICT各组在培养48 h后,各组增殖指数(proliferative index,PI)无明显差异(Pgt;0.05),见表1。
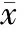
表1 ICT对MC3T3-E1 subclone 14细胞活力和增殖的影响
2ICT对MC3T3-E1subclone14细胞分化和矿化的影响
和对照组比较,ICT各组ALP活性均明显升高,差异显著(Plt;0.01);0.1 μmol/L和1 μmol/L ICT 浓度组ColⅠ和BGP较对照组均明显升高,差异显著(Plt;0.01);ICT各组细胞形成矿化结节的数量较对照组均明显升高,差异显著(Plt;0.01),见表2、图1。
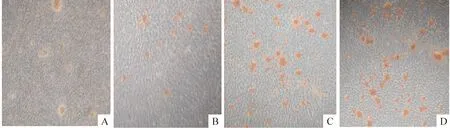
Figure 1. The microphotographs of mineralized nodus in MC3T3-E1 subclone 14 cells after ICT treatment for 14 d (Alizarin staining,×40).A:control;B:0.01 μmol/L ICT;C:0.1 μmol/L ICT;D:1 μmol/L ICT.
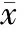
表2 ICT对MC3T3-E1 subclone 14细胞分化和矿化的影响
3阻断ER信号对MC3T3-E1subclone14细胞分化的影响
和ER阻断剂ICI182780共同处理后,1 μmol/L ICT促进MC3T3-E1 subclone 14细胞表达ALP、Col I和BGP明显减少,和单纯应用ICT组比较有显著差异(Plt;0.01),见表3。
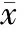
表3 阻断ER信号对MC3T3-E1 subclone 14细胞分化活性的影响
4ICT对MC3T3-E1subclone14细胞BMP-2、4、7mRNA表达的影响
实时荧光定量检测相对对照样品表达量差异(ΔΔCt)显示ICT可以剂量依赖性地提高BMP-2 mRNA的表达量,各剂量组和对照组以及各剂量组之间差异均显著(Plt;0.01),见图2。用1 μmol/L ICT处理细胞12 h后,也可以提高BMP-4 mRNA的表达量(Plt;0.05),但对BMP-7 mRNA的表达无明显影响,见图3。
5阻断ER信号对Smad1/5/8活性的影响
Western blotting检测结果相对分析表明,应用1 μmol/L ICT处理后MC3T3-E1 subclone 14细胞可以使磷酸化的Smad1/5/8表达量升高,和对照组相比有显著差异(Plt;0.01)。而加入ER阻断剂ICI182780后Smad1/5/8磷酸化明显减弱(Plt;0.01),单纯加入ICI182780组磷酸化和对照组比无明显差异(Pgt;0.05),因此可以推定BMP/Smad信号可能在ER信号的下游,见图4、5。
6阻断BMP信号对MC3T3-E1subclone14细胞分化的影响
和BMP阻断剂noggin(100 μg/L)共同干预后,1 μmol/L ICT促进MC3T3-E1 subclone 14细胞表达ALP、Col I和BGP明显减少,与单纯应用ICT组比差异明显(Plt;0.01),见表4。
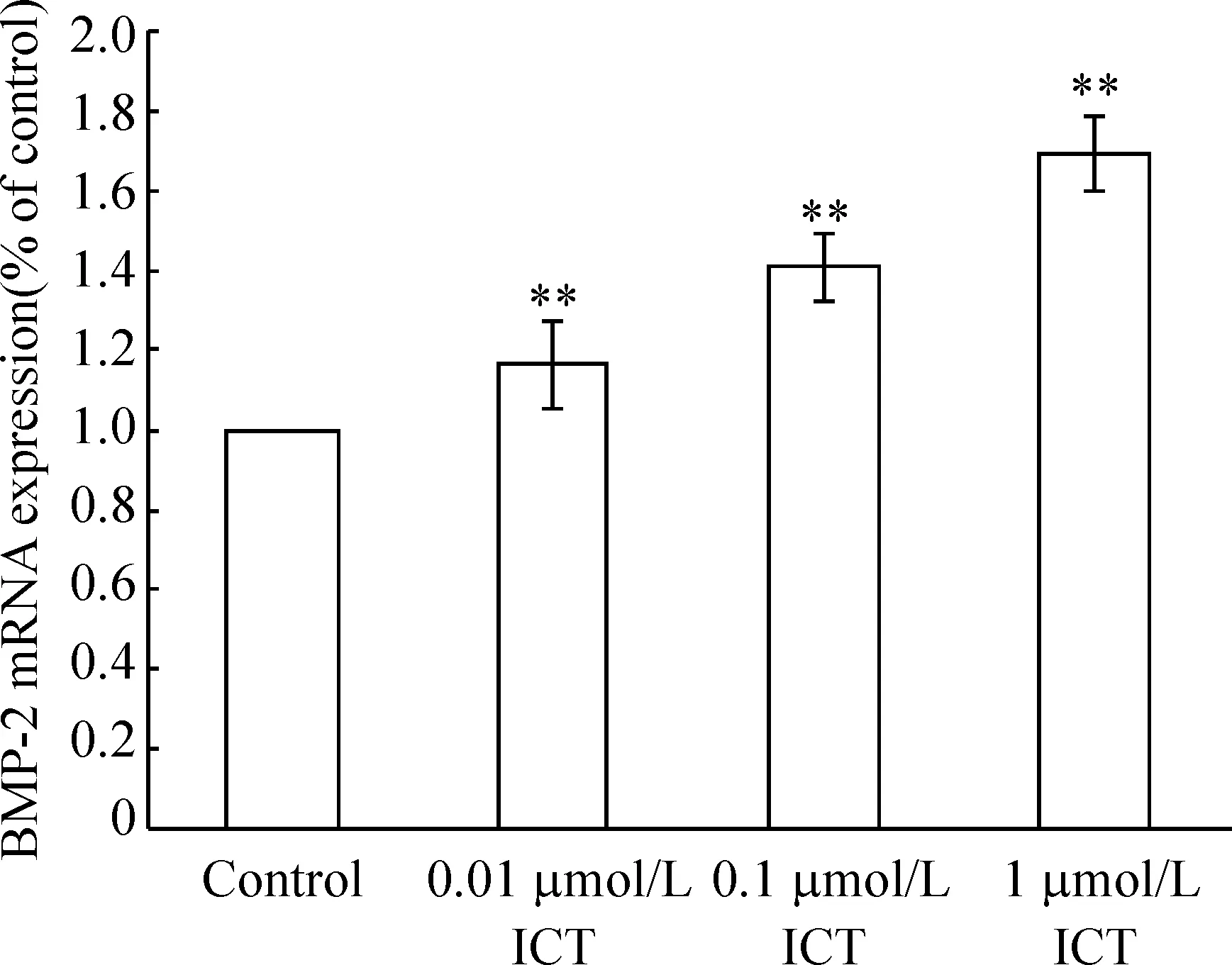
Figure 2. MC3T3-E1 subclone 14 cells were treated with different concentrations of ICT for 12 h and the level for BMP-2 mRNA was analyzed by qPCR. ICT increased the mRNA level of BMP-2 in a concentration-dependent manner. ±s.n=6.**Plt;0.01 vs control.
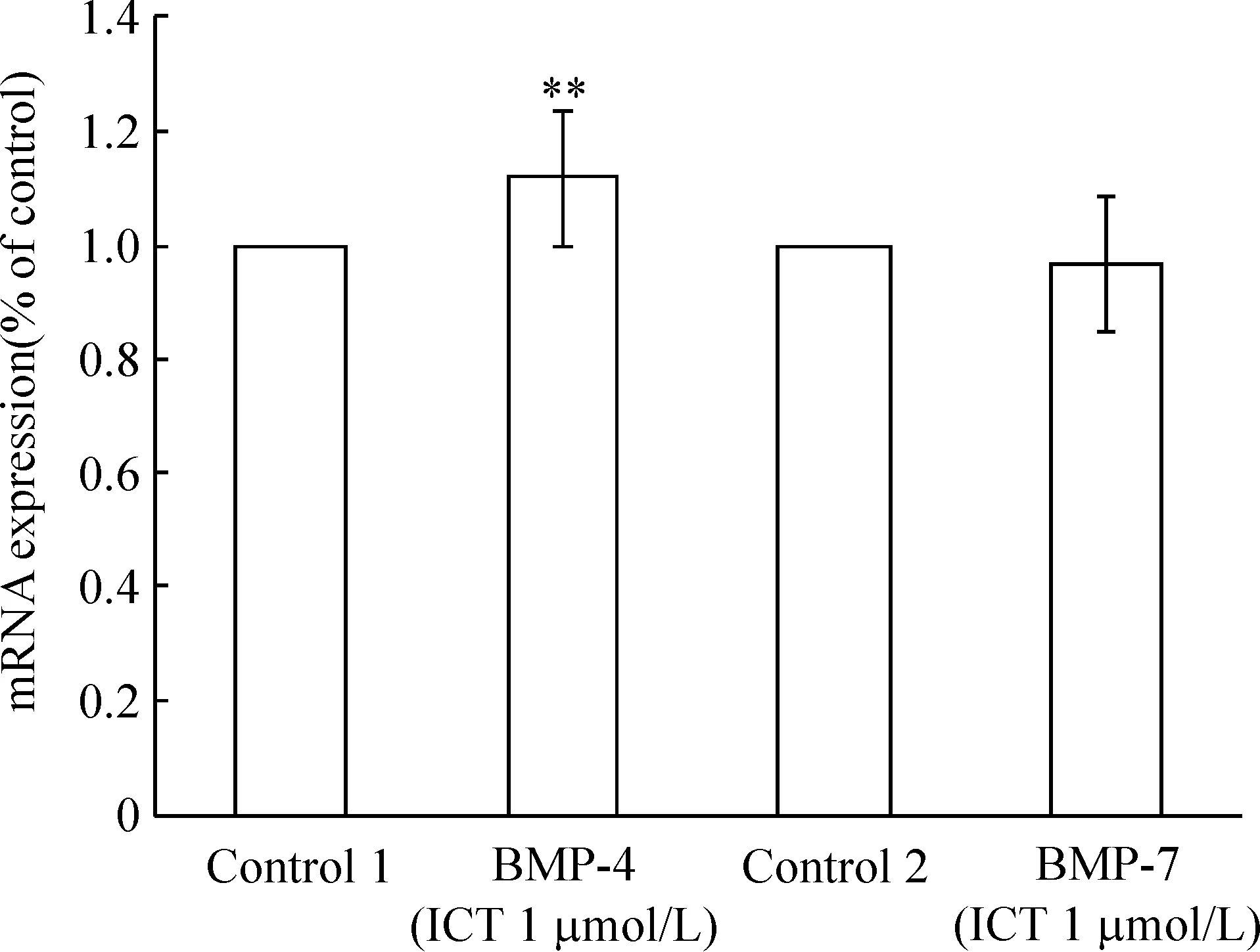
Figure 3. MC3T3-E1 subclone 14 cells were treated with 1 μmol/L ICT for 12 h and the level for BMP-4 and BMP-7 mRNA was analyzed by qPCR. ICT increased the mRNA level of BMP-4 mRNA, but had no effect on BMP-7 mRNA. ±s.n=6..**Plt;0.01 vs control 1.

Figure 4. ICI182780 inhibited the ICT-induced increase in the phosphorylation of Smad1/5/8. MC3T3-E1 subclone 14 cells were pretreated with 1 μmol/L ICI182780 for 2 h and then further incubated with or without ICT for another 24 h. Smad1/5/8 protein phosphorylation was measured by Western blotting, then executed a relative quantitative analysis±s.n=6.**Plt;0.01 vs control;##Plt;0.01 vs ICT treatment alone.
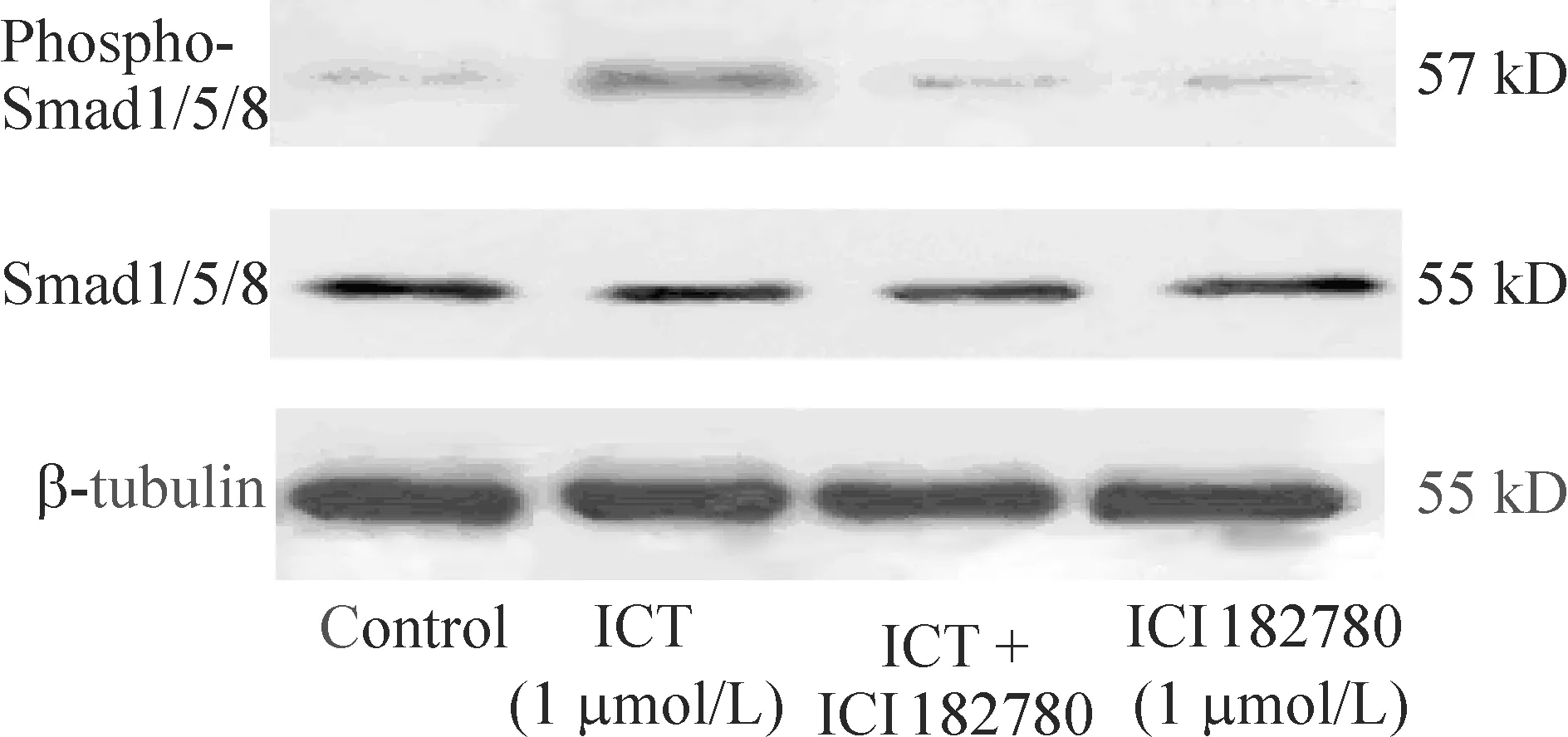
Figure 5. ICI182780 prevented the ICT-induced activation of Smad1/5/8. Cells were treated with 1 μmol/L ICT for 24 h,and ICI182780 1 μmol/L was added 2 h before ICT treatment.
表4 阻断BMP信号对MC3T3-E1 subclone 14细胞分化活性的影响
讨 论
MC3T3-E1 subclone 14和原代培养颅顶OB的行为类似,是研究体外OB分化的较好模型[6-7],细胞在含有Vit C和β-GP的培养条件中能较好地分化。ICT具有类雌激素的活性结构, 0.01 μmol/L、0.1 μmol/L、1 μmol/L ICT不影响细胞活力和增殖指数,但可以促进细胞ALP、Col I和BGP的表达,促进矿化结节的形成,这和一些中药活性成分的研究类似[5],国内也有学者发现染料木黄酮可以剂量和浓度依赖性地提高原代培养的大鼠OB的Col I和BGP的表达[8]。
雌激素通过雌激素受体参与骨骼生理和病理的相关过程,对骨的生长发育、成熟以及骨量维持有重要意义[9]。雌激素的作用通过雌激素受体ERα和ERβ介导。ICI182780是一种甾体类选择性雌激素受体调节剂,是ER的特异性拮抗剂,通过加速ER降解而下调ER、影响ER二聚体化、干扰ER细胞核定位以及减少ER与ERE的结合。ERα和ERβ都同样对特异性拮抗剂ICI182780反应,ICI182780基本可以完全阻断雌激素的效应。目前认为,一些中药有类性激素样作用,它们的活性成分从化学结构上看大部分具有雌激素的类似结构,因此被称为植物雌激素(phytoestrogen)[10],在植物中常以糖苷的形式存在,进入体内经肠道细菌糖苷酶水解为有活性的苷元,可与雌激素受体结合,发挥雌激素样作用。ICT就是从淫羊藿苷经肠道内细菌代谢而来,化学结构上3,7位羟基化使其具有了类雌激素的活性结构(图6),因此我们推测ICT可能也是通过雌激素受体起作用的,本实验通过用ICI182780阻断ER后发现,ICT促进MC3T3-E1 subclone 14细胞分化作用明显下降,可见ER介导了ICT的促分化的作用。

Figure 6. Chemical structures of icaritin, 17-β estradiol and ICI182780.
BMPs是脊椎动物体内能诱导成骨的一类酸性多肽,可诱导未定型和定型OB经过趋化、分裂、分化等过程,不可逆地分化成骨。BMP受体属于TGF-β受体超家族的成员,是膜蛋白受体,具有丝氨酸/苏氨酸蛋白激酶结构。在迄今发现的约20多种BMP成员中,BMP-2、BMP-4和BMP-7在成骨作用方面较为重要[11]。Smads蛋白是BMP在细胞内信号转导过程中起重要作用的中介因子,其中Smad1、5、8作为信号通路中关键分子,通过对多种信号的整合表现为一种总的效应,对靶基因的转录进行调节[12]。一些药物如FK506可以通过BMP-2/Smad1/5/8调节干细胞的成骨分化[13]。Noggin是BMP的抑制剂,能够竞争性与BMPs受体结合,下调BMPs的活性[14]。我们的研究表明ICT可以剂量依赖性地提高BMP-2的表达,对BMP-4也有促进表达的作用,但对BMP-7却无促进作用,这和一些研究结果如蛇床子素仅刺激BMP-2表达有些不同[2],我们认为BMP家族多个成员可能参与了ICT对MC3T3-E1 subclone 14细胞的成骨分化。进一步研究发现阻断ER信号后,Smad1/5/8的磷酸化明显减弱,提示ICT能通过ER激活BMP/Smad信号通路。用noggin阻断BMP/Smad信号后,ICT促进MC3T3-E1 subclone 14细胞分化作用明显下降,说明BMP/Smad信号通路参与了ICT诱导的MC3T3-E1 subclone 14细胞的成骨分化。
[1]Huang J, Yuan L, Wang X, et al. Icaritin and its glycosides enhance osteoblastic, but suppress osteoclastic, differentiation and activityinvitro[J]. Life Sci, 2007, 81(10): 832-840.
[2]Kuo PL, Hsu YL, Chang CH, et al. Osthole-mediated cell differentiation through bone morphogenetic protein-2/p38 and extracellular signal-regulated kinase 1/2 pathway in human osteoblast cells[J]. J Pharmacol Exp Ther, 2005, 314(3): 1290-1299.
[3]Fatokun AA,Stone TW,Smith RA. Hydrogen peroxide-induced oxidative stress in MC3T3-E1 cells: the effects of glutamate and protection by purines[J]. Bone, 2006,39(3):542-551.
[4]Prouillet C, Mazière JC, Mazière C, et al. Stimulatory effect of naturally occurring flavonols quercetin and kaempferol on alkaline phosphatase activity in MG-63 human osteoblasts through ERK and estrogen receptor pathway[J]. Biochem Pharmacol, 2004, 67(7): 1307-1313.
[5]Tang CH, Yang RS, Chien MY, et al. Enhancement of bone morphogenetic protein-2 expression and bone formation by coumarin derivatives via p38 and ERK-dependent pathway in osteoblasts[J]. Eur J Pharmacol, 2008, 579 (1-3):40-49.
[6]Tang SY, Xie H, Yuan LQ, et al. Apelin stimulates proliferation and suppresses apoptosis of mouse osteoblastic cell line MC3T3-E1 via JNK and PI3-K/Akt signaling pathways[J]. Peptides, 2007,28(3):708-718.
[7]Choi EM, Lee YS. Involvement of PI3K/Akt/CREB and redox changes in mitochondrial defect of osteoblastic MC3T3-E1 cells[J]. ToxicolInVitro, 2011,25(5):1085-1088.
[8]王 东, 苏宜香.染料木黄酮对人成骨细胞增殖及分化影响[J]. 中国公共卫生,2009,25(3):306-308.
[9]朱顺叶,余振华,陈红珊,等.司坦唑醇激活ERα调节雌激素受抑的青春期大鼠生长板软骨细胞的增殖和分化[J].中国病理生理杂志,2009,25(6):1186-1191.
[10]孟庆书,何 平, 朱晓燕, 等. 植物雌激素的作用机制[J]. 生命的化学, 2007,27(2):141-143.
[11]Liao JC, Tzeng ST, Keorochana G, et al. Enhancement of recombinant human BMP-7 bone formation with BMP binding peptide in a rodent femoral defect model[J]. J Orthop Res, 2011,29(5):753-759.
[12]Simic P, Vukicevic S. Bone morphogenetic proteins: from developmental signals to tissue regeneration. Conference on bone morphogenetic proteins[J]. EMBO Rep, 2007,8(4):327-331.
[13]Kugimiya F, Yano F, Ohba S, et al. Mechanism of osteogenic induction by FK506 via BMP/Smad pathways[J]. Biochem Biophys Res Commun, 2005, 338 (2):872-879.
[14]Zhu W, Kim J, Cheng C, et al. Noggin regulation of bone morphogenetic protein (BMP) 2/7 heterodimer activityinvitro[J]. Bone, 2006, 39 (1):61-71.
IcaritininducesdifferentiationofMC3T3-E1subclone14cellsviaestrogenreceptorandBMP/Smadsignalingpathwayinvitro
ZHU Xiao-feng1, ZHANG Rong-hua2, SUN Sheng-yun1, WANG Pan-pan2, YANG Li2, HAN Li1, JIN Ling1
(1DepartmentofTraditionalChineseMedicine,TheFirstAffiliatedHospital,2PharmacyCollege,JinanUniversity,Guangzhou510630,China.E-mail:tzrh@jnu.edu.cn)
AIM: To observe the effects of icaritin (ICT) on the proliferation and differentiation of MC3T3-E1 subclone 14 cells (a pre-osteoblast cell line) and to observe the role of estrogen receptor (ER) and bone morphogenetic protein(BMP)/Smads signaling pathways in the differentiation of the cells.METHODSThe methods of WST-8 and BrdU were used to observe the viability and proliferation of MC3T3-E1 subclone 14 cells after treatment with different concentrations of ICT. The effects of ICT and noggin on the levels of alkaline phosphatase(ALP), type I collagen (Col I) and bone Gla protein (BGP) in MC3T3-E1 subclone 14 cells were observed after ER was blocked by ICI182780. The relative mRNA levels of BMPs (2, 4, 7) were detected by real-time PCR. The protein phosphorylation of Smad1/5/8 was determined by Western blotting after ER signaling pathway was blocked by ICI182780.RESULTSICT at concentrations of 0.1 μmol/L and 1 μmol/L increased the levels of ALP, Col I and BGP, and the numbers of mineralized nodules in MC3T3-E1 subclone 14 cells, indicating that ICT-promoted the differentiation, but did not affect the cell viability and proliferation. After the ER receptor signaling was blocked, ICT-promoted differentiation was significantly decreased. ICT improved the mRNA expression of BMP-2, 4, but did not affect the mRNA expression of BMP-7. After the ER receptor signaling was blocked, ICT-promoted phosphorylation of Smad1/5/8 was significantly decreased. Blockage of BMP/Smad signaling inhibited the effect of ICT on the differentiation.CONCLUSIONIcaritin induces the differentiation of MC3T3-E1 subclone 14 cells by activating BMP/Smad signaling pathway through ER.
Icaritin; Osteoblasts; Receptors,estrogen; Bone morphogenetic protein
1000-4718(2011)12-2351-06
R336
A
10.3969/j.issn.1000-4718.2011.12.021
2011-07-30
2011-09-19
国家自然科学基金资助项目(No.30772885;No.81173619);广东省高等学校中药有效性与安全性重点实验室开放基金资助项目(No.kf08011);广东中医药局科研基金资助项目(No.2010118)
△通讯作者 Tel: 020-85228578; E-mail: tzrh@jnu.edu.cn
