TNFR-Fc减轻LPS所致小鼠ALI炎症反应损伤*
2011-11-20袁伟锋黄文杰
袁伟锋, 李 理, 徐 虹, 黄文杰△
(1广州军区广州总医院呼吸内科, 广东 广州 510010;2南方医科大学研究生学院, 广东 广州 510515)
·短篇论著·
TNFR-Fc减轻LPS所致小鼠ALI炎症反应损伤*
袁伟锋1,2, 李 理1, 徐 虹1,2, 黄文杰1△
(1广州军区广州总医院呼吸内科, 广东 广州 510010;2南方医科大学研究生学院, 广东 广州 510515)
目的: 评价肿瘤坏死因子受体-Fc融合蛋白(TNFR-Fc)能否有效下调炎症反应而减轻急性肺损伤(ALI)小鼠的肺组织破坏。方法小鼠随机分为脂多糖(LPS)组、TNFR-Fc+LPS组和对照组。气管内滴入LPS复制ALI小鼠模型,TNFR-Fc组在滴入LPS前24 h腹膜腔注射TNFR-Fc (0.4 mg/kg),在滴入LPS后2 h收集标本,检测肺湿/干重、肺泡蛋白含量与肺组织病理评分;ELISA法检测血清TNF-α浓度及检测肺泡灌洗液与血清IL-1β、IL-6、IL-10与IFN-γ浓度。结果TNFR-Fc显著降低血清TNF-α浓度(Plt;0.05),轻度降低肺湿/干重比例,显著降低BALF蛋白浓度(Plt;0.05),显著降低ALI评分数值(Plt;0.05)。TNFR-Fc显著降低致炎症细胞因子IL-6在BALF(Plt;0.05)与血清(Plt;0.05)中的浓度,轻度提高BALF中IL-10浓度(Pgt;0.05),但其差异不显著,亦能显著提高血清IL-10浓度(Plt;0.05)。IL-1β与IFN-γ水平处理前后变化不显著。结论TNFR-Fc中和ALI中过度表达的TNF-α,下调以IL-6为代表的炎症反应,减轻ALI的肺组织破坏。
肿瘤坏死因子受体-Fc融合蛋白; 急性肺损伤; 炎症
细菌感染后诱发的炎症反应失衡是引起急性肺损伤(acute lung injury, ALI)的重要因素。炎症反应失控放大、加重了ALI病情,甚至发生急性呼吸窘迫综合征与多器官功能衰竭。因此,ALI的治疗不仅需要有效的抗感染疗法,而且需要对机体防御系统进行调控,减少炎症反应对肺组织结构细胞的破坏,维持呼吸系统功能。在炎症反应始动与放大的过程中,肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)起着重要作用。TNF-α是启动和介导炎症反应放大的主要炎症介质。肺泡巨噬细胞在LPS刺激后初次表达TNF-α,初次释放的TNF-α与其它炎症细胞的TNF受体(TNF receptor, TNFR)结合,活化炎症反应信号,正反馈放大炎症反应[1]。中和TNF-α或可抑制炎症反应的放大过程,减轻ALI的炎症损伤。本研究复制LPS致ALI小鼠模型,以TNFR-Fc中和循环过量的TNF-α,通过肺湿/干重比例、肺泡腔蛋白渗出、肺组织病理、支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)与血清中多个炎症细胞因子浓度等方面评价TNF-α中和对ALI的肺组织保护作用。
材 料 和 方 法
1材料
1.1动物 SPF级8周龄雌性BALB/c小鼠共30只,平均体重20 g,广东省医学实验动物中心提供。所有操作和实验流程均遵守《实验动物管理条例》。小鼠在实验前自由进食和进水。
1.2主要试剂与设备 脂多糖(lipopolysaccharide,LPS,E.coliO55∶B5, Sigma);注射用重组人II型肿瘤坏死因子受体-Fc融合蛋白(上海中信国健药业有限公司,批号为20090501),BCA蛋白浓度测定试剂盒(江苏碧云天公司),小鼠白细胞介素1β(interleukin-1β,IL-1β)、IL-6、IL-10、TNF-α与干扰素γ(interferon γ,IFN-γ) ELISA试剂盒(北京四正柏生物科技有限公司),电热烘干箱,酶标仪,光学显微镜(奥林巴斯,BX51)。
2方法
2.1实验设计 30只小鼠随机平均分为LPS组、TNFR-Fc+LPS组与对照组。LPS组小鼠腹腔注射水合氯醛麻醉后,钝性分离气管,气管内滴入LPS(5 mg/kg)。TNFR-Fc+LPS组小鼠腹腔注射TNFR-Fc(0.4 mg/kg),24 h后如上法进行LPS气管内滴入。对照组小鼠气管内滴入与LPS溶液等体积的生理盐水。分别于LPS/生理盐水滴入后0 h与2 h处死小鼠获取检测样本。
2.2肺组织湿/干重比例测量 小鼠水合氯醛麻醉后经腹主动脉充分放血,开胸后取肺,滤纸吸干肺表面液体,置电子天平称量肺组织湿重。称量湿重后肺置于电热烘干箱80 ℃干燥48 h后取出,称量肺组织干重并计算湿/干重比例。
2.3BALF蛋白含量检测 小鼠水合氯醛麻醉后经腹主动脉充分放血,剪开颈前皮肤,分离暴露气管,向心端插入套管针,4 ℃ PBS灌洗3次,共2 mL,计算总回收率,纳入回收率达80%样本,5 000 r/min离心10 min,留取上清液,BCA法检测蛋白含量(操作按试剂盒操作说明进行)。
2.4细胞因子浓度检测 同上法收集BALF上清液,ELISA法检测血清TNF-α浓度,以及BALF与血清IL-1β、IL-6、IL-10、IFN-γ浓度(操作按ELISA试剂盒说明书进行)。
2.5肺组织病理半定量评分 小鼠经腹主动脉充分放血后分离肺组织,置10%中性甲醛中固定。肺组织常规脱水、石蜡包埋,切片后行HE染色,参照Mikawa等[2]的方法以4项指标进行肺损伤评分:(1)肺泡充血;(2)出血;(3)间隙或血管壁中性粒细胞浸润或聚集;(4)肺泡间隔增厚或透明膜形成。0分:极轻度损伤;1分:轻度损伤;2分:中度损伤;3分:重度损伤;4分:严重损伤。将4项指标得分相加作为总分。由3名病理科医师分别对肺组织损伤程度进行评分,取3者平均值。
3统计学处理
结 果
1肺湿/干重比例
LPS组与TNFR-Fc+LPS组小鼠肺湿/干重比例在气管内滴入LPS后2 h与0 h相比均无显著差异(4.810±0.866vs3.480±0.193;4.700±0.359vs3.700±0.315,Pgt;0.05)。在滴入LPS后2 h,TNFR-Fc+LPS组与LPS组小鼠肺湿/干重比例无显著差异(4.700±0.359vs4.810±0.866,Pgt;0.05),见表1。
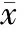
表1 TNFR-Fc对LPS致ALI小鼠肺湿/干重比例、BALF蛋白含量与肺损伤评分的影响
2肺泡灌洗液蛋白含量
LPS组与TNFR-Fc+LPS组小鼠BALF蛋白含量在气管内滴入LPS后2 h与0 h相比均显著性增高(793.430±87.168vs69.130±19.807,Plt;0.05;519.460±88.579vs77.440±8.533,Plt;0.05)。在滴入LPS后2 h,TNFR-Fc+LPS组BALF蛋白含量显著低于LPS组(519.460±88.579vs793.430±87.168,Plt;0.05),见表1。
3肺组织病理评分
在滴入生理盐水后2 h,对照组小鼠肺泡仍结构清晰,肺泡壁薄,肺泡内未见水肿液;LPS组小鼠在气管内滴入LPS后2 h肺组织肺泡间隔增厚并破坏,炎细胞浸润,无法辨认清晰肺泡结构;TNFR-Fc+LPS组小鼠在气管内滴入LPS后2h肺组织损伤较轻,肺泡间隔增厚,但间隔破坏不明显,可辨认肺泡结构,炎症细胞浸润,主要见于间隔及间隔内血管,部分肺泡腔内有少量渗出。LPS/生理盐水滴入后2 h 3组小鼠肺组织病理见图1。LPS组与TNFR-Fc+LPS组小鼠肺组织病理评分在气管内滴入LPS后2 h与0 h相比均显著升高(LPS组1.600±0.683vs10.000±0.365,Plt;0.05;TNFR-Fc+LPS组1.530±0.650vs6.800±0.901,Plt;0.05)。LPS滴入后2 h,TNFR-Fc+LPS组评分显著低于LPS组(6.800±0.901vs10.000±0.365,Plt;0.05),见表1。
Figure 1. Lung histology from three group animals (×200).A:control;B:LPS;C:TNFR-Fc+LPS.
4TNFR-Fc中和TNF-α效果检测
LPS组与TNFR-Fc+LPS组小鼠血清TNF-α浓度在LPS滴入后2 h与0 h相比均显著增高[(33.770±13.295)ng/Lvs(634.900±89.082)ng/L,Plt;0.05;(39.530±20.044)ng/Lvs(119.400±50.874)ng/L,Plt;0.05]。在气管内滴入LPS后2 h,TNFR-Fc+LPS组小鼠血清TNF-α浓度显著低于LPS组[(119.400±50.874)ng/Lvs(634.900±89.082)ng/L,Plt;0.05],见表2。
表2 TNFR-Fc对LPS致ALI小鼠血清/BALF细胞因子浓度的影响
5TNFR-Fc对BALF与血清IL-1β浓度的影响
LPS组与TNFR-Fc+LPS组小鼠BALF的IL-1β浓度在气管内滴入LPS后2 h与0 h相比无显著差异(Pgt;0.05)。在滴入LPS后2 h,LPS组与TNFR-Fc+LPS组BALF的IL-1β浓度无显著差异[(391.670±32.653)ng/Lvs(352.580±66.868) ng/L,Pgt;0.05]。
LPS组与TNFR-Fc+LPS组小鼠血清IL-1β浓度在LPS滴入后2 h与0 h相比无显著差异(Pgt;0.05)。在气管内滴入LPS后2 h,LPS组与TNFR-Fc+LPS组小鼠血清IL-1β浓度无显著差异[(66.730±16.716)ng/Lvs(58.590±4.508) ng/L,Pgt;0.05],见表2。
6TNFR-Fc对BALF与血清IL-6浓度的影响
LPS组与TNFR-Fc+LPS组小鼠BALF中IL-6浓度在气管内滴入LPS后2 h与0 h相比均显著上升[(61.730±15.422)ng/Lvs(1 440.150±184.585)ng/L,Plt;0.05;(60.190±14.273)ng/Lvs(468.370±123.615)ng/L,Plt;0.05]。在滴入LPS后2 h,TNFR-Fc+LPS组小鼠BALF中IL-6浓度显著低于LPS组[(468.370±123.615)ng/Lvs(1 440.150±184.585)ng/L,Plt;0.05]。
LPS组与TNFR-Fc+LPS组小鼠血清IL-6浓度在气管内滴入LPS后2 h与0 h相比显著升高[(20.290±2.246)ng/Lvs(1 739.030±423.206)ng/L,Plt;0.05];(19.370±2.183)ng/Lvs(1 073.480±156.062)ng/L,Plt;0.05]。在滴入LPS后2 h,TNFR-Fc+LPS组小鼠血清IL-6浓度显著低于LPS组[(1 073.480±156.062)ng/Lvs(1 739.030±423.206) ng/L,Plt;0.05],见表2。
7TNFR-Fc对BALF与血清IL-10浓度的影响
LPS组与TNFR-Fc+LPS组小鼠BALF中IL-10浓度在气管内滴入LPS后2 h与0 h相比均无显著差异(Pgt;0.05)。在滴入LPS后2 h,LPS组与TNFR-Fc+LPS组小鼠BALF中IL-10浓度无显著差异[(264.460±51.147)ng/Lvs(348.520±76.894)ng/L;Pgt;0.05]。
LPS组与TNFR-Fc+LPS组小鼠血清IL-10浓度在气管内滴入LPS后2 h与0 h相比均显著升高[(211.310±10.753) ng/Lvs(958.130±125.345) ng/L,Plt;0.05;(209.480±10.466) ng/Lvs(1 522.520±86.189) ng/L,Plt;0.05]。在滴入LPS后2 h,TNFR-Fc+LPS组小鼠血清IL-10浓度显著高于LPS组[(1 522.520±86.189) ng/Lvs(958.130±125.345) ng/L,Plt;0.05],见表2。
8TNFR-Fc对BALF与血清IFN-γ浓度的影响
LPS组与TNFR-Fc+LPS组小鼠BALF中IFN-γ浓度在气管内滴入LPS后2 h与0 h相比均无显著改变(Pgt;0.05)。在滴入LPS后2 h,LPS组与TNFR-Fc+LPS组小鼠BALF中IFN-γ浓度无显著差异[(93.680±8.792)ng/Lvs(90.810±13.654)ng/L;Pgt;0.05]。
LPS组小鼠血清IFN-γ浓度在气管内滴入LPS后2 h与0 h相比无显著差异[(86.040±6.779)ng/Lvs(107.970±11.920)ng/L,Pgt;0.05]。TNFR-Fc+LPS组小鼠血清IFN-γ浓度在气管内滴入LPS后2 h与0 h相比显著升高[(88.130±7.177)ng/Lvs(119.150±16.533)ng/L,Plt;0.05]。在LPS处理后2 h,LPS组小鼠血清IFN-γ浓度与TNFR-Fc+LPS组相比无显著差异[(107.970±11.920)ng/Lvs(119.150±16.533)ng/L,Pgt;0.05],见表2。
讨 论
多种感染因素均可引起ALI,但近年来认为ALI的直接原因并不是病原微生物对组织细胞的直接破坏,而是机体对病原微生物产生不适当的免疫应激,尤其是过度的炎症反应。因此,针对ALI的病理生理过程,进行适当的免疫调控或有助于减轻过度炎症反应对肺组织损伤。
TNF-α是炎症反应激活后迅速释放的快反应炎症介质。当细胞接受炎症信号,TNF-α迅速表达及释放,初次释放的TNF-α可与其它炎症细胞的TNFR结合,启动机体的免疫应激,正反馈放大炎症反应[1]。众多基础研究支持血清或肺泡灌洗液中TNF-α浓度与ALI严重程度正相关[3]。中和过高浓度的游离TNF-α,控制炎症损伤从而降低ALI危害是目前争议较多的一种治疗策略[4,5]。在本研究中,以气管内滴入LPS复制ALI小鼠模型,采用代表性的TNFR-Fc中和游离TNF-α,评价中和TNF-α对ALI的炎症反应调节作用与肺保护效应。
TNFR-Fc是TNFR的膜外区与IgG的Fc段形成的融合蛋白,能有效降低外周血游离TNF-α浓度,已普遍应用于因TNF-α分泌异常引起的免疫性疾病,如类风湿性关节炎、强直性脊柱炎、Crohn病等[6,7]。在本研究中,提前24 h进行TNFR-Fc腹腔内注射能有效地降低ALI小鼠血清TNF-α浓度,但仍高于对照组,说明上述TNFR-Fc预处理未完全清除循环中的TNF-α,避免了“零浓度”TNF-α导致的免疫功能缺失。同时,气管内滴入LPS导致明显的肺组织结构破坏,肺组织大片坏死,大量血管床破坏,而在中和TNF-α后,肺组织病理性破坏显著减轻,ALI评分下降,客观地呈现中和TNF-α对肺组织的保护作用。肺泡蛋白渗出是血管通透性增加的结果,其变化规律与病理损伤一致。LPS气管内滴入显著增高BALF中蛋白浓度,证实ALI时有明显的血管损伤;中和TNF-α则明显减轻炎症反应引起的血管破坏,蛋白渗出减少。但ALI时肺水肿程度与肺病理损伤变化不同步。气管内滴入LPS后肺湿/干重比例仅稍有升高,中和TNF-α后肺湿/干重比例仅轻度降低。我们考虑气管内滴入LPS诱导的肺内性ALI以肺组织结构破坏为主,肺组织大片坏死,大量血管床破坏,此部分缺乏血管反应,炎症渗出程度较低,因此整体的肺水肿程度增高并不明显。而给予TNFR-Fc预处理只能对非坏死区域的肺组织起作用,部分减轻间质水肿。坏死区域“平均化”了LPS引起的肺间质水肿,无法清晰地显示出中和TNF-α而减轻肺水肿的作用。
IL-6是一个在ALI的发生、发展过程中起着重要作用的促炎细胞因子,促进了ALI的组织破坏[8]。IL-6能诱导急性期反应蛋白的合成,其血清水平可作为判断严重感染预后的指标[9]。在本研究中,小鼠在气管滴入LPS后BALF与血清IL-6水平均迅速升高,而TNFR-Fc预处理能有效地降低IL-6浓度,提示中和TNF-α有利于下调炎症反应。IL-1β与IFN-γ是另外两个上调炎症反应的细胞因子。在本研究中,气管内滴入LPS均未明显增高BALF及血清IL-1β、IFN-γ浓度,而且TNFR-Fc预处理也未能影响BALF及血清IL-1β、IFN-γ浓度,提示TNFR-Fc对炎症反应的干预并不通过IL-1β或IFN-γ起作用。
IL-10是有显著炎症反应抑制作用的细胞因子。在炎症反应激活时IL-10也随之表达。炎症反应激活及免疫细胞的活化有利于病原微生物的清除,但可能损伤机体正常细胞[10]。IL-10能控制炎症过度放大,避免炎症反应损伤机体正常组织细胞。在本研究中,LPS激活炎症反应伴随血清IL-10浓度升高,TNFR-Fc预处理使其浓度更高,提示中和TNF-α能有效减低ALI的炎症反应程度。此外,我们发现无论在BALF中或血清中,LPS均可显著地升高IL-6与IL-10的比值(本文未显示此数据)。以IL-6为代表的促炎因子与以IL-10为代表的抑炎因子比值反映了ALI存在炎症反应失衡——促炎反应过度活化与抑炎作用相对不足。而TNFR-Fc预处理则显著地降低BALF及血清中IL-6/IL-10比值(本文未显示此数据),提示中和TNF-α、减轻ALI结构细胞损伤与恢复促炎反应与抑炎症反应的平衡密切相关。
综上所述,由LPS诱发的ALI中存在过度放大的炎症反应而导致结构细胞的损伤。TNFR-Fc通过中和过量的TNF-α,下调由TNF-α介导的炎症反应放大过程,重建以IL-6与IL-10为代表的促炎/抑炎平衡,从而减轻LPS引起的全身与肺局部炎症反应,有效地减轻肺泡渗出与肺组织结构破坏,提示对ALI的病理生理过程进行适当的免疫干预有可能成为治疗ALI的新策略。
[1]Murphy TJ, Paterson HM, Kriynovich S,et al. Linking the “two-hit” response following injury to enhanced TLR4 reactivity [J]. J Leukoc Biol, 2005, 77(1):16-23.
[2]Mikawa K, Nishina K, Takao Y, et al. ONO-1714, a nitric oxide synthase inhibitor, attenuates endotoxin-induced acute lung injury in rabbits [J]. Anesth Analg,2003, 97(6):1751-1755.
[3]陈业民, 黄文杰, 李胜利, 等. 重症肺炎大鼠干扰素-γ、白细胞介素-6和肿瘤坏死因子-α含量变化 [J]. 中国病理生理杂志,2007, 23(3):492-494.
[4]Dentener MA, Creutzberg EC, Pennings HJ, et al. Effect of infliximab on local and systemic inflammation in chronic obstructive pulmonary disease: a pilot study [J]. Respiration,2008, 76(3):275-282.
[5]Deveci F, Muz MH, Ilhan N, et al. Evaluation of the anti-inflammatory effect of infliximab in a mouse model of acute asthma [J]. Respirology,2008, 13(4):488-497.
[6]Genovese MC, Cohen S, Moreland L, et al. Combination therapy with etanercept and anakinra in the treatment of patients with rheumatoid arthritis who have been treated unsuccessfully with methotrexate [J]. Arthritis Rheum,2004, 50(5):1412-1419.
[7]Lyseng-Williamson KA, Foster RH. Infliximab: a pharmacoeconomic review of its use in rheumatoid arthritis [J]. Pharmacoeconomics,2004, 22(2):107-132.
[8]Imai Y, Kuba K, Neely GG, et al. Identification of oxidative stress and Toll-like receptor 4 signaling as a key pathway of acute lung injury [J]. Cell,2008, 133(2):235-249.
[9]Barriere SL, Lowry SF. An overview of mortality risk prediction in sepsis [J]. Crit Care Med,1995, 23(2):376-393.
[10]Couper KN, Blount DG, Riley EM. IL-10: the master regulator of immunity to infection [J]. J Immunol,2008, 180(9): 5771-5777.
ProtectiveroleofTNFR-Fcinmouseacutelunginjuryinducedbylipopolysaccharide
YUAN Wei-feng1,2, LI li1, XU Hong1,2, HUANG Wen-jie1
(1DepartmentofRespiratoryMedicine,GuangzhouGeneralHospitalofGuangzhouMilitaryCommand,Guangzhou510010,China;2PostgraduateInstituteofSouthernMedicalUniversity,Guangzhou510515,China.E-mail:huangyelu1029@vip.163.com)
AIM: Acute lung injury (ALI) is associated with excessive inflammation caused by high tumor necrosis factor α(TNF-α) concentration. We hypothesized that anti-TNF-α therapy would have beneficial effects on mouse ALI model via down-regulating the inflammation.METHODSLipopolysaccharide(LPS,5 mg/kg) was intratracheally administered to BALB/c mice (8~10 weeks old). Twenty-four hours before LPS treatment, the mice were intraperitoneally injected with TNF receptor-Fc fusion protein(TNFR-Fc) once at a dose of 0.4 mg/kg. Wet to dry ratio of the lung tissues and protein concentration in bronchoalveolar lavage fluid(BALF) were detected. The histological changes of the lung tissues were also observed to evaluate lung injury. The concentration of TNF-α in serum as well as interleukin-1β(IL-1β), IL-6, IL-10 and interferon γ(IFN-γ) in BALF and serum were measured by ELISA.RESULTSTNFR-Fc treatment significantly decreased the concentration of serum TNF-α (Plt;0.05), the score of the lung histology and protein concentration in BALF (Plt;0.05). However, the wet to dry ratio of the lung was not obviously changed. The level of IL-6 was decreased both in BALF (Plt;0.05) and in serum (Plt;0.05) after TNFR-Fc treatment. The concentration of IL-10 increased significantly in serum (Plt;0.05) but not in BALF (Pgt;0.05). The concentrations of IL-1β and IFN-γ in BALF and serum were not obviously affected by TNFR-Fc treatment.CONCLUSIONTreatment with TNFR-Fc significantly attenuates LPS-induced ALI via affecting the expression of IL-6 and IL-10.
Tumor necrosis factor receptor-Fc fusion protein; Acute lung injury; Inflammation
1000-4718(2011)12-2387-05
R363
A
10.3969/j.issn.1000-4718.2011.12.028
2011-04-18
2011-10-09
国家自然科学基金资助项目(No. 81070003)
Tel: 020-36653555; E-mail: huangyelu1029@vip.163.com
