TGF-β1在雷奈酸锶促进大鼠骨髓间充质干细胞向成骨细胞分化中的作用*
2011-12-23王小娜兰爱平
王小娜, 李 正, 王 瑒, 兰爱平, 吴 文
(1 南方医科大学,广东 广州510515;2广东省医学科学院,广东省人民医院东病区内分泌科,广东 广州510080;3中山大学中山医学院生理学教研室,广东 广州510080)
雷奈酸锶(strontium ranelate,Sr)是一种新型的抗骨质疏松药物,具有抑制破骨细胞骨吸收和促进成骨细胞骨形成的双重作用[1]。临床试验表明,它能够降低绝经后妇女发生椎体骨折和非椎体骨折的风险,同时能预防骨量减低[2-3]。已有研究表明锶可通过细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)和p38 丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路调节成骨细胞特异性转录因子Runx2 的转录活性,Runx2 则调节下游成骨蛋白,如骨钙素(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)Ⅱ型胶原(collagen type Ⅱ,Col Ⅱ)的表达,促进MSCs 的成骨分化[4-5]。而近年发现转化生长因子(transforming growth factor β1,TGF-β1)在大鼠骨髓间充质干细胞(rat bone marrow mesenchymal stem cells,rBMSCs)成骨分化过程中也起着重要作用,具有促进细胞增殖、调节细胞分化、促进细胞外基质合成和调节机体免疫作用[6]。体外实验表明,TGF-β1可促进骨膜间充质干细胞的增殖分化,促进成骨(软骨)细胞的增殖,刺激Runx2、I 型胶原、骨连结素(ostocnectin)和OPN 的合成。同时,可抑制破骨细胞的生成以及成熟破骨细胞的活性,从而抑制骨吸收作用,并降低成脂标志物的表达[7]。由此可见,TGF-β1在骨组织代谢过程中起着十分重要的作用。然而,Sr能否通过TGF-β1促进rBMSCs 向成骨细胞分化尚未见报道。为此,本文旨在重点探讨:(1)Sr 对rBMSCs TGF-β1表达的影响;(2)TGF-β1是否在Sr 促进rBMSCs 向成骨细胞分化中起作用,以便为Sr 的促成骨作用机制提供实验资料。
材 料 和 方 法
1 主要材料
Sr 干混悬剂由Servier 公司提供;4 周龄雄性SD大鼠购自中山大学实验动物中心;DMEM/F12 培养基、胎牛血清、胰蛋白酶购自Gibico;青霉素、链霉素购自华北制药;细胞裂解液、地塞米松、维生素C、β-甘油磷酸钠、二甲基亚砜(dimethyl sulphoxide,DMSO)购自Sigma;碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒购自南京建成生物工程研究所;细胞茜素红钙染色试剂盒购自上海杰美基因医药有限公司;兔抗大鼠TGF-β1单克隆抗体和SB431542 购自Bioworld。
2 主要方法
2.1 rBMSCs 的分离培养及传代 取4 周龄,雌雄不限SD 大鼠颈推脱臼处死,75%乙醇浸泡10 min,无菌条件下剪除双侧股骨和胫骨,剔除其表面肌肉及软组织,用10 mL 注射器吸取含有10%胎牛血清、1 ×105U/L 青霉素G、100 mg/L 链霉素的DMEM/F12 培养液冲洗骨髓腔,直至骨髓腔发白。移至15 mL离心管,1 000 r/min 离心10 min,制成单细胞悬液,以(1 ~3)×105cells/cm2接种于25 cm2的培养瓶中。在37℃、5% CO2培养箱内进行培养。24 h后半量换液,以后每2 ~3 d 换1 次液,至细胞融合至80%时,用成骨诱导液(含10-8地塞米松、0.2 mmol/L维生素C 和10 mmol/L β-甘油磷酸钠)培养rBMSCs[8]。本实验原代rBMSCs 培养1 ~2 d 即可见到细胞贴壁,4 ~5 d 观察到成纤维细胞集落形成,悬浮的淋巴细胞等造血系细胞经过换液操作后大部分被去除,9 ~11 d 细胞集落间相互融合成单层,形态多为梭形成纤维细胞。
2.2 ALP 的测定 取培养第3 ~5 代的细胞,以1 ×108/L 的密度接种于96 孔板,每孔200 μL,每孔设4个复孔。检测时将细胞洗涤后以0.2 % Triton X-100 裂解液及反复冻融法充分裂解,裂解液经低温离心机12 000 ×g 离心10 min,取上清50 μL ,按试剂盒说明书进行操作,于酶标仪520 nm 波长处测定ALP 值。
2.3 细胞茜素红钙结节染色 取培养第3 ~5 代细胞,调整细胞浓度为1 × 108/L ,接种于6 孔板,6 孔板底部预先置入消毒过的载玻片,给予相应的处理因素后第21 d 按照细胞茜素红钙结节染色试剂盒说明书对样本进行固定、染色及澄清处理,倒置显微镜下观察钙结节染色情况,每组取4 个样本,每样本随机取1 个视野(×100),比较各组间的差异。
2.4 Western blotting 检测TGF-β1表达及半定量分析 收集的细胞用冰冷的PBS 洗涤细胞2 次,加适量细胞裂解液,在冰上将细胞迅速刮下,将裂解产物移至EP 管,10 000 r/min 离心10 min,吸出上清液体,用BCA 方法进行蛋白质浓度测定。将提取的蛋白质样品加入等体积上样缓冲液,100 ℃煮5 min,在15%聚丙烯酰氨凝胶电泳,电泳后将胶上所需蛋白条带转印至PVDF 膜。PVDF 膜用5%脱脂奶粉室温下封闭90 min,加入1∶1 000 稀释的抗TGF-β1的Ⅰ抗,置于4 ℃孵育过夜。用含0.1%吐温-20 的TBST 缓冲液(TBS/T)洗膜3 次,每次5 min。然后加入辣根过氧化物酶标记的Ⅱ抗,以1∶2 500 稀释,室温孵育90 min,TBS/T 洗膜3 次,每次5 min。最后采用增强化学发光法(ECL)显影,扫描检测蛋白表达状况。用Smartview 软件分析目标条带灰度值,与内参照actin 条带灰度值校正后进行半定量分析。
3 统计学处理
结 果
1 Sr 增加rBMSCs ALP 活性
图1 显示,应用0. 1 ~7 mmol/L Sr 分别处理rBMSC 7 d,均能明显增加ALP 活性,与对照组比较,差异均有统计学意义(均P <0.05)。其中3 mmol/L Sr 对ALP 活性的促进作用最大。

Figure 1. Effects of strontium ranelate (Sr)at different concentrations on activity of ALP in BMSCs of rats. #P <0.05,##P <0.01 vs control.图1 不同浓度Sr 对rBMSCs ALP 活性的影响
2 Sr 促进rBMSCs 的钙结节形成
图2 显示,3 mmol/L Sr 处理rBMSCs 21 d,可明显地增加钙结节的数量及面积。
3 Sr 对rBMSCs TGF-β1 表达的影响
图3A 显示,应用0.1 ~5 mmol/L Sr 处理rBMSCs 7 d 均可明显上调TGF-β1表达,其中1 mmol/L Sr 对TGF-β1表达的上调作用最大,TGF-β1表达是对照组的3.1 倍(P <0.01)。但是,7 mmol/L Sr对TGF-β1表达无明显作用(P >0.05)。图3B 显示,在应用1 mmol/L Sr 处理rBMSCs 1 ~7 d,Sr 呈时间依赖性地上调TGF-β1表达,其中处理细胞7 d 时,TGF-β1的表达水平达到最高峰。然而,1 mmol/L Sr 处理rBMSCs 10 d 时对TGF-β1表达无明显影响。
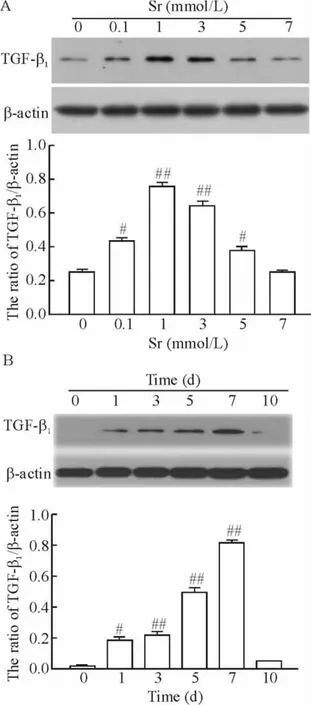
Figure 3. Effects of Sr on expression of TGF-β1 in BMSCs.A:rBMSCs were treated with Sr at 0.1 to 7 mmol/L for 7 d;B:rBMSCs were treated with 1mmol/L Sr for 1 to 7 d. ±s.n=6. #P <0.05,##P <0.01 vs control.图3 Sr 对rBMSCs TGF-β1 表达的影响
4 TGF-β1 抑制剂拮抗Sr 对TGF-β1 表达的上调作用
图4 显示,应用1 mmol/L Sr 处理rBMSCs 7 d 可明显上调TGF-β1的表达(P <0.01);在Sr 处理细胞前2 h,应用10 μmol/L SB431542(TGF-β1抑制剂)预处理细胞可显著地阻断Sr 对TGF-β1表达的上调作用;10 μmol/L SB431542 或DMSO 对TGF-β1的基础表达水平无明显影响。
5 TGF-β1 抑制剂拮抗Sr 对ALP 活性的促进作用
图5 显示,应用1 mmol/L Sr 处理rBMSCs 7 d 可明显增加ALP 活性,与对照组比较,差异有统计学意义(P <0.05);在Sr 处理细胞前2 h,用10 μmol/L SB431542(TGF-β1抑制剂)预处理细胞可明显地抑制Sr 对ALP 活性的促进作用,与Sr 处理组比较,差异显著(P <0.05)。10 μmol/L SB431542 或DMSO对ALP 活性无明显的作用。
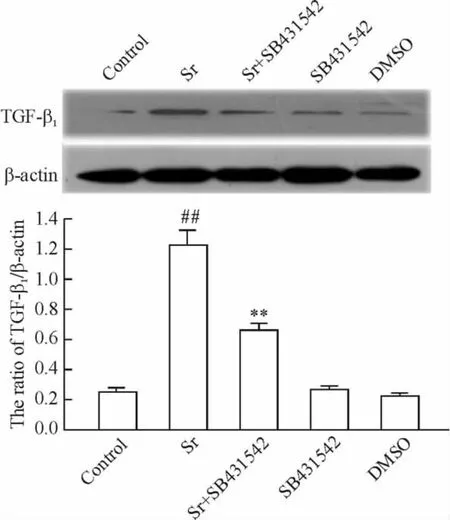
Figure 4. SB431542(inhibitor of TGF-β1,10 μmol/L)preconditioning inhibited Sr-induced overexpression of TGF-β1 in rBMSCs.Sr:rBMSCs were treated with 1 mmol/L Sr for 7 d;Sr+SB431542:rBMSCs were pretreated with SB431542 for 2 h,followed by the treatment with Sr(1 mmol/L)for 7 d;SB431542:rBMSCs were treated with SB431542 for 2 h and then with DMSO for 7 d;DMSO:rBMSCs were cultured with DMSO for 7 d. ±s.n=5. ##P <0.01 vs control;**P <0.01 vs Sr.图4 TGF-β1 抑制剂阻断Sr 对rBMSCs TGF-β1 表达的上调作用
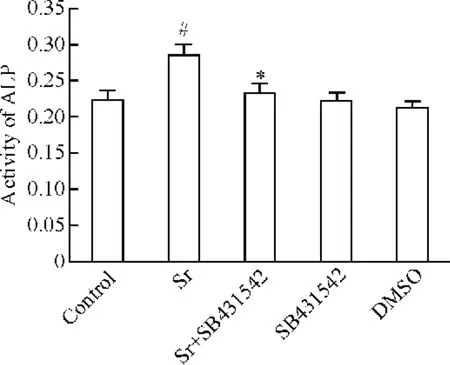
Figure 5. Preconditioning with SB431542(10 μmol/L)inhibited Sr-induced activity enhancement of ALP in BMSCs.Sr:rBMSCs were treated with 1 mmol/L Sr for 7 d;Sr+SB431542:rBMSCs were pretreated with SB431542 for 2 h,followed by the treatment with Sr(1 mmol/L)for 7 d;SB431542: rBMSCs were treated with SB431542 for 2 h and then with vechicle for 7 d;DMSO:rBMSCs were cultured by DMSO for 7 d. ±s.n=5. #P <0.05 vs control;* P <0.05 vs Sr.图5 TGF-β1 抑制剂阻断Sr 对ALP 活性的增强作用
6 TGF-β1 抑制剂阻断Sr 对钙结节形成的促进作用
图6 显示,1 mmol/L Sr 处理rBMSCs 21 d 可显著的增加钙结节的数量;在Sr 处理细胞前2 h,应用TGF-β1抑制剂SB431542(10 μmol/L)预处理细胞能明显地抑制Sr 对钙结节形成的促进作用;10 μmol/L SB431542 或DMSO 本身对钙结节数量无明显影响。
讨 论
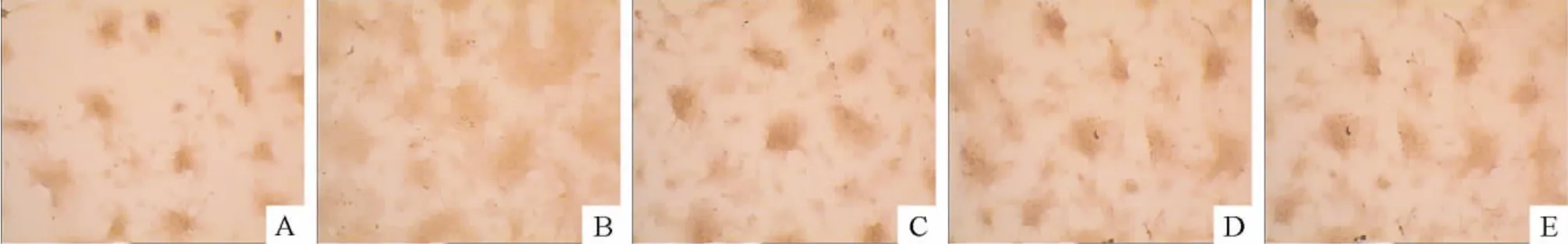
Figure 6. Preconditioning with SB431542(10 μmol/L)inhibited Sr-induced mineralization in BMSCs(alizarin red staining,×100).A:control;B:rBMSCs were treated with 1 mmol/L Sr for 21 d;C:rBMSCs were pretreated with SB431542 for 2 h,followed by the treatment with Sr(1 mmol/L);D:rBMSCs were treated with SB431542 for 2 h and then with DMSO for 21 d;D:rBMSCs were cultured by DMSO for 21 d.图6 TGF-β1 抑制剂(SB431542)对钙结节形成的影响
ALP 是细胞成骨分化的一个早期指标,是调节细胞矿化的重要酶之一。本研究采用ALP 及钙结节形成作为判断rBMSCs 向成骨细胞分化的指标。研究结果表明,新型的抗骨质疏松剂Sr 能明显的增加rBMSCs 的ALP 活性及钙结节数量,提示Sr 具有促进rBMSCs 向成骨细胞分化的作用,这与文献报道[1,4-5,9-11]的结果一致。TGF-β1属于转化生长因子β(TGF-β)超家族成员之一,它是一个分泌型多肽信号分子,生物活性极其广泛,能调控多种间充质来源的细胞增殖和定向分化、尤其是在细胞成骨分化、骨基质合成和骨重建中起着重要的作用,是调控rBMSCs 的首选生长因子之一[10,12]。TGF-β1也是人类骨骼中含量最丰富的生长因子,通过影响rBMSCs 向成骨细胞方向的转化而影响正常及病理下的骨骼形态[13]。已有研究表明,TGF-β1可能在锶促进rBMSCs 向成骨细胞分化的过程中起着重要的作用[9]。但是,TGF-β1在Sr促进rBMSCs 向成骨细胞分化中的作用如何迄今未见报道。根据本研究得出的结果,我们推测TGF-β1可能参与Sr 促进rBMSCs 向成骨细胞分化的过程。本研究在应用Sr 处理rBMSCs 前,用TGF-β1特异性抑制剂SB431542 预处理细胞,结果表明,TGF-β1抑制剂不仅能阻断Sr 对rBMSCs TGF-β1表达的上调作用,而且能抑制Sr 对ALP 活性及钙结节形成的促进作用,提示通过上调TGF-β1表达可能是Sr 促进rBMSCs 向成骨细胞分化的重要作用机制之一。
然而,对于TGF-β1在调节成骨中的作用有不同的意见。Shingo 等[14]认为,TGF-β1对于骨形成具有促进和抑制的双重作用[11]。TGF-β1也能促进rBMSCs 的迁移,具有促进骨形成和骨吸收的双重作用[15]。但是,Zhao 等[7]却观察到TGF-β1可促进鼠类BMSCs 的成骨分化,表现在它能增加Runx2、OPN 及Col I mRNA 表达及ALP 活性。因此,有关TGF-β1在促进rBMSCs 向成骨细胞分化中的作用仍需作进一步的探讨。
综上所述,本研究证实Sr 可促进rBMSCs 向成骨细胞分化,此作用可能与其上调TGF-β1表达有关。本文为深入阐明Sr 的促成骨机制提供了实验依据。
[1] Bonnelye E,Chabadel A,Saltel F,et al. Dual effect of strontium ranelate:stimulation of osteoblast differentiation and inhibition of osteoclast formation and resorption in vitro[J].Bone,2008,42(1):129-138.
[2] Seeman E,Vellas B,Benhamou C,et al.Strontium ranelate reduces the risk of vertebral and nonvertebral fractures in women eighty years of age and older[J]. J Bone Miner Res,2006,21(7):1113-1120.
[3] Caverzasio J,Thouverey C. Activation of FGF receptors is a new mechanism by which strontium ranelate induces osteoblastic cell growth[J]. Cell Physiol Biochem,2011,27(3-4):243-250.
[4] 廖清船,肖洲生,秦艳芳,等.p44/42 和p38 MAPK 在骨髓间充质干细胞向成骨细胞分化中发挥不同的功能[J].中国骨质疏松杂志,2004,10(3):267-271.
[5] Peng S,Zhou G,Luk KD,et al.Strontium promotes osteogenic differentiation of mesenchymal stem cells through the ras/MAPK signaling pathway[J]. Cell Physiol Biochem,2009,23(1-3):165-174.
[6] Tachi K,Takami M,Sato H,et al. Enhancement of bone morphogenetic protein-2-induced ectopic bone formation by transforming growth factor-β1[J]. Tissue Eng Part A,2011,17(5-6):597-606.
[7] Zhao L,Jiang S,Hantash BM,et al. Transforming growth factor β1induces osteogenic differentiation of murine bone marrow stromal Cells[J]. Tissue Eng Part A,2010,16(2):725-733.
[8] 张丽蓉,夏文杰,项 鹏,等.体外定向诱导人骨髓间充质干细胞分化为成骨细胞的研究[J],中国病理生理杂志,2002,18(7):745-748.
[9] Lee KS,Kim HJ,Li QL,et al.Runx2 is a common target of transforming growth factor β1and bone morphogenetic protein 2,and cooperation between Runx2 and Smad5 induces osteoblast-specific gene expression in the pluripotent mesenchymal precursor cell line C2C12[J]. Mol Cell Biol,2000,20(23):8783-8792.
[10] Kim MK,Niyibizic. Znteraction of TGF-β1and rhBMP2 on human bone marrow stromal cells cultured in collagen gel matrix[J].Yonsei Med J,2001,42(3):338-344.
[11] Sila-Asna M,Bunyaratvej A,Maeda S,et al. Osteoblast differentiation and bone formation gene expression in strontium-inducing bone marrow mesenchymal stem cell[J].Kobe J Med Sci,2007,53(1-2):25-35.
[12] 潘海涛,郑启新,郭晓冬,等.兔骨髓基质干细胞的分离培养和鉴定及转化生长因子β1的基因瞬时转染研究[J].医学研究生通报,2006,19(6):508-511.
[13] Kanaan RA,Kanaan LA. Transforming growth factor beta1,bone connection[J]. Med Sci Monit,2006,12(8):RA164-RA169.
[14] Shingo Maeda,Makoto Hayashi,Setsuro Komiya,et al.Endogenous TGF-β1signaling supresses maturation of osteoblastic mesenchymal cells[J].EMBO J,2004,23(3):552-563.
[15] Tang Y,Wu X,Lei W. TGF-β1-induced migration of bone mesenchymal stem cells couples bone resorption and formation[J].Nat Med,2009,15(7):757-765.
