医用镍钛合金表面微弧氧化膜层的显微结构及耐蚀性
2011-11-16徐吉林刘福罗军明
徐吉林,刘福,罗军明
(1.南昌航空大学材料科学与工程学院,江西 南昌 330063;2.哈尔滨工业大学材料学院,黑龙江 哈尔滨 150001)
医用镍钛合金表面微弧氧化膜层的显微结构及耐蚀性
徐吉林1,*,刘福2,罗军明1
(1.南昌航空大学材料科学与工程学院,江西 南昌 330063;2.哈尔滨工业大学材料学院,黑龙江 哈尔滨 150001)
采用由NaAlO2和NaH2PO2组成的电解液,以微弧氧化技术在医用镍钛合金表面制备 Al2O3陶瓷膜层,以减少合金表面Ni含量,并进一步提高其耐腐蚀性能,使其具有良好的生物相容性。随微弧氧化过程中处理时间的延长,试样表面的游动火花由白色逐渐向橙色转变,火花数减少但尺寸增大。所得陶瓷膜层由 γ-Al2O3晶相组成,随着处理时间的延长,γ-Al2O3的结晶度增加,膜层表面粗糙度增大,表面微孔数逐渐减少而孔径增大。经60 min微弧氧化处理后,镍钛合金在Hank’s溶液中的自腐蚀电位比基体高142 mV,自腐蚀电流密度降低了近2个数量级,耐蚀性有了大幅提高。
医用镍钛合金;微弧氧化;氧化铝膜层;耐蚀性
1 前言
近等原子比的NiTi合金由于具有良好的形状记忆效应、超弹性、耐腐蚀性和生物相容性,在生物医用材料领域有着广阔的应用前景[1]。但是近年来有研究表明,Ni含量占近50%(原子分数)的NiTi合金植入人体后,由于体液对植入体表面腐蚀可造成Ni离子析出而进入人体组织和器官,使人体发生中毒或过敏反应,甚至致癌[2]。为了抑制Ni离子的释放,进一步提高NiTi合金的耐腐蚀性能,表面改性是最为有效的方法。对NiTi合金进行表面改性研究的方法已有大量报道,如热氧化、溶胶–凝胶、激光表面改性、等离子浸没注入和阳极氧化[3-7]等。这些方法各有优缺点,但都不能很好地满足临床的需求。
近年来,微弧氧化技术在Al、Mg、Ti及其合金的表面改性研究中引起了国内外学者的广泛关注。微弧氧化是将Ti、Mg、Al等阀金属或其合金置于电解质水溶液中,利用电化学方法在该材料的表面微孔中产生火花放电斑点,在热化学、等离子体化学和电化学的共同作用下,原位生成陶瓷膜的方法[8]。研究表明,微弧氧化技术可以在形状复杂的钛植入材料表面形成均匀的陶瓷膜层,有效地提高植入材料的耐腐蚀和耐磨性能,且表面粗糙多孔有利于细胞附着、增殖及长入,提高植入体的生物相容性[9]。此外,微弧氧化制备的膜层与基体具有良好的结合力,这是其他改性方法所无法比拟的。随着微弧氧化技术的不断发展,用该法处理的材料种类也增多,不仅仅是阀金属及其合金(如铝基复合材料、镁基复合材料及锆基金属陶瓷[10-12]等),形成的陶瓷膜层也不仅仅只是消耗基体而得到的基体的氧化物陶瓷膜(如镁合金表面制备氧化钛和钛合金表面制备氧化铝[13-14]等)。
氧化铝具有优良的耐磨、耐腐蚀性能及良好的生物相容性,常用于承重髋和膝关节置换体及牙科植入体。本文通过微弧氧化技术在医用NiTi合金表面制备氧化铝陶瓷膜层,并通过扫描电镜、粗糙度仪、X射线衍射仪和电化学工作站考察了微弧氧化处理时间对微弧氧化膜层表面形貌、粗糙度、相组成及耐腐蚀性能的影响。
2 实验
2. 1 材料及设备
以商业医用10 mm × 10 mm × 1 mm的50.8%Ni–Ti合金(Ni的原子分数为50.8%)作阳极,不锈钢内衬作阴极。试验采用双向脉冲微弧氧化装置,主要由高压脉冲电源(哈工大中俄中心研制)、自制不锈钢电解槽、搅拌系统(金坛市华城高尔实验仪器厂)和循环水冷却系统组成。
2. 2 试样制备
基体经800#砂纸打磨后,分别在丙酮、乙醇和蒸馏水中超声清洗10 min,干燥后放入电解液中进行微弧氧化处理。电解液由蒸馏水配制,含NaAlO20.015 mol/L和NaH2PO20.15 mol/L,在微弧氧化处理过程中电解液温度始终保持在35 °C以下,处理时间为2 ~ 60 min。微弧氧化过程采用恒压控制模式,工作电压400 V,工作频率60 Hz。
2. 3 性能测试
在微弧氧化过程中,采用NIKON D300专业数码相机(日本尼康)拍摄不同时间段的火花形态。将处理后的试样用自来水冲洗,再在PS-10超声清洗机(深圳洁康洗净电器有限公司)中清洗10 min,以去除膜层表面污染物,自然干燥后进行后续测试。采用S-4800扫描电镜(SEM,日立公司)观察不同工作电压下所得膜层的表面形貌。采用JB-4C表面粗糙度仪(广州市广精精密仪器有限公司)进行表面粗糙度 Ra测试。采用D/max-2500薄膜X射线衍射仪(Rigaku公司)对试样进行物相分析。用CHI604电化学工作站(上海辰华)对处理前后的试样在Hank’s溶液中进行动电位极化扫描,评价其耐腐蚀性能。电极体系为典型的三电极体系,饱和甘汞电极(SCE)作参比电极,铂片为辅助电极,测试试样(10 mm × 10 mm)为工作电极,扫速0.167 mV/s。Hank’s溶液的组成为:NaCl 8 g/L,KCl 0.4 g/L,MgSO4·7H2O、KH2PO4、Na2HPO4·2H2O各0.06 g/L,NaHCO30.35 g/L,葡萄糖1 g/L,MgCl2·6H2O 0.1 g/L, CaCl20.14 g/L。
3 结果与讨论
3. 1 微弧氧化过程中的火花演变
图 1是微弧氧化过程中不同处理时间段的火花形态。从2 min时,阳极试样表面已布满了细小的白色火花;10 min时,原有的细小白火花逐渐演变成大量的橙色火花,而细小白火花明显减少,火花的直径也有所增大;延长至30 min时,试样表面的白色火花已彻底消失,取而代之的是数量较少的大直径橙色火花;进一步延长至60 min后,火花进一步减少,而直径进一步增大,单个火花在某一点放电的持续时间也有所延长,即火花的移动速率减慢。这与阀金属及其合金微弧氧化处理的现象基本一致[8]。随着处理时间的延长,膜层厚度增大,致密度逐渐提高,击穿变得越来越困难,细小的火花已经难于击穿陶瓷膜层,只有将能量集中在一起,形成少量粗大的火花,微弧氧化才得以继续进行,这时微弧氧化处理过程中的微弧形成温度将进一步提高,有利于膜层的晶化和向更高温度的晶体转变。火花形态的变化体现了微弧氧化过程中放电通道的数量随着处理时间的延长逐渐减少,而直径增大。图 2中的表面形貌图即反应出微弧氧化过程的这一特点。
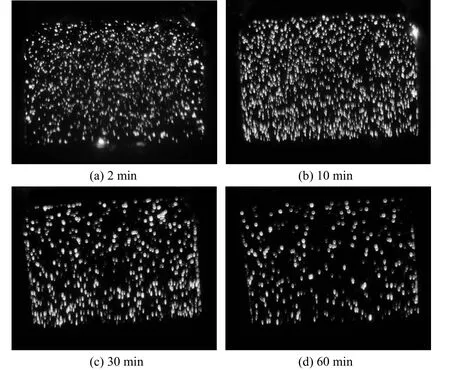
图1 微弧氧化过程中不同处理时间的火花形态Figure 1 Morphology of sparks at different treatment time during MAO process
3. 2 表面形貌与粗糙度

图2 微弧氧化过程中不同处理时间陶瓷膜层的表面形貌Figure 2 Surface morphologies of ceramic coating at different treatment time during MAO process

图3 处理时间对陶瓷膜层表面粗糙度的影响Figure 3 Effect of treatment time on surface roughness of ceramic coating
图2和图3分别为NiTi合金微弧氧化处理不同时间段所得陶瓷膜层的表面形貌和表面粗糙度。从中可以看出,NiTi合金表面微弧氧化2 ~ 60 min,其表面的陶瓷膜层均呈现粗糙多孔的形貌,但孔的数量和孔径大小随时间的变化而变化,其变化规律与微弧氧化处理过程中的火花演变规律一致。微弧氧化处理 2 min时,膜层表面均匀分布着大量直径小于1 μm的蜂窝状圆形小孔;10 ~ 30 min时,膜层的孔数减小但孔径增大,且孔径大小不再均一;延长到60 min时,膜层表面的孔径达到1 μm,形态显著改变,微孔周围有大量的堆积物,类似“火山口”形貌。从表面形貌可以看出,膜层的粗糙度随着时间的延长而增大,与图 3膜层表面粗糙度随处理时间变化的趋势一致。从图2可知,处理2 min得到的膜层表面粗糙度仅0.316 μm,处理10 ~ 60 min时膜层表面粗糙度缓慢增加,由0.337 μm增至0.35 μm。从图3还可看出,粗糙度的标准差随时间的延长而增大,这也说明膜层表面平整度随处理时间的延长而变差。
3. 3 物相组成

图4 微弧氧化过程不同处理时间陶瓷膜层的XRD图谱Figure 4 XRD patterns of ceramic coating at different treatment time during MAO process
不同时间段 NiTi合金表面微弧氧化膜层的 XRD图谱见图4。从图4可知,NiTi合金微弧氧化陶瓷膜层主要由γ-Al2O3晶相组成,且随处理时间的延长,其衍射峰强度增大。当NiTi合金微弧氧化仅处理2 min时,试样2θ = 45.9°、66.8°处各有一个非常小的衍射峰,说明γ-Al2O3结晶程度较差,且基体NiTi的衍射峰特别强,不仅在2θ = 42.2°有衍射峰,在2θ = 60.8°、77.4°也有衍射峰,说明Al2O3膜层较薄;延长到10 min后,基体的衍射峰急剧减弱,而γ-Al2O3的衍射峰增强,说明膜层厚度增大;处理60 min后,2θ = 37.4°处也出现衍射峰,说明γ-Al2O3的结晶程度得到进一步的提高。在NiTi合金上形成Al2O3膜层,其原理与在Ti合金上形成Al2O3以及在Mg合金表面形成TiO2是基本一致的,都是利用电解液成分强烈参与微弧氧化反应成膜,通过微弧氧化过程中的高温高压将电解液中的负电基团烧结到合金表面,形成氧化物陶瓷膜[13-14]。
3. 4 耐腐蚀性能
金属材料植入人体后,不可避免地要受体液的电化学腐蚀,这将极大地影响植入体的生物相容性。目前为止,用于体外试验的常用模拟体液主要有0.9%(质量分数)NaCl生理盐水、Hank’s溶液、Ringer's溶液和Tyrode’s溶液等,其中Hank’s溶液使用率最高,本文也选用Hank's溶液作介质,测定试样的Tafel曲线,结果见图5。表1是不同试样对应的腐蚀参数。

图5 不同处理时间所得陶瓷膜层在Hank’s溶液中的Tafel曲线Figure 5 Tafel curves for ceramic coating prepared for different treatment time in Hank’s solution
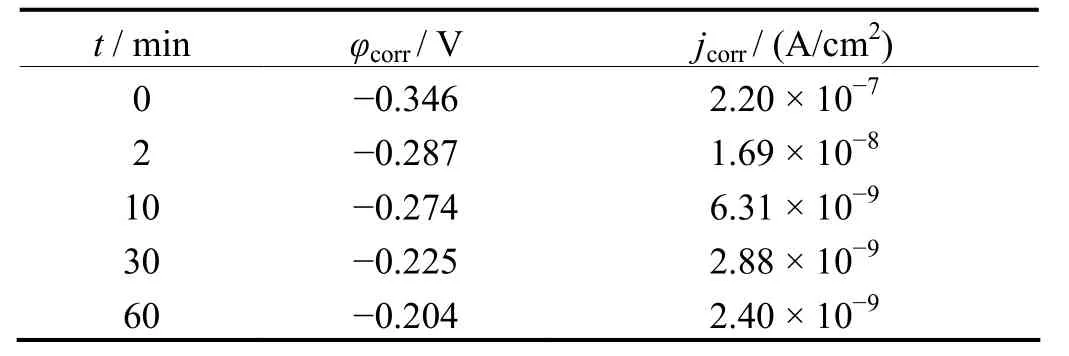
表1 不同处理时间所得陶瓷膜层的腐蚀电位和腐蚀电流密度Table 1 Corrosion potentials and current densities of ceramic coatings prepared by MAO for different time
从图 5可明显看出,与未处理的试样相比,微弧氧化处理后 NiTi合金试样的极化曲线整体都向小电流、正电位方向移动,说明微弧氧化处理后的试样耐腐蚀性能优于未处理试样。随着处理时间的延长,膜层的腐蚀电位正移,而腐蚀电流密度降低,说明延长微弧氧化处理时间有利于提高膜层的耐腐蚀性能。延长至60 min时,腐蚀电位较基体提高了142 mV,而腐蚀电流密度减小了近2个数量级,说明此时NiTi合金的耐蚀性大幅度改善。
综上所述,通过微弧氧化技术在医用NiTi合金表面形成粗糙多孔的Al2O3氧化陶瓷膜,有利于提高NiTi合金的生物相容性。一方面,Al2O3是一种惰性氧化陶瓷膜,植入人体后,不会与人体发生复杂的生理反应;另一方面,由于Ni离子的释放量取决于NiTi合金表面的Ni含量和植入体的耐腐蚀性能,经微弧氧化处理后,NiTi合金表面的Ni含量大幅度降低,且耐腐蚀性能明显提高,有利于抑制 Ni离子的溶出[15],增强了NiTi合金的生物安全性。另外,微弧氧化陶瓷膜表面粗糙多孔,将其作为硬组织替代材料时,有利于骨细胞的附着、增殖及长入,进一步提高其生物相容性。
4 结论
(1) 采用双向脉冲微弧氧化方法在50.8%Ni–Ti合金表面上制备了粗糙多孔的氧化陶瓷膜层,随处理时间的延长,膜层表面粗糙度逐渐增大,微孔数减少而孔径增大,其表面形貌的变化与微弧氧化处理过程中火花形态的演变规律一致。
(2) 陶瓷膜层主要由γ-Al2O3晶相组成,随着处理时间的延长,γ-Al2O3的衍射峰增强,结晶度提高。
(3) 微弧氧化处理后,NiTi合金的耐腐蚀性能大幅提高,且耐腐蚀性能随处理时间的延长而逐渐增强。处理60 min时,与基体相比,膜层在Hank’s溶液中的自腐蚀电位提高了142 mV,自腐蚀电流密度降低了近2个数量级。
[1] BRAILOVSKI V, TROCHU F. Review of shape memory alloys medical applications in Russia [J]. Bio-medical Materials and Engineering, 1996, 6 (4): 291-298.
[2] SHABALOVSKAYA S A. Surface, corrosion and biocompatibility aspects of Nitinol as an implant material [J]. Bio-medical Materials and Engineering, 2002, 12 (1): 69-109.
[3] FIRSTOV G S, VITCHEV R G, KUMAR H, et al. Surface oxidation of NiTi shape memory alloy [J]. Biomaterials, 2002, 23 (24): 4863-4871.
[4] CHENG F T, SHI P, MAN H C. Anatase coating on NiTi via a lowtemperature sol–gel route for improving corrosion resistance [J]. Scripta Materialia, 2004, 51 (11): 1041-1045.
[5] MAN H C, ZHANG S, CHENG F T, et al. In situ formation of a TiN/Ti metal matrix composite gradient coating on NiTi by laser cladding and nitriding [J]. Surface and Coatings Technology, 2006, 200 (16/17): 4961-4966.
[6] CHU P K. Plasma surface treatment of artificial orthopedic and caradiovascular biomaterials [J]. Surface and Coatings Technology, 2007, 201 (9/11): 5601-5606.
[7] CHENG F T, SHI P, MAN H C. Nature of oxide layer formed on NiTi by anodic oxidation in methanol [J]. Materials Letters, 2005, 59 (12): 1516-1520.
[8] YEROKHIN A L, NIE X, LEYLAND A, et al. Plasma electrolysis for surface engineering [J]. Surface and Coatings Technology, 1999, 122 (2/3): 73-93.
[9] SUL Y T. The significance of the surface properties of oxidized titanium to the bone response: special emphasis on potential biochemical bonding of oxidized titanium implant [J]. Biomaterials, 2003, 24 (22): 3893-3907.
[10] CUI S H, HAN J M, DU Y P, et al. Corrosion resistance and wear resistance of plasma electrolytic oxidation coatings on metal matrix composites [J]. Surface and Coatings Technology, 2007, 201 (9/11): 5306-5309.
[11] WU K, WANG Y Q, ZHENG M Y. Effects of microarc oxidation surface treatment on the mechanical properties of Mg alloy and Mg matrix composites [J]. Materials Science and Engineering A, 2007, 447 (1/2): 227-232.
[12] LIU L, LIU Z, CHAN K C, et al. Surface modification and biocompatibility of Ni-free Zr-based bulk metallic glass [J]. Scripta Materialia, 2008, 58 (3): 231-234.
[13] LIANG J, HU L T, HAO J C. Preparation and characterization of oxide films containing crystalline TiO2on magnesium alloy by plasma electrolytic oxidation [J]. Electrochimica Acta, 2007, 52 (14): 4836-4840.
[14] SUN X T, JIANG Z H, XIN S G, et al. Composition and mechanical properties of hard ceramic coating containing α-Al2O3produced by microarc oxidation on Ti–6Al–4V alloy [J]. Thin Solid Films, 2005, 471 (1/2): 194-199.
[15] WEVER D J, VELDHUIZEN A G, DE VRIES J, et al. Electrochemical and surface characterization of a nickel–titanium alloy [J]. Biomaterials, 1998, 17 (7/9): 761-769.
Microstructure and corrosion resistance of microarc oxidation coating on surface of biomedical nickel–titanium alloy /
XU Ji-lin*, LIU Fu, LUO Jun-ming
An Al2O3ceramic coating was prepared on the surface of biomedical titanium–nickel alloy by microarc oxidation in a NaAlO2–NaH2PO2electrolyte. As the treatment time extends during microarc oxidation, the color of the moving spark on the sample surface changes from white to orange, and the number of spark decreases while its size increases. The obtained ceramic coating is composed of γ-Al2O3crystal. As the treatment time extends, the crystallinity of γ-Al2O3increases, the ceramic coating surface become rougher, and the micropore distributed on the surface of ceramic coating becomes less in number but larger in size. The corrosion potential of nickel–titanium alloy is increased by 142 mV and the corrosion current density of it in Hank’s solution decreased by 2 orders of magnitude after microarc oxidation for 60 min, indicating that the corrosion resistance of nickel–titanium alloy is improved markedly.
biomedical titanium–nickel alloy; microarc oxidation; alumina coating; corrosion resistance
School of Materials Science and Engineering, Nanchang Hangkong University, Nanchang 330063, China
TG174.453
A
1004 – 227X (2011) 12 – 0041 – 04
2011–09–01
2011–09–27
国家自然科学基金(51101085)。
徐吉林(1982–),男,江西宁都人,博士,讲师,主要从事生物医用材料及表面改性研究。
作者联系方式:(E-mail) jlxu@nchu.edu.cn。
[ 编辑:周新莉 ]
