超高效液相色谱-串联质谱法检测饲料中盐酸可乐定和盐酸赛庚啶
2011-11-14李丹妮张文刚
李丹妮,张文刚,严 凤,顾 欣
(上海市兽药饲料检测所,上海 201103)
可乐定(图1)和赛庚啶(图2)都属合法的人医用药品。可乐定(Clonidine)是一种中枢神经系统肾上腺素能α2-受体激动剂,对α2-受体具有特异亲和性,属于咪唑啉衍生物。作为抗高血压药物,其药理作用主要为通过刺激脑干α2-肾上腺素受体导致交感神经从中枢神经系统的传出减少,从而降低外周阻力、肾血管阻力、心率以及血压,也有用于手术后的麻醉和镇痛[1-2]。赛庚啶为人用抗过敏药[3],对抗体内组胺对血管、支气管平滑肌的作用,从而消除过敏症状,也可用于改善患者的食欲。
近年开始出现将可乐定用于促进动物生长和改善酮体组成的研究[4-5],推断其主要的作用机理为通过促进下丘脑生长腺素神经元合成和释放生长腺素,进而调节腺垂体细胞内cAMP水平,从而调控生长激素分泌,促进生猪生长。动物研究表明在猪饲粮中添加0.5 mg/kg可乐定,能显著提高猪的瘦肉率和眼肌面积,降低脂肪比率和背膘厚,改善猪的胴体组成。赛庚啶是H1受体拮抗剂,属于抗组胺药,但同时也是5-羟色胺受体拮抗剂,可在下丘脑食欲中枢拮抗5-羟色胺,这可以解释赛庚啶具有刺激食欲的功能。目前在国内已发现将这两种药物违法添加在猪饲料中,2010年12月农业部1519号公告已明确把可乐定和赛庚啶列入了《禁止在饲料和动物饮水中使用的物质》清单。
目前已有关于血样和尿样中可乐定及赛庚啶检测方法的报道,主要采用高效液相色谱-串联质谱法(LC/MS/MS)[6-8]。国内已有采用高效液相色谱法(HPLC)检测饲料中盐酸可乐定和盐酸赛庚啶的方法[9-10]。本研究采用超高效液相色谱-串联质谱(UPLC/MS/MS)技术,建立了饲料中盐酸可乐定和盐酸赛庚啶的检测方法,液相色谱串联质谱方法通过采集离子碎片及丰度比,能够更准确进行定性确证,同时大大提高了检测的灵敏度,为准确定性定量提供了更好的方法。
1 材料和方法
1.1 仪器 超高效液相色谱-串联质谱仪UPLC/Qμattro Premier XE(Waters公司);MassLynx v4.1质谱工作站软件;漩涡振荡器;CL3R冷冻离心机(美国IEC公司);Laborota 4000旋转蒸发器(德国Heidolph公司)。
1.2 药品与试剂 盐酸可乐定对照品,纯度≥98%(Sigma公司);盐酸赛庚啶对照品,纯度≥98%(Sigma公司);乙腈色谱纯(Merck公司);甲酸,纯度96%(TEDIA);甲醇、盐酸、氨水均为分析纯(国药集团化学试剂有限公司);实验用水为超纯水。
1.3 实验方法
1.3.1 液相色谱 色谱柱:SB C18100 mm ×3.0 mm,粒径1.8 μm(美国 Agilent公司),柱温 40 ℃;进样量5 μL;流速0.3 mL/min;流动相为 A 相:乙腈;B相0.1%甲酸水溶液;梯度洗脱程序见表1。

表1 流动相洗脱程序
1.3.2 质谱参考条件 电喷雾离子源,正离子电离(ESI+);多反应监测(MRM);毛细管电压:3.0 Kv;离子源温度:110℃;脱溶剂气流量:700 L/h;锥孔气:50 L/h;去溶剂温度:350℃;碰撞气(Ar)流量0.24 mL/min;碰撞室压力:3.8 ×10-3Pa。分析中以保留时间和离子对(母离子和两个子离子)的信息比较进行定性分析;经过优化的质谱参数见表2。

表2 可乐定和赛庚啶的母离子、子离子及质谱参数
1.3.3 标准曲线 精密称取盐酸可乐定对照品,加入适量的水溶解,再用甲醇定容,配成含可乐定浓度约为1 mg/mL的标准贮备液,2~8℃冷藏保存,有效期六个月。赛庚啶贮备液配制:精密称取盐酸赛庚啶对照品,用甲醇配成含赛庚啶浓度约为1 mg/mL的标准贮备液,2~8℃冷藏保存,有效期六个月。分别吸取盐酸可乐定贮备液和盐酸赛庚啶贮备液适量,置于棕色容量瓶中,用乙腈:0.2%甲酸水溶液(20/80,V/V)稀释成可乐定和赛庚啶浓度均为 0.5、1.0、5.0、10.0、50.0 μg/L 的系列对照品工作液,现配现用。
1.3.4 样品的前处理 称取2.00 g试样于50 mL离心管中,准确加入20 mL盐酸甲醇提取液(甲醇:0.1 mol/L HCl=80 ∶20),充分振荡 20 min,然后于7 000 r/min离心10 min,上清液备用。MCX(3CC/60 mg)固相萃取小柱先用3 mL甲醇,3 mL水活化。取上清液2 mL过柱,用2 mL水和2 mL甲醇淋洗,空气抽干2 min,用5%氨水甲醇溶液5 mL洗脱,收集洗脱液,旋转蒸发(60℃)至干,用乙腈:0.2%甲酸水溶液(20/80,V/V)1 mL溶解,过0.22 μm滤膜后上机测定。若样品液中含有的药物浓度超出线性范围,进样前可用一定体积的流动相稀释,使稀释后上机液中的药物浓度在线性范围内。
浓缩饲料及预合混料的浓度水平较高,可根据实际情况,在提取步骤中增加稀释步骤后进行净化。
1.3.5 样品回收率与精密度 选择空白配合饲料、浓缩饲料及预混合饲料样品做为基质,在配合饲料中添加可乐定和赛庚啶浓度分别为0.02、0.04、0.1 mg/kg的样品进行加标回收实验,前处理步骤按照1.3.4。在预混合饲料和浓缩饲料中添加可乐定和赛庚啶浓度分别为 0.2、0.5、1 mg/kg的样品进行加标回收实验,预混合饲料及浓缩饲料在加入提取试剂后,准确移取上清液1 mL到10 mL容量瓶中,加入盐酸甲醇提取液(甲醇:0.1 mol/L HCl=80∶20)定容至刻度,取稀释液2 mL过MCX小柱进行净化,其余步骤与配合饲料一致。每个浓度重复测定6次,计算回收率及相对标准偏差。
1.3.6 检测限和定量限 取空白样品,按1.3.4前处理步骤后,经超高效液相色谱-串联质谱测得噪音信号的平均值,按信噪比≥3为检测限,信噪比≥10为定量限。
2 结果
2.1 超高效液相色谱-串联质谱的测定 图3是可乐定和赛庚啶混合标准溶液的MRM色谱图。

图3 可乐定和赛庚啶标准溶液MRM色谱图(标准工作液浓度为10 ng/mL)
2.2 标准曲线 用液相色谱-串联质谱测定工作液,获得标准曲线 A赛庚啶=1 773.74+226.032C,线性相关系数 r=0.999 2,A可乐定=207.371C+23.109 3,线性相关系数 r=0.999 4。
2.3 精密度和回收率 选择配合饲料、浓缩饲料和预混合饲料空白样品,按照本方法确定的条件进行加标回收重复性试验,实验表明相对标准偏差均≤10%,表明采用本方法测定饲料中盐酸可乐定和盐酸赛庚啶具有较好的精密度、重复性。统计结果见表3-表5。
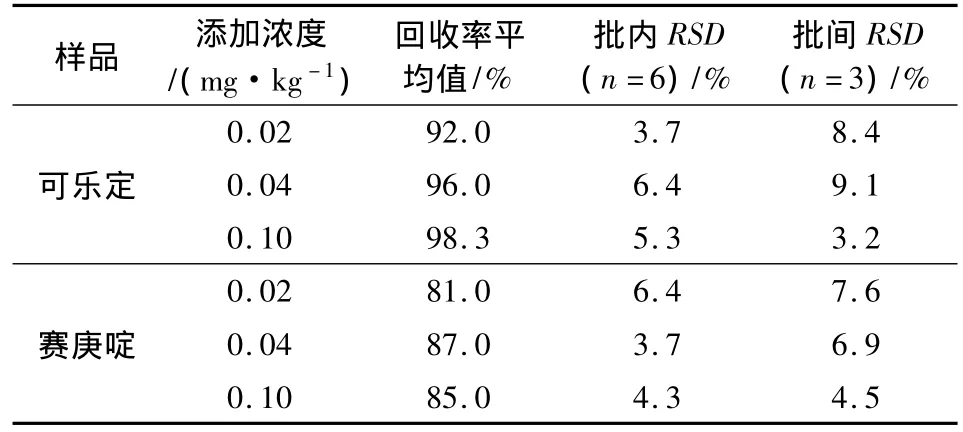
表3 配合饲料中盐酸可乐定和盐酸赛庚啶回收率和精密度
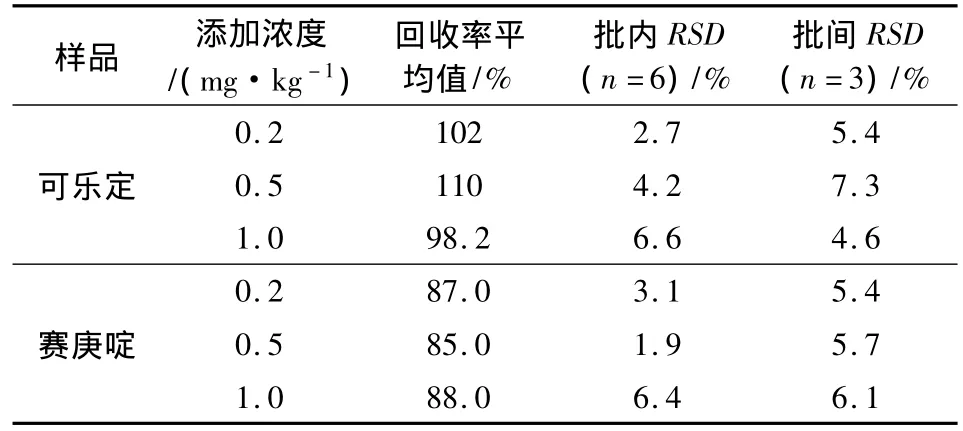
表4 预混合饲料中盐酸可乐定和盐酸赛庚啶回收率和精密度

表5 浓缩料中盐酸可乐定和盐酸赛庚啶回收率和精密度
由上表看出,按已确定的样品提取条件和色谱条件测定添加回收量,实验表明配合饲料中可乐定和赛庚啶回收率达到70% ~100%,预混合饲料和浓缩饲料中盐酸可乐定和盐酸赛庚啶回收率达到70% ~110%,相对标准偏差均<10%,说明该方法对不同种类饲料样品中,不同含量的盐酸可乐定和盐酸赛庚啶的测定均有较好的准确度。图4-图9为空白饲料及添加回收率MRM色谱图。


2.4 检测限和定量限 饲料样品中盐酸可乐定和盐酸赛庚啶方法最低检测限为0.01 mg/kg,信噪比S/N(Peak to Peak)>3。方法最低定量限为0.02 mg/kg,信噪比 S/N(Peak to Peak)>10。
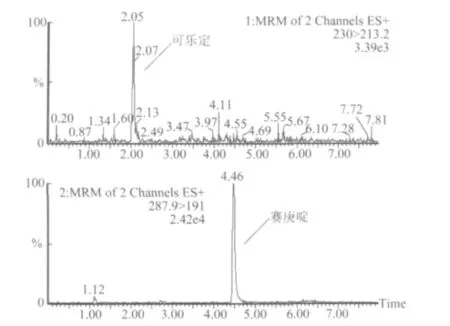
图9 浓缩饲料中可乐定和赛庚啶添加回收率MRM图(添加浓度0.2 mg/kg)
3 讨论
3.1 工作液稀释溶剂的选择 我们尝试选择中性溶剂甲醇、0.2%甲酸、0.2%甲酸∶乙腈 =50 ∶50、0.2%甲酸∶乙腈=20∶80等作为最终进样前的样品溶剂进行实验,发现溶剂对样品的影响较大,而且对赛庚啶和可乐定具有不同的效果,当增加溶剂中有机溶剂比例时赛庚啶的溶解性增强,峰面积增大,灵敏度提高,同时可乐定的灵敏度降低。经过比较发现进样溶剂最接近流动相梯度洗脱起始比例时,可使可乐定和赛庚啶的分离度和峰的对称性符合要求。因此实验中选择流动相梯度起始比例的溶剂0.2%甲酸∶乙腈=20∶80作为进样溶剂。
3.2 SPE柱的选择 可乐定和赛庚啶均属于碱性药物,可选择对碱性药物具有高选择性MCX小柱净化。同时我们还比较了HLB固相萃取小柱的净化效率,比MCX小柱略低,因此最终选择了MCX小柱进行固相萃取净化。
3.3 流动相的选择 通过比较三种常见流动相甲醇、甲醇∶水(1 ∶1,V/V)、乙腈:0.2% 甲酸,发现流动相中未加入0.2%甲酸的情况下,可乐定和赛庚啶的电离效果较差,峰型对称性差,在加入一定比例的0.2%甲酸后,得到了改善,因此最终选择乙腈:0.2%甲酸作为流动相。通常因为饲料样品中基质干扰较大,在流动相条件中设置梯度条件可避免样品中的基质干扰,使得定性和定量更加准确。
3.4 色谱柱的选择 超高效液相色谱串联质谱相较于普通的液相色谱串联质谱具有分离速度快、灵敏度高等分离特点,本实验基于超高效液相色谱串联质谱仪器进行方法开发,在方法研制过程中,我们选用了两款适合超高效液相色谱使用的色谱柱Aglient公司生产的 SB C18100 mm ×3.0 mm,粒径1.8 μm以及Waters公司生产的BEH C18100 mm×2.1 mm,粒径1.7 μm 进行比较。可乐定药物极性强,不易保留,经实验比较发现SB C18柱可以提供更好的保留和分离效果,因此最终选择SB C18色谱柱进行本次检测方法研究。
3.5 实际样品检测 在2010年饲料预警预测工作中,我所利用本方法对采集到的447批次样品进行了检测,共检出25批次阳性样品,从阳性样品的分析结果可以看出,目前可乐定和赛庚啶在配合饲料、浓缩饲料和预混合饲料各类型中均存在违法添加的情况。全部阳性样品中,配合饲料中可乐定的添加范围为0.1~0.9 mg/kg,赛庚啶的添加范围为0.2~1.3 mg/kg,浓缩饲料和预混合饲料中可乐定的添加范围为1.2~1.4 mg/kg,赛庚啶的添加范围为1.0~19.0 mg/kg。另根据文献报道在饲料中添加0.5 mg/kg可乐定时,即能明显改变猪的胴体组成,因此本方法的定量限和检测限的均能够满足要求。
[1]王 珊,宁 聪,魏 虹,等.可乐定促生长作用的临床观察[J].实用儿科杂志,1992,7(4):218-219.
[2]曹建平,徐建国.可乐定麻醉镇痛应用及机制[J].国外医学-麻醉学与复苏分册,2001,22(2):104-107.
[3]张庆柱,耿金荣.赛庚啶的药理与临床研究进展[J].中级医刊,1996,31(3):47-49.
[4]王雷杰,占秀安,许梓荣,等.可乐定对生长猪胴体组成的影响及其作用机理探讨[J].浙江大学学报(农业与生命科学版),2005,31(5):654-658.
[5]冯 杰,余东游.可乐定对动物生长激素分泌的影响[J].饲料研究,2000(9):24-25.
[6]Weng N,Bu H,Chen Y,et al.Simultaneous Development of Six LC-MS-MS Methods for the Determination of Multiple Analytes in Human Plasma[J],Journal of Pharmaceutical and Biomedical Analysis,2002,28(6):1115-1126.
[7]Fente C A,Regal P,Beatriz I,et al.Development and Validation of an LC-MS/MS Confirmatory Method for Residue Analysis of Cyproheptadine in Urine of Food-Producing Animals[J].J Agric Food Chem,2009,57(6):2595-2598.
[8]Xesús F,Lei Y,Seyed V H,et al.Development and Validation of LC-MS/MS Method for the Determination of Cyproheptadine in SeveralPharmaceuticalSyrup Formulations[J].Journal of Pharmaceutical and Biomedical Analysis,2009,50(5):1044-1049.
[9]曹 莹,蒋 音,严 凤.高效液相色谱法分析饲料中的“可乐定”[J].上海畜牧兽医通讯,2010,6:27-28.
[10]曹 莹,蒋 音,张文刚.高效液相色谱法分析饲料中的赛庚啶[J].中国饲料,2011,2:39-40.
