UPLC/Q-TOF MS鉴定沃尼妙林在大鼠体内的代谢产物
2011-11-14毕言锋徐士新肖希龙
毕言锋,孙 雷,李 丹,汪 霞,徐士新,肖希龙
(1.中国兽医药品监察所,北京 100081;2.中国农业大学动物医学院,北京 100091)
沃尼妙林(Valnemulin,VLM)是新一代截短侧耳素(pleuromutilin)类动物专用半合成抗生素,主要用于防治猪、牛、羊及家禽的支原体病和革兰氏阳性菌感染[1-2]。目前,有关VLM的代谢研究资料还很少。EMEA研究表明VLM在大鼠、犬和猪体内代谢完全,并采用同位素标记和高效液相色谱法在大鼠血浆、肝、尿液及粪便中检测到22种代谢产物,但相关代谢物的结构没有鉴定[3]。
近年来,高分辨质谱仪(HRMS)已经广泛用于药物代谢物的筛选和鉴定[4]。随着质谱技术的发展,HRMS(如Q-TOF MS)可以采集分子及其碎片离子的高分辨率(大于10 000)准确质量(误差小于5 ppm)信息,有助于更准确的预测化合物元素组成和结构鉴定[5]。另外,相对于HPLC,UPLC采用颗粒更小(1.7 μm)的色谱柱填料,从而极大提高了复杂多组分样品分析的分离度和灵敏度[6]。因此,UPLC与高分辨Q-TOF MS联用,成为复杂生物体系中药物代谢产物分离和鉴定的有力工具[7-10]。
本研究将利用UPLC/Q-TOF MS技术分析大鼠口服VLM后尿液的代谢指纹,对VLM的体内代谢产物进行筛选,并根据代谢产物的精确质量和MS/MS信息进行结构鉴定,讨论VLM的体内代谢途径。
1 实验部分
1.1 仪器与试剂 超高效液相色谱(UPLC,Waters公司);四级杆-飞行时间质谱仪(Synapt HDMS,Waters公司);大鼠代谢笼(意大利 Ugo Basile公司);沃尼妙林(含量大于95%);乙腈(色谱纯,Fisher公司);羧甲基纤维素钠(CMC-Na,国药集团试剂厂)。
1.2 样品采集及处理 Sprague-Dawley大鼠(购自北京维通利华实验动物技术公司),雄性,体重180~220 g。动物房温度20~25℃,湿度50% ~60%,每天光照12 h。实验前,大鼠在代谢笼内饲养一周,自由进食饮水,每天口服灌食 2 mL CMC-Na溶液。实验前12 h,禁食,自由饮水。实验中,每只大鼠按20 mg/kg体重剂量口服灌食沃尼妙林CMC-Na溶液,正常禁食饮水。分别采集给药前(-12~0 h)及给药后0~4 h(AT1),4~12 h(AT2)和12~24 h(AT3)的尿液样品,12 000 r/min离心后,-20℃冷冻保存至上机检测。为了保证样品不被污染,每次采样前均对样品容器进行清洗。
1.3 UPLC/Q-TOF MS 条件 ACQUITY HSS T3色谱柱(100 mm × 2.1 mm i.d.,1.7 μm);流速0.45 mL/min;柱温35℃;流动相A为0.1%甲酸乙腈溶液,流动相B为0.1%甲酸水溶液;梯度洗脱程序:0~1min,5% ~25%A;1~5 min,25~32%A;5~7 min,32% ~80%A;7~9 min,95%A,9~11 min,5%A。进样体积 2 μL。
QTOF MS采用ESI正电离扫描;毛细管电压3.0 kV,锥孔电压15 V;采用碰撞能量梯度(MSE)功能同时采集MS和MS/MS信息,低碰撞能设为4 V,高碰撞能梯度范围设为10~20 V;离子源及脱溶剂气温度分别为120℃和350℃;脱溶剂化气体流速设为650 L/h。TOF MS质量采集范围为m/z 100至1 000 Da,样品分析前用甲酸钠溶液进行质量数校正。另外,采用亮氨酸-脑啡肽溶液(LE,m/z 566.2771)为Lock mass实时校正精确质量数。
1.4 数据处理 将给药前后的大鼠尿液代谢指纹数据输入MetaboLynx XS软件进行处理,采用质量亏损过滤 (Mass defect filtering,MDF)技术消除内源性物质的干扰,然后,根据常见代谢途径中药物准确质量数的变化,筛选VLM的代谢产物。同时,利用化合物及碎片离子的精确质量数预测其元素组成,并根据代谢物的碎片离子信息及其与VLM的结构关系进行结构鉴定。
2 结果
2.1 VLM质谱行为研究 根据VLM分子离子([M+H]+)的MS/MS精确质量信息,可以准确推测VLM分子在Q-TOF MS上碎裂途径(图1)。首先,VLM的[M+H]+容易断裂分别生成质荷比(m/z)为 303.2335(C20H31O+2)的截短侧耳素(pleuromutilin)母核碎片离子和 m/z 263.1432(C11H23N2O3S+)的侧链碎片离子。母核碎片离子(m/z 303)可进一步失去一个H2O分子生成m/z 285.2230(C20H29O+)。另外,侧链碎片离子(m/z 263)可以失去一个H2O分子生成 m/z 245.1324(C11H21N2O2S+)碎片离子,酰胺键和硫醚键断裂分别生成 m/z 164.0738(C6H14NO2S+)和 m/z 171.1495(C9H19N2O+)碎片离子,而m/z 164可以失去NH3生成147.0480(C6H11O2S+)碎片离子。VLM分子离子及碎片离子的准确质量测量值与理论值间的误差均小于5 ppm,说明仪器具有理想的质量准确性和分辨率,有助于准确预测代谢物的元素组成和结构鉴定。
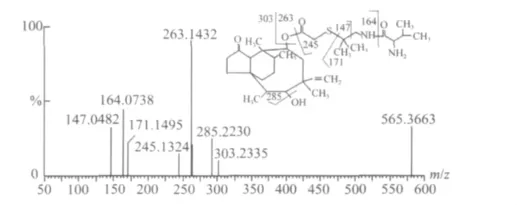
图1 VLM的MS/MS质谱图及其主要碎裂途径
2.2 VLM代谢产物鉴定 MetaboLynx XS处理结果显示,与给药前的空白样品相比,在给药后的大鼠尿液中除检测到VLM原形药物外,还发现了比原形加一个氧的代谢产物M1,M2和M3,以及比原形加两个氧的代谢产物M4和M5(表1和图2)。同时,根据M1~M5的MS/MS信息(图3)对5种代谢产物的结构进行鉴定。

图2 大鼠尿液(0~4h)中检测到的VLM及其代谢产物M1~M5

表1 VLM及其主要代谢物的保留时间、准确质量、元素组成、主要碎片离子及其相关代谢过程

图3 VLM主要代谢物(M1~M5)的MS/MS质谱图
2.2.1 代谢物M1和M2 代谢物M1的元素组成(C31H52N2O6S)比VLM(C31H52N2O5S)多一个氧原子,推测M1为VLM的氧化或羟基化产物。M1具有碎片离子 m/z 263.1429(C11H23N2O3S+)、m/z 171.1497(C9H19N2O+)、m/z 164.0750(C6H14NO2S+)和m/z 147.0480(C6H11O2S+),与 VLM 侧链的特征碎片离子相同,说明M1的侧链没有发生变化。另外,碎片离子m/z 319.2282(C20H31O+3)比VLM的母核碎片离子的元素组成多一个氧原子,还可以连续失去两个H2O分子分别生成碎片离子m/z 301.2180(C20H29)和 m/z 283.2072(C20H27O+),说明VLM母核上发生了羟基化。M2的元素组成和碎片离子与M1相同,但保留时间不同,说明M1和M2都是VLM的母核羟基化代谢产物。
2.2.2 代谢物 M3 M3与 M1、M2具有相同的元素组成,但碎片离子和保留时间都不同。M3具有碎片离子 m/z 303.2332(C20H31O+2)和m/z285.2222(C20H29O+),与VLM母核的特征碎片离子相同,说明M3的母核没有发生转化。另外,M3的碎片离子m/z 279.1381(C11H23N2O4S+)比VLM侧链碎片离子(C11H23N2O3S+)多一个氧原子,同时,M3具有与 VLM相同的特征碎片离子 m/z 171.1482(C9H19N2O+),但没有发现VLM侧链的碎片离子m/z 147(C6H11O2S+),说明M3的侧链的硫醚被氧化成亚砜。
2.2.3 代谢物M4和M5 M4和M5具有相同的元素组成(C31H52N2O7S),比VLM(C31H52N2O5S)多两个氧原子,说明它们是M1、M2和M3二次氧化或羟基化代谢物。M4的碎片离子 m/z 335.2206(C20H31O4+)比VLM的母核碎片离子(C20H31O2+)多两个氧,并能连续失去三个H2O分子生成碎片离子 m/z 317.2112(C20H29O3+)、m/z 299.2006和 m/z 281.1931(C20H25O+),说明 M4是VLM的母核二羟基化产物。M5的碎片离子有m/z 319.2257(C20H31O3+)、m/z 301.2182(C20H29O2+)和 m/z 279.1386(C11H23N2O4S+)、261.1267(C11H21N2O3S+)分别与M1和M3的特征碎片离子相同,说明M5是VLM母核羟基化且侧链硫醚键氧化的代谢产物。
3 讨论
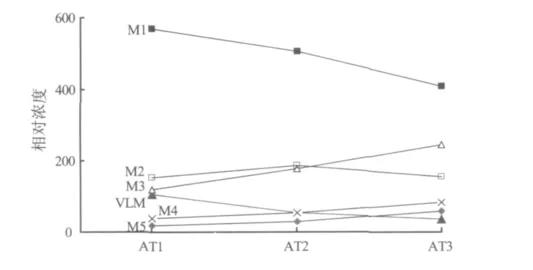
图4 不同时间点大鼠尿液中VLM及其代谢产物的相对浓度
将不同时间点样品中VLM及其主要代谢物(M1~M5)的总峰面积归一化为1000,并假设每种代谢物的质谱响应相同,计算VLM及其代谢物在尿液中的相对浓度(图4)。结果表明,AT1、AT2和AT3组样品中,未发生转化的原型药物约分别占VLM总残留量的11%、5%和6%,说明VLM进入体内后代谢迅速,24 h内基本代谢完全,主要以代谢物形式排出体外,代谢途径包括母核羟基化和侧链硫醚键氧化。药代动力学研究表明,VLM在动物体内的有效血药浓度维持时间短,药物消除较快[16],这可能与VLM进入体内后迅速发生代谢有关。
体外代谢研究表明,截短侧耳素类药物泰妙菌素可以发生2β和8α-羟基化[11]。同时,EMEA的研究也发现,8α-羟基泰妙菌素也是泰妙菌素在动物体内的代谢产物,并将其确定为泰妙菌素在猪、鸡体内的残留标示物[12]。在本研究中,大鼠尿液样品中VLM羟基化产物M1、M2和M4的分别约占VLM及代谢产物总量的50%、17%和5.8%,说明母核羟基化是VLM的主要代谢途径。然而,仅根据液相色谱和质谱信息无法确定羟基化位置,还需要对羟基化产物分离提纯后利用其他技术对进行结构确证。另外,由于亚砜的稳定性较差,因此,侧链硫醚键氧化不是VLM的主要代谢途径,M3的含量较低。根据以上的研究结果,可以预测VLM在大鼠体内可能的代谢途径(图5)。

图5 VLM在大鼠体内的可能代谢途径
本研究利用UPLC/Q-TOF MS技术发现了VLM在大鼠体内的5种主要代谢产物,并根据MS/MS准确质量信息对代谢物的结构进行了初步鉴定。结果表明,VLM在大鼠体内代谢迅速,代谢途径包括母核羟基化和侧链硫醚键氧化等。另外,母核羟基化产物(M1、M2和M4)是VLM在大鼠体内的主要代谢产物。
[1]Stipkovits L,Ripley P H,Tenk M,et al.The Efficacy of Valnemulin(Econor)in the Control of Disease Caused by Experimental Infection of Calves with Mycoplasma Bovis[J].Research in Veterinary Science,2005,78(3):207-215.
[2]Stipkovits L,Ripley P H,Varga J,et al.Use of Valnemulin in the Control of Mycoplasma Bovis Infection Under Field Conditions[J].Veterinary Record,2001,148(13):399-402.
[3]EMEA.Committee for Veterinary Medicinal Products.Valnemulin.Summary Report[Z].1998.
[4]Zhu M S,Zhang H Y,Griffith H W.Drug Metabolite Profiling and Identification by High Resolution Mass Spectrometry[J].J Biol Chem,2011.doi:10.1074/jbc.R110.200055.
[5]Ma S,Chowdhury S K,Alton K B.Application of Mass Spectrometry for Metabolite Identification[J].Curr Drug Metab,2006,7(5):503-523.
[6]Wren S A C,Tchelitcheff P.Use of Ultra-Performance Liquid Chromatography in Pharmaceutical Development[J].Journal of Chromatography A,2006,1119(1/2):140-146.
[7]Castro-Perez J M.Current and Future Trends in the Application of HPLC-MS to Metabolite-identification Studies[J].Drug Discov Today,2007,12(5/6):249-256.
[8]Want E J,Coen M,Masson P,et al.Ultra Performance Liquid Chromatography-Mass Spectrometry Profiling of Bile Acid Metabolites in Biofluids:Application to Experimental Toxicology Studies[J].Anal Chem,2010,82(12):5282-5289.
[9]Tiller P R,Yu S,Castro-Perez J,et al.High-throughput,Accurate Mass Liquid Chromatography/Tandem Mass Spectrometry on a Quadrupole Time-Of-Flight System as a‘first-Line’Approach forMetabolite Identification Studies[J].Rapid Commun Mass Spectrom,2008,22(7):1053-1061.
[10] Bi Y F,Wang X,Xu S X,et al.Metabolism of Olaquindox in Rat and Metabolites Identification in Urine and Feces using Ultra Performance Liquid Chromatography-Quadrupole Time-of-Flight Mass Spectrometry[J].Rapid Commun Mass Spectrom,2011,25(7):889-898.
[11]曾东平,严 楚,孙永学,等.沃尼妙林在猪体内的生物利用度及药代动力学研究[J].中国兽医科学,2010,40(10):1076-1079.
[12] Lykkeberg A K,Cornett C,Halling-Sorensen B,et al.Isolation and Structural Elucidation of Tiamulin Metabolites Formed in Liver Microsomes of Pigs[J].J Pharm Biomed Anal,2006,42(2):223-231.
[13] EMEA.Committee for Veterinary Medicinal Products.Tiamulin.Summary Report(1)[Z].1999.
