框镜鲤维氏气单胞菌CY0806株OMPAⅠ基因的克隆及生物信息学分析
2011-11-14单晓枫吴同垒孟庆峰王伟利钱爱东
单晓枫,吴同垒,孟庆峰,王伟利,钱爱东
(1.吉林农业大学动物科学技术学院,长春 130118;2.吉林进出口检验检疫局,长春 130062)
维氏气单胞菌(Aeromonas veronii,AV)隶属于气单胞菌属,是一种新型的人-兽-鱼共患病原菌。其不仅可以引发人的胃肠炎、脑膜炎、腹膜炎、败血症和外伤感染等[1-3],还对鱼虾蟹等多种水生动物具有较强的致病力[4-7]。维氏气单胞菌可产生多种毒力因子,如气溶素、溶血素、外膜蛋白、粘附素和胞外蛋白酶等。其中,外膜蛋白可增强细菌的粘附作用,维持外膜结构、抵抗补体介导的血清杀伤力等,是一种重要的毒力因子;此外,外膜蛋白具有很强的抗原性,不仅可以刺激机体产生体液免疫和细胞免疫,还可以用外膜蛋白建立特异性强的免疫学检测方法。
目前,国内有关维氏气单胞菌的研究处于起步阶段,尚未见AV外膜蛋白的研究报道,为此,本试验以AV基因组DNA中克隆了OMPAⅠ基因,并对其序列进行Blast比对,用生物信息学软件对其编码蛋白的理化参数、二级结构、抗原表位等进行分析和预测,为维氏气单胞菌基因工程疫苗的研发和特异性免疫学检测方法的建立奠定基础。
1 材料与方法
1.1 菌种 维氏气单胞菌CY0806,分离自吉林某渔场养殖患病框镜鲤,由本实验室分离鉴定[8];大肠杆菌DH5α,由本实验室保存制备。
1.2 主要试剂 DL2000 Marker、Taq DNA聚合酶、dNTP、pMD18-T载体均购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒购自爱思进生物技术有限公司;细菌基因组DNA提取试剂盒、质粒小量抽提试剂盒购自北京索莱宝科技有限公司;气单胞菌培养基RS购自北京陆桥技术有限责任公司;其他试剂均为进口或国产分析纯。
1.3 引物设计与合成 根据GenBank上发表的AV OMPAⅠ基因序列,用生物软件 Primer Premer 5.0设计一对特异性引物:P1:5'-GACGATATCATGATGAAAATGGCTCCT-3',P2:5'-GCGAAGCTTTTACTTCTGAACTTCTTG-3'。引物由宝生物工程(大连)有限公司合成。
1.4 目的基因的PCR扩增 以AV CY0806细菌基因组DNA为模板,以P1、P2为上下游引物,反应体系50 μL,反应条件:94℃预变性5 min;94℃变性1 min,59 ℃复性1 min,72 ℃延伸1.5 min,共34个循环;72℃延伸10 min。扩增产物经1.0%琼脂糖凝胶分析后,用DNA凝胶回收试剂盒回收目的片段。
1.5 目的基因的克隆与鉴定 将回收产物于pMD18-T载体连接,并转化至DH5α感受态中,涂布于含氨苄青霉素LB固体培养基,37℃培养12-16 h,挑取单个菌落、液体LB中增菌,用质粒提取试剂盒提取质粒,并进行PCR鉴定,将阳性质粒送至宝生物工程(大连)有限公司测序。
1.6 目的基因及编码蛋白的生物信息学分析 利用 NCBI、DNAstar、MEGA4.0 等分子生物学软件或网站,对目的基因及编码蛋白进行分析。
2 结果
2.1 OMPAⅠ基因的克隆 以 CY0806基因组DNA为模板,经PCR扩增出与目的基因大小相符的条带(图1)。将扩增的OMPAⅠ基因片段纯化后,与pMD18-T载体连接,经氨苄青霉素抗性筛选,阳性质粒经PCR鉴定证实目的基因已成功克隆与载体中。

图1 AV CY0806株OMPAⅠ基因的PCR扩增
2.2 OMPAⅠ基因的序列分析与系统进化树 经序列测定,OMPAⅠ基因全长1026 bp,编码338个氨基酸。利用Blastn对获得的OMPAⅠ基因序列进行同源性分析:该基因与维氏气单胞菌AB2902300的OMPAⅠ基因同源性为93%,与其他气单胞菌同源性大于80%,与不同菌种的OMPAⅠ基因构建的系统进化树如图2所示。

图2 AV CY0806株OMPAⅠ基因的系统进化树
2.3 OMPAⅠ基因编码蛋白的生物信息学分析
2.3.1 OMPAⅠ的分子特征 经ProtParam tool和DNAStar分析,OMPAⅠ分子量 36044.6 u,推测分子式C1602H2488N466O485S9,含有32个强碱性氨基酸(K,R),31 个强酸性氨基酸(D,E),130 个疏水氨基酸(A,I,L,F,W,V),80 个极性氨基酸(N,C,Q,S,T,Y),等电点7.82,半衰期为 30 h(体外哺乳动物类网状细胞)、大于20 h(在酵母体内)及10 h(在大肠杆菌体内),不稳定性系数25.78,属于稳定蛋白,平均疏水值-0.189。
2.3.2 OMPAⅠ信号肽与转膜区分析 通过SignaIP软件分析:OMPAⅠ蛋白序列最前端的23个N-末端氨基酸残基为信号肽序列,最佳切割位点为23-24个氨基酸(图3);在线软件TMHMM分析结果显示:OMPAⅠ蛋白无跨膜区。

图3 AV CY0806株OMPAⅠ蛋白分子信号肽预测
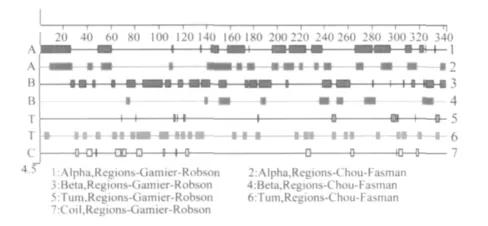
图4 AV CY0806株OMPAⅠ蛋白的二级结构预测
2.3.3 OMPAⅠ蛋白的二级结构预测分析 以Gamier-Bobson方法预测OMPAⅠ蛋白的二级结构发现:α螺旋占41.5%,β折叠占39.5%,β转角占6.34%,无规卷曲占 12.6%;而通过 Chou-Aasman方法分析发现α螺旋占38.9%,β折叠占16.7%,β 转角占36.3%(图 4)。
2.3.4 OMPAⅠ蛋白的B细胞抗原表位预测 综合Kyte-Doolittle标准对OMPAⅠ蛋白亲水区的预测、Emini原则对OMPAⅠ蛋白的表面暴露区的分析、Karplus-sohulz预测方案对OMPAⅠ蛋白柔性区域的预测、Chou-Aasman方案对OMPAⅠ蛋白的β转角分析等结果预测OMPAⅠ蛋白可能B细胞抗原表位位于(图5所示):78-80(Thr,Gly,Arg)、87-91(Arg,Thr,Glu,Ser,Gln)、126-128(Ser,Asp,Thr)、164-165(Asn,Gly)、171(Asn)、225-226(Asp,Thr)、247-250(Pro,Lys,Asp,Gly)、259-260(Asp,Arg)、264-265(Asp,Ala)、301-302(Gln,Pro)、334-337(Gly,Arg,Asn,Lys)。

图5 蛋白亲水性、柔韧性、表面暴露区和抗原指数分析
3 讨论
维氏气单胞菌广泛分布于水、土壤等环境中,可感染人类并引发多种疾病。近年来,其致水产动物发病的报道也屡有发生。目前,国内对维氏气单胞菌的研究相对较少,而有关毒力因子的研究则未见报道。其中,外膜蛋白作为革兰氏阴性菌外膜中的重要蛋白成分,具有较强的免疫原性,且种类、数量也随菌株的不同而有所差异。在国外,已有报道利用外膜蛋白建立的间接ELISA方法检测维氏气单胞菌,结果表明该检测方法行之有效[9];Vazquez-Juarez[10]以维氏气单胞菌外膜蛋白做基因工程疫苗,对斑带副鲈进行了免疫同时进行了保护力试验,结果表明维氏气单胞菌的外膜蛋白具有较高的免疫原性。本试验针对维氏气单胞菌OMPAⅠ吉亚尼设计一对特异性引物,对维氏气单胞菌吉林分离株进行PCR扩增,得到与目的基因大小一致的基因片段,经序列分析,该基因序列与GenBank登录的维氏气单胞菌菌株AB2902300的OMPAⅠ同源性为93%,与其他气单胞菌同源性大于80%,说明气单胞菌属间的OMPAⅠ有较高的同源性,但仍存在一定的种属差异。
研究应用SignalP软件对维氏气单胞菌CY0806株OMPAⅠ蛋白的信号肽位置及最佳切割位点进行了预测。而信号肽的作用是负责蛋白质转运及分泌,当前体蛋白已正确定位,切除信号肽,同时蛋白立体构象发生改变,前体蛋白变成成熟的蛋白质。因此,预测分析信号肽为维氏气单胞菌OMPAⅠ蛋白的异源表达等后续研究奠定基础。
为了提高预测蛋白二级结构的准确性,研究者往往采用不同的方法进行分析。本研究以二种方法预测分析了维氏气单胞菌CY0806株OMPAⅠ蛋白的二级结构,结构表明:该蛋白α螺旋的含量相对较高,而α螺旋与β折叠由于有氢键的维持使蛋白不易变形,可以稳定蛋白结构[11]。因此,通过预测分析,维氏气单胞菌CY0806株OMPAⅠ蛋白结构相对稳定。
目前,B细胞表位的预测一般综合多种参数进行分析,以提高预测的准确性。本研究以亲水性、柔韧性、表面可能性以及β转角等预测方案综合考虑。本试验预测结果该蛋白可能有11处区域为B细胞表位,但若要证实仍需后续试验进行验证。一经证实,可利用合成肽等技术合成维氏气单胞菌CY0806株OMPAⅠ蛋白的特异性B细胞表位的短肽,为制备维氏气单胞菌的特异性抗体、建立检测维氏气单胞菌的特异性诊断方法奠定基础。
[1]Wang J T,Fang C T,Hsueh P R,et al.Spontaneous Bacterial Empyema Caused by Aeromonas veronii Biotype Sobria[J].Diagnostic Microbiology and Infectious Disease,2000,37:271-273.
[2]Shiina Y,Ii K,Iwanaga M.An Aeromonas veronii Biovar Sobria Infection with Disseminated Intravascular Gas Production[J].Infect Chemother,2004,10:37-41.
[3]Figueras M J,Aldea M J,Fernández N,et al.Aeromonas Hemolytic Uremic Syndrome.A Case and a Review of the Literature[J].Diagnostic Microbiologyand Infectious Disease,2007,58:231-234.
[4]Rahman M,Colque-Navarro P,Khn I,et al.Identification and Characterization of Pathogenic Aeromonas veronii Biovar Sobria Associated with Epizootic Ulcerative Syndrome in Fish in Bangladesh[J].Applied Environmental Microbiology,2002,68(2):650-655.
[5]Sung H H,Hwang S F,Tasi F M.Responses of Giant Freshwater Prawn(Macrobrachium rosenbergii)to Chall- enge by Two Strains of Aeromonas spp.[J].Journal of Invertebrate Pathology,2000,76:278-284.
[6]房 海,陈翠珍,张晓君,等.中华绒螯蟹病原维氏气单胞菌的检验[J].中国人兽共患病学报,2008,24(1):45-49.
[7]潘晓艺,沈锦玉,李建应,等.青虾“软壳综合症”病原及其特性[J].微生物学通报,2009,36(10):1571-1576.
[8]龚 倩,高淑琴,单晓枫,等.框镜鲤致病性维氏气单胞菌的分离鉴定[J].中国预防兽医学学报,2010,32(12):981-983.
[9]Arora S,Agarwal R K,Bist B.Comparison of ELISA and PCR vis-a`-vis Cultural Methods for Detecting Aeromonas spp.in Foods of Animal Origin[J].International Journal of Food Microbiology,2006,106:177-183.
[10] Vazquez-Juarez R C,Gomez-Chiarri M,Barrera-Saldana H,et al.Evaluation of DNA Vaccination of Spotted Sand Bass(Paralabrax Maculatofasciatus)with Two Major Outer-Membrane Protein-Encoding Genes from Aeromonas veronii[J].Fish & Shellfish Immunology,2005,19:153-163.
[11] David W M.Bioinformatics:Sequence and Genome Analysis[M].Beijing:Science Press,2002.
