肺孢子虫(菌)p55抗原嵌合基因的克隆及表达产物分析*
2011-11-13王雪莲栾和芝赵雨杰安春丽
王雪莲,栾和芝,刘 彤,赵雨杰,安春丽
2.秦皇岛港口医院检验科,秦皇岛 066000;
3.中国医科大学基础医学院细胞生物学教研室,沈阳110001;
4.中国医科大学基础医学院生物芯片中心,沈阳 110001
肺孢子虫(菌)肺炎(Pneumocystis pneumonia,PCP)是由肺孢子虫(菌)引起的一种机会感染性肺炎[1]。常见于艾滋病(AIDS)、恶性肿瘤、器官移植及其他免疫功能不全的人群[2-3]。最新的流行病学资料显示:PCP的发病率在发展中国家呈明显增长趋势,而在美国等一些发达国家,由于普遍开展了高效抗逆转录病毒疗法(HAART)之后,PCP的发病率有所下降[4],但仍然是这些国家AIDS流行第3个十年里面临的严重问题[2,5-6]。自AIDS流行以来,国内外有许多学者一直致力于PCP防治策略以及疫苗方面的研究,但是至今尚无理想的防治措施。
肺孢子虫55 kDa蛋白(p55)是肺孢子虫的主要抗原成分之一,能刺激宿主产生抗肺孢子虫的保护性免疫反应[7]。Smulian等研究发现,天然p55蛋白能刺激宿主产生明显的细胞免疫和体液免疫反应,重组p55蛋白也能对肺孢子虫感染提供保护作用[8]。Zheng等研究发现用 p55抗原制备的非CD4+T细胞依赖疫苗能够预防小鼠 PCP[9]。综上,p55是最有希望的疫苗候选抗原。由于肺孢子虫体外培养困难,导致p55抗原来源受到限制,而多个p55蛋白变异体的存在又使得免疫效果受到了影响,这些都严重地阻碍了利用p55抗原进行PCP免疫防治研究的进展。
本研究通过生物信息学手段,预测人源p55抗原及变异体的抗原表位,选择可能有效抗原表位,设计包含多个抗原表位的多肽,根据遗传中心法则及大肠杆菌密码子偏好性进行密码子优化,将氨基酸序列转化为核苷酸序列,人工合成该核苷酸片段,构建原核表达载体,在大肠杆菌中表达重组蛋白,并对此表达产物进行分析鉴定。研究结果不仅解决p55来源困难和p55单价抗原免疫范围小的难题,为PCP疫苗的研究奠定基础,而且还为PCP的免疫学诊断提供可靠的依据。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 大肠杆菌(Escherichia coli,E.coli)DH5α购自上海生工生物工程技术服务有限公司,质粒载体pGEX-6p-1(含GST标签)为本实验室保存。
1.1.2 主要试剂 限制性内切酶BamH I和NotI购自大连宝生物工程有限公司,质粒DNA提取试剂盒,DNA标记物、蛋白标记物、蛋白上样缓冲液、异丙基-β-D硫代半乳糖苷(IPTG)、蛋白胨、酵母粉、购自上海生工生物工程技术服务有限公司,Anti-GST-Ab,H RP标记羊抗兔IgG,PVDF膜购自大连宝生物工程有限公司。其他常规试剂购自沈阳化学试剂采购供应站。
1.1.3 数据库和预测软件 采用http://www.ncbi.nlm.gov/BLAST提供的BLAST软件、网络共享软件Antigenic Peptide Prediction以及 Laser gene DNASTAR软件,进行蛋白质序列及性质分析。
1.2 实验方法
1.2.1 抗原表位预测 自NCBI网站的蛋白数据库中获取p55抗原及4个变异体信息(登记号分别为 AAQ06669、AAQ06670、AAX14020、AAQ06672、AAQ06673)。利用哈佛大学提供的网络共享Antigenic Peptide Prediction 软件(http ://bio.dfci.harvard.edu/Tools/antigenic.pl)及 Lasergene DNASTAR软件,分析p55抗原及变异体的结构,预测可能的抗原表位。综合预测结果,设计抗原表位肽串联多肽。根据遗传中心法则及大肠杆菌密码子偏好性进行密码子优化,将氨基酸序列转化为核苷酸序列,即编码多个抗原表位的嵌合基因。
1.2.2 嵌合基因的合成和测序鉴定 嵌合基因全长1 180 bp,在基因片段上下游分别引入BamH I和NotI酶切位点(图 1中粗体部分),命名为CAG,由上海生工生物工程技术服务有限公司合成并测序验证。
1.2.3 pGEX-6p-1/CAG原核表达载体的构建及鉴定 将CAG基因连接在原核表达载体pGEX-6p-1上,插入位点为BamH I和NotI,与标签GST连接,构建重组质粒pGEX-6p-1/CAG,并将其转化感受态菌E.coliDH5α。用含重组质粒的E.coli涂布于含有氨苄青霉素(Amp,100μ g/mL)的LB培养基(1%蛋白胨,0.5%酵母提取物,1%NaCl),于37℃培养箱中过夜培养。挑取孤立菌落接种于2 mL LB培养基(Amp,100μ g/mL)中,37℃培养过夜。提取质粒,限制性内切酶BamH I和NotI酶切,测序鉴定。
1.2.4 重组融合蛋白的诱导表达及纯化 将上述过夜培养的菌液按1∶100的比例接种到含300 mL LB液体培养基(Amp,100μ g/mL)中,37℃振荡培养至菌液吸光度(A550)为0.8~1.0时,IPTG(1 mmol/L)37℃诱导表达。4℃12 000×g离心10min,蛋白裂解液重悬沉淀。分别用 1、2、4、6 mol/L尿素充分振荡、洗涤,4℃12 000×g离心15min,重复上述步骤一次。沉淀重悬于含8 mol/L尿素的包涵体溶解缓冲液中,充分溶解包涵体后,4℃12 000g离心 15min,收集上清,沉淀用 PBS重悬。取不同浓度尿素洗涤纯化的上清、沉淀进行SDS-PAGE电泳分析融合蛋白存在形式。
1.2.5 Western Blotting分析表达产物 分别取IPTG诱导后0 h、2 h、4 h和6 h菌液1 mL,10 000×g离心15min,将沉淀重悬于50 μ L蛋白裂解液中,液氮 3 min,37℃水浴3 min,重复 3次,超声裂解后加等体积的2×SDS载样缓冲液,100℃变性5 min,8%SDS-PAGE蛋白电泳,转印PVDF膜。洗膜后用5%脱脂奶粉封闭2 h。加入Anti-GST-Ab抗体(1∶500稀释),4℃孵育过夜。PBS洗膜4次,再加入羊抗兔IgG(1∶5 000稀释),室温孵育2 h,DAB显色。
2 结 果
2.1 包含多个p55抗原表位的多肽选择 根据蛋白数据库中获取的p55抗原氨基酸序列,利用软件对p55蛋白抗原性相关的参数进行预测分析,从已报道的p55抗原及4个变异体中选择可能有效的抗原表位,各表位串联后进一步分析,各表位相对独立,具有较高的抗原性参数指标。此多肽的氨基酸序列为:Mgfhkamlicaiigvtlgvwhrkgfqemlicaiigmtl gvwiekmgslfiifaviarvffktdhecnnlkehckdilaesckkvqg kcldlglltpmelpselkesvhivikryqndtedqclitetvtvtavpek tletedqcsitetvtvtvtpek eslcsitetvtvtfsrdsrslciksiscds iskylkemdftkkdcvdlaaevcsfakenftkthtlltistvtvtemaq ftkthtilsvstvlvtelapethftkthtvltvstvvvtetaqmaqdiyt hikiliktktcclgrptketaqythtyirtliktenivkraflaglkpdfg kgvrvegfhkagkgvrverfhkagkgvrvegfqkefesgsyyqp mdlas。
2.2 嵌合基因序列 我们选择了大肠杆菌偏好的密码子,以提高短肽串联基因在大肠杆菌内的表达效率,将上述氨基酸序列转化为核苷酸序列(图1),在基因的上下游分别加入BamH I和NotI酶切位点(粗体部分)。

图1 嵌合基因序列图Fig.1 The sequence of the chimeric antigen gene
2.3 重组质粒pGEX-6p-1/CAG的鉴定
2.3.1 重组质粒pGEX-6p-1/CAG的双酶切鉴定
pGEX-6p-1载体片断长度约4 900bp,CAG基因片段长度为1 180bp。重组质粒pGEX-6p-1/CAG经BamHI和NotI双酶切的电泳结果出现了约4,900 bp及 1 180 bp的特异性条带(图 2),表明pGEX-6p-1/CAG表达载体构建成功。
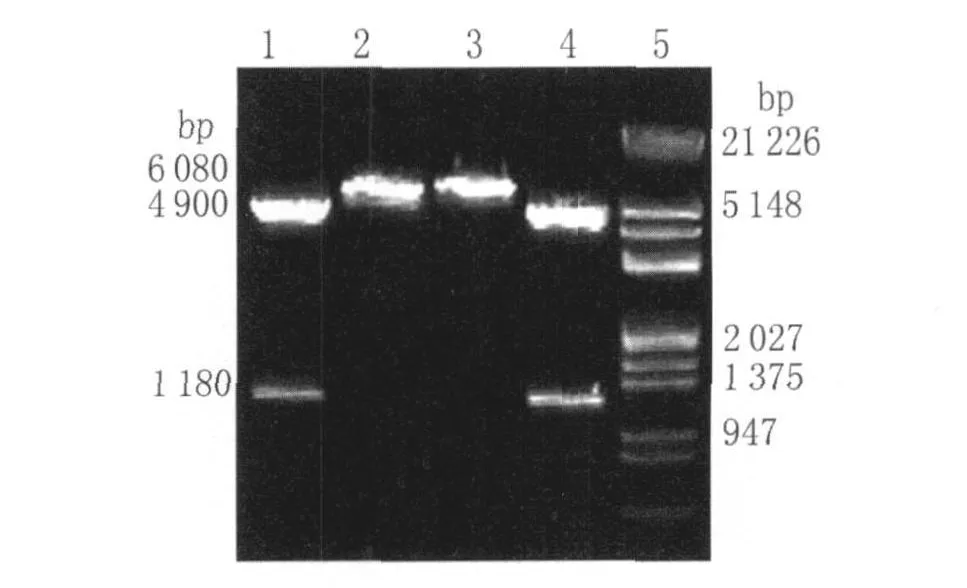
图2 重组质粒pGEX-6p-1/CAG的限制性内切酶酶切鉴定Fig.2 Identification of recombinant plasmid pGEX-6p-1/CAG by Restriction enzyme digestion
2.3.2 重组质粒pGEX-6p-1/CAG的测序结果重组质粒pGEX-6p-1/CAG由上海生工生物工程有限公司作序列测定,结果证实了其碱基序列及读码框架与设计完全相符(图3)。
2.4 重组融合蛋白的诱导表达及Western Blotting鉴定结果 携带质粒 pGEX-6p-1/CAG和pGEX-6p-1的E.coli表分别达出分子量约69 000的GST-CAG融合蛋白和26 000 GST蛋白。SDSPAGE电泳结果显示,诱导的pGEX-6p-1/CAG菌体蛋白在相对分子质量(Mr)69 000处有GST融合蛋白条带(图4),与生物信息学分析预测的分子量相符。各浓度尿素洗涤后的沉淀及上清中在Mr69 000处可见目的条带,沉淀中目的条带均较上清明显(图4),结果表明此重组融合蛋白是以包涵体及溶解2种形式存在,但主要以包涵体形式存在。4mol/L尿素洗涤包涵体效果较好(图4)。
Western Blotting结果显示此融合蛋白能被Anti-GST-Ab识别,在Mr69 000处形成特异性反应条带(见图5)。IPTG诱导4h后融合蛋白表达量大(图5)。结果表明嵌合基因CAG在原核细胞中得到了有效的表达。
3 讨 论
资料表明,PCP是艾滋病患者最常见的并发症,有超过90%的AIDS患者是因PCP而确诊,因而被视为AIDS的“标志性疾病”[2]。临床资料显示:PCP一旦发生,病情进展迅速,若不及时治疗,病死率高达100%。迄今既没有理想的治疗药物,也无有效的疫苗问世。因此,开发有效的防治PCP等机会感染性疾病的新策略对HIV感染者以及其他免疫机能低下人群的健康和生存质量都具有深远影响。
图3 pGEX-6p-1/CAG质粒测序结果Fig.3 The result of plasmid pGEX-6p-1/CAG sequencing
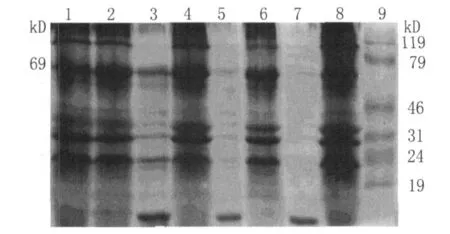
图4 pGEX-6p-1/CAG表达产物的SDS-PAGE分析1-8为不同浓度(1 mol/L,2 mol/L,4 mol/L,6 mol/L)尿素洗涤的重组蛋白CAG-GST的上清与沉淀。9为蛋白质标记物Fig.4 SDS-PAGE analysis of the expression products of pGEX-6p-1/CAG1-8 Supernatant and precipitation containing recombinant protein CAG-GST washed by different urea concentrations(1 mol/L,2 mol/L,4 mol/L,6mol/L).9 protein M arker
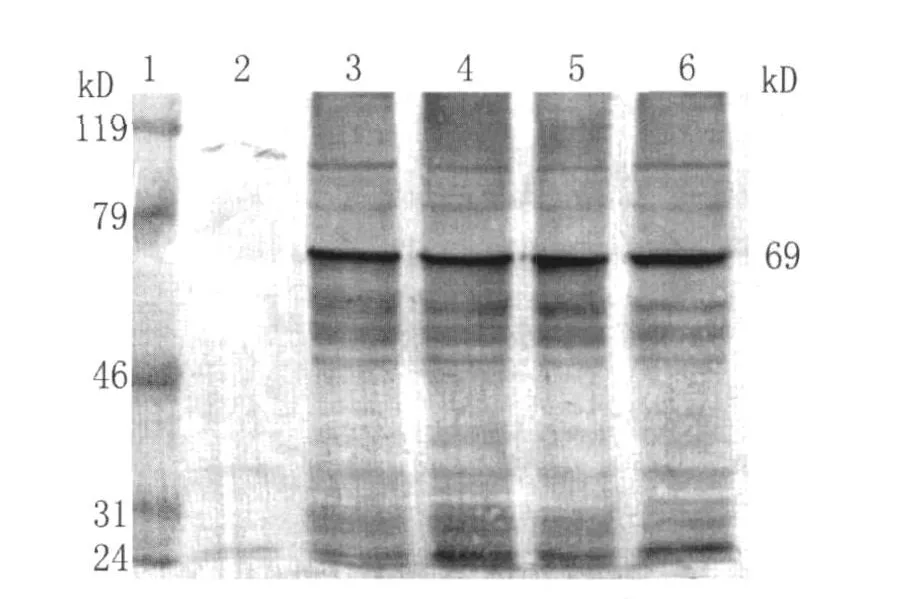
图5 免疫印迹法对重组蛋白的鉴定1为蛋白标记物;2-6为IPTG诱导(0~4h)的重组蛋白Fig.5 Identification of recombinant protein by Western Blot 1 protein marker;2-6 induced(0-4h)recombinant protein
p55抗原是最有希望的疫苗候选抗原,在预防PCP的疫苗研究中比肺孢子菌的主要表面糖蛋白(MSG,gpA)更受青睐。由于p55抗原来源困难及存在变异体和致病因子等问题限制了以p55蛋白为抗原的疫苗研制。本研究以多个抗原表位为基础设计基因工程疫苗,选择p55抗原作为目的蛋白,最大限度的删除致病因子,保留可有效诱导保护性免疫反应的成分。将p55抗原及4种变异体抗原表位进行串联后,各表位仍相对独立,具有较高的抗原性参数指标。因此,表达出的重组CAG蛋白应该具备更好的抗原性,且可实现单价疫苗多价免疫的效果。
本实验是通过生物信息学技术,网络数据库结合生物软件分析的方法预测p55蛋白二级结构,亲水性,穿膜螺旋,N-糖基化位点,氨基酸序列的亲疏水性,表面可及性,分子柔韧性及抗原性指数等,确定可能在肺孢子虫感染过程中起重要作用的并具有较好抗原性参数的结构区域作为抗原表位。从5个p55蛋白变异体中选取了十二个B细胞表位,这十二段短肽通过软件预测没有穿膜螺旋和N-糖基化位点,具有很好的亲水性和可及性,进入宿主体内应处于伸展状态,易于接近宿主细胞受体。短肽的这些特性使其适用于基因工程疫苗的进一步研制。通过密码子优化和不同的线性排列组合筛选,选取了具有最好抗原性参数的排列,根据遗传中心法则转变为核苷酸序列。实验结果显示多表位嵌合基因片段在接入pGEX-6p-1原核表达载体后能够有效表达出预期大小的蛋白片段。将多表位嵌合基因应用于疫苗研制从理论上比单表位短肽疫苗具有更好的免疫原性以及更好的抗蛋白变异体的能力。但是实验中我们发现CAG-GST融合蛋白的表达率低、包涵体复性率低以及纯化费用较高,这些问题尚需进一步研究解决。重组融合蛋白的抗原性以及其预防感染的效果还需要进一步的研究及验证。
[1]Stringer JR,Beard CB,Miller RF,et al.A New Name(Pneumocystis jiroveci)for Pneumocystis from Humans[J].Emerging Infectious Diseases,2002,8(9):891-896.
[2]Duchini A,Goss JA,Karpen S,et al.Vaccinations for adult solid-organ transplant recipients:current recommendations and protocols[J].Clin Microbiol Rev,2003,16(3):357-364.
[3]Fauci AS.HIV and AIDS:20 years of science[J].Nat Med,2003,9(7):839-843.
[4]Lian YL,Heng BS,Nissapatorn V,et al.AIDS-defining illnesses:a comparison between before and after commencement of highly active antiretroviral therapy(HAART)[J].Curr HIV Res,2007,5(5):484-489.
[5]Autran B,Carcelain G,Li TS,et al.Positive effects of combined antiretroviral therapy on CD4+T cell homeostasis and function in advanced HIV disease[J].Science,1997,277(5322):112-116.
[6]Morris A,Lundgren JD,Masur H,et al.Current epidemiology ofPneumocystis pneumonia[J].Emerg Infect Dis,2004,10(10):1713 1720.
[7]Smulian AG,Stringer JR,Linke MJ,et al.Isolation and Characterization of a Recombinant Antigen ofPneumocystiscarinii[J].Infect Immun,1992,60(3):907-915.
[8]Smulian AG,Sullivan DW,T heus SA.Immunization with recombinantPneumocystis cariniip55 antigen provides partial protection against infection:characterization of epitope recog nition associated with immunization[J].Microbes Infect,2000,2(2):127-136.
[9]Zheng M,Ramsay AJ,Robichaux M B.CD4+T cell independent DNA vaccination against opportunistic infections[J].T he Journal of Clinical Investigation,2005,115(12):3536-3544.
