MBL基因多态性与新疆汉族人群结核病易感性的研究*
2011-11-13张万江
李 宇,吴 芳,章 乐,张万江
2.石河子大学新疆地方与民族高发病教育部重点实验室,石河子 832002
结核病是由结核分枝杆菌引起的一种重要传染性疾病,是人类健康的主要杀手。据WHO统计,全球约有1/3的人感染结核杆菌,但其中不足1/10的感染者发展为结核病,且每年不到0.1%的感染者死于该病[1];这都提示个体遗传差异与结核病易感性相关[2]。近年来,随人类基因组流行病学的发展,宿主易感基因在结核病发生与进展中的作用更日益凸显,并受到国内外广泛关注,其中MBL基因就是当前的一个研究热点。
甘露糖结合凝集素(Mannose-binding lectin,MBL)属于Ca2+依赖型凝集素家族中的一员,它主要通过调理作用和激活补体途径而发挥天然免疫防御功能。MBL天然免疫功能的发挥依赖于其充足的血清浓度和完整的多聚结构。已有研究证实,MBL血清浓度低下或结构缺损受MBL基因的6个多态性位点的影响,这其中包括位于启动子区—550位的H/L,—221位的X/Y和+4位的P/Q以及外显子1区的52、54、57,3个多态性位点。随着对MBL的免疫防卫功能的逐步深入了解和结核病免疫机制的不断阐明,人们对MBL基因与肺结核发病之间的关联研究也取得了进一步突破。本研究采用病例-对照研究方法,应用序列特异性引物-聚合酶链反应(PCR-SSP)技术对我国新疆汉族结核病患者和健康对照者MBL基因的H/L、P/Q和A/B位点进行基因及单倍体分型,并比较其基因型和单倍体型分布频率,探讨MBL基因多态性与新疆汉族人群结核病的关联。
1 材料和方法
1.1 研究对象
1.1.1 肺结核病例组 在新疆塔城、石河子、沙湾县等地区长期生活的汉族肺结核患者231例,其中男117例,女114例,年龄23~75岁,平均年龄39.2岁。入选标准为:①所有病例均按照1996年国家制定的肺结核诊断标准诊断为肺结核病;②无慢性阻塞性肺疾病、哮喘、肺癌、糖尿病、高血压等并发症;③无遗传病家族史;④所有病例均排除具有结核病相似病症者,同时排除HIV感染、肿瘤患者、长期使用激素、器官移植等免疫功能低下者;⑤在新疆地区居住时间20年以上。
1.1.2 正常对照组 与病例组生活地区相一致的汉族健康志愿者226例,其中男118例,女108例,年龄25~72岁,平均年龄36.8岁。入选标准为:①经胸部X线透视检查无活动性肺结核病灶、无病理钙化灶及病理性肺部阴影;②与病例组患者无血缘关系;③血清结核抗体检测阴性;④无慢阻肺、哮喘、肺癌、糖尿病、高血压等合并症;⑤无遗传病家族史和结核病史;⑥排除各种慢性病史以及接受激素治疗引起免疫功能低下者。
1.2 主要试剂 Taq DNA聚合酶(北京天根生物工程公司)、蛋白酶K(上海生物工程有限责任公司)、DNTP(北京天根生物工程公司)、MBL引物(上海生物工程有限责任公司)、琼脂糖(美国BBI公司)、DNA Marker(上海生物工程有限责任公司)、饱和酚/氯仿/异戊醇(上海生物工程有限责任公司)、溴酚蓝(宝生物大连有限公司)、三氯甲烷(天津大茂化学试剂厂)。
1.3 主要仪器 PCR自动扩增仪(美国Bio-metra公司)、Bio—RAD梯度 PCR仪(美国Bio-RAD公司)、DYY-4型电泳仪(北京六一厂)、Gel Doc 2000凝胶成像系统(美国Bio-RAD公司)、凝胶成像仪(美国伯乐公司)、T U-1800紫外分光光度仪(北京普析通用仪器有限公司)、UV—2401PC紫外分光光度计(日本岛津公司)、2-16K高速冷冻离心机(德国Sigma公司)、XW-80A涡旋振荡器(上海精科实验有限公司)。
1.4 外周血DNA的提取 采用酚-氯仿法提取全血基因组DNA。
1.5 MBL基因各位点的基因型和单倍体分型
1.5.1 引物设计及合成 参照文献,委托上海生物工程有限责任公司,分别针对MBL基因H/L、P/Q、A/B 3个多态位点设计合成5对特异性引物(所选择的位点、引物序列和引物位置见表1)。
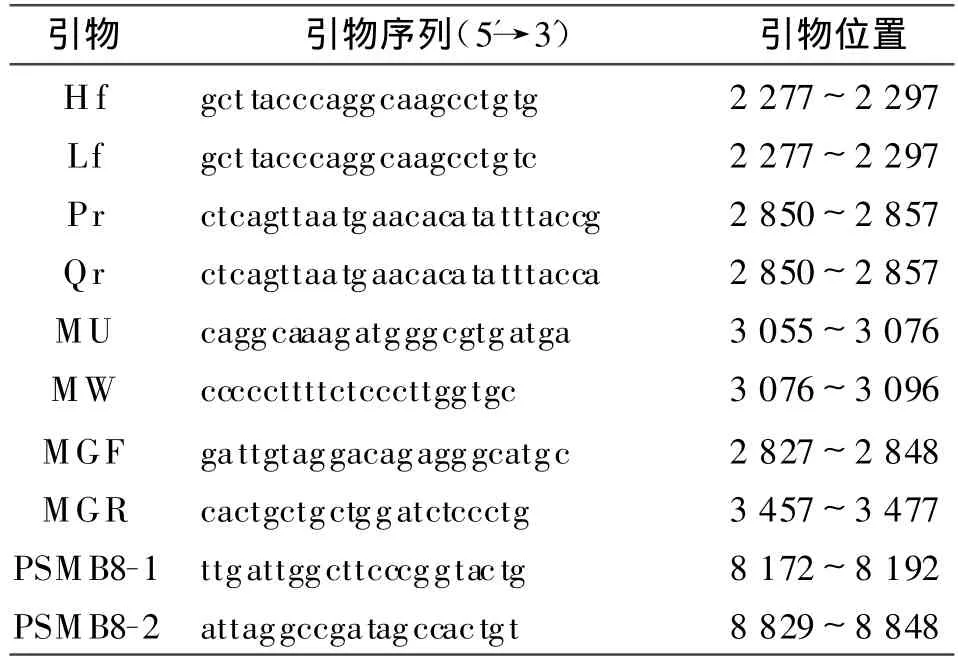
表1 MBL基因分型及单倍体分型所需的特异性及通用引物Table 1 The Primers sequence and size for MBL alleles
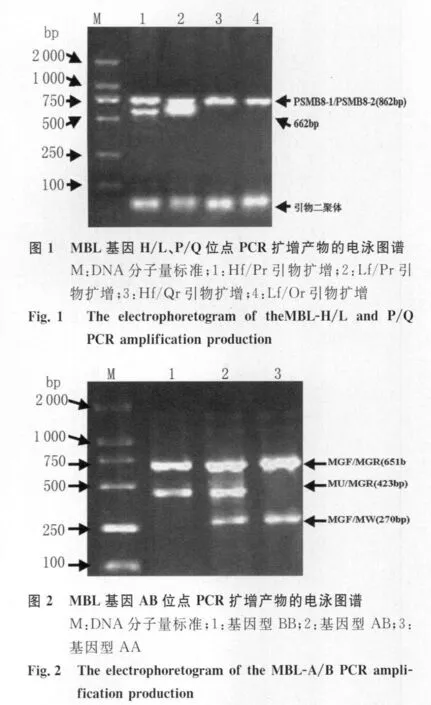
1.5.2 MBL基因的 H/L、P/Q和 A/B位点的PCR-SSP分析 正向序列特异性引物Hf/Lf与反向序列特异性引物Pr/Qr,4条引物两两配对,共计4对组合分别对每个模板进行扩增。通用引物对PSMB8-1/PSMB8-2作为阳性内参照,在有阳性内参照出现的情况下根据产生的特异性条带判断H/L、P/Q位点的基因型和单倍体型。其中通用引物对扩增的片断长度为862bp;4对特异性引物的扩增的片断长度分别为662bp。如图1所示:某个样本的Hf/Pr和Lf/Pr引物对扩增产物阳性,因此我们可以判断该样本上述两个位点的基因型分别为H L,PP;单倍体型则为 HP,LP。扩增体系为:ddH2O :14.5μ L;10 ×buffer(Mg2+Plus):2.5μ L;dNTP(2.5mmol/L):2.5μ L;PCR Primer:上下游各0.5μ L;TaqDNA Polymerase:0.5μ L;Template DNA :3.0μ L;HGH Primer:上下游各 0.5μ L;反应总量为25μ L。扩增条件:96℃预变性3min;96℃变性30s,62℃高温退火45s,72℃延伸45s,共计10个循环;96℃变性30s,60℃中温退火 45s,72℃延伸45s,共计20个循环;96℃变性45s,58℃低温退火60s,72℃延伸60s,共计 5个循环;72℃延伸5min。
1.5.3 MBL基因的A/B位点的PCR-SSP分析针对野生型A等位基因引物对是MW-MGF,针对变异型B等位基因引物对为MU-MGR,通用引物对MGF-MGR。在有阳性内参照出现的情况下根据产生的特异性条带判断MBL基因的A/B位点的基因型。通用引物对扩增的片断长度为651bp;A等位基因扩增的片断长度为270bp;B等位基因扩增的片断长度为423bp。扩增体系同前。扩增条件:96℃预变性 3min;96℃变性 30s,62℃退火 30s,72℃延伸30s,共计30个循环;72℃延伸5min。
1.6 分析方法 对所选样本进行Hardy-Weiberg平衡检验,结果表明两组资料的MBL各位点的基因型及单倍体型的频率的观察值和期望值之间的差异无统计学意义(P>0.05),说明样本基因型和单倍体型的频率分布符合Hardy-weinberg平衡定理,它们在病例组和对照组人群中的分布是均匀的,来自同一个孟德尔群体,可以进行下一步研究。
采用χ2检验方法分析比较肺结核病例组与正常对照组人群中等位基因型及单倍体型的分布情况,并计算OR值及95%的可信区间。统计过程使用双侧检验,P<0.05有显著性差异。应用SPSS11.5统计软件处理数据。
1.7 测序 选取10%MBL各位点等位基因PCR扩增产物,纯化回收后送往上海生物工程技术服务有限公司进行测序。
2 结 果
2.1 MBL各位点的等位基因和单倍体型的频率分布结果见表2、3。
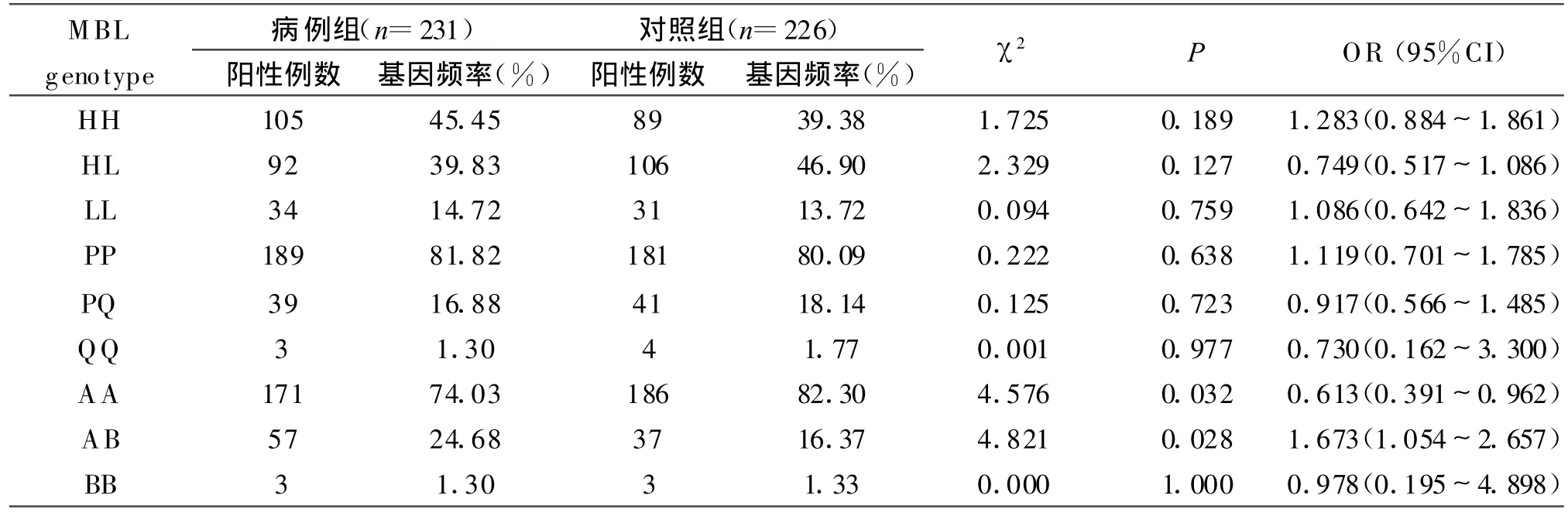
表2 MBL基因各位点的等位基因频率分布表Table 2 Allele locus frequencies of MBL genes
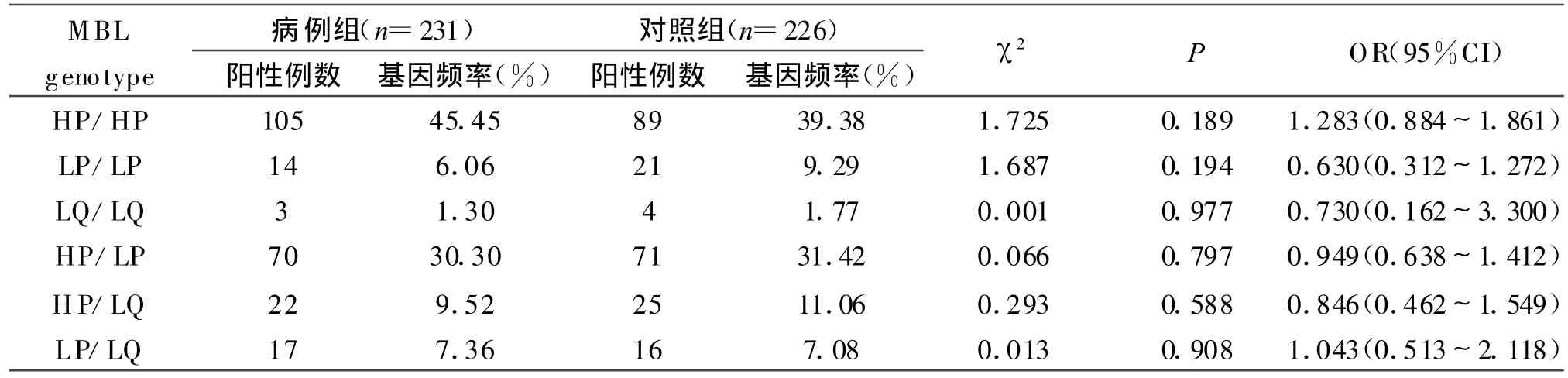
表3 MBL基因各位点的单倍体型频率分布表Table 3 Haplotypes locus frequencies of MBL genes
2.2 PCR结果 健康对照组中的MBL基因AA基因型的频率显著高于肺结核病例组,两组的频率值分别是82.30%和74.03%,两者经统计学分析有显著性差异(χ2=4.576,OR=0.613,P<0.05);肺结核病例组中的MBL基因AB基因型的频率显著高于健康对照组,两组的频率值分别为24.68%和16.37%,两者有统计学意义(χ2=4.821,OR=1.673,P<0.05)。而在所检测的MBL基因H/L、P/Q两个位点的等位基因及各单倍体型在两组间的分布则无显著性差异(P值均大于0.05)。
2.3 测序结果 随机抽取上述位点的各等位基因型及单倍体型10%的阳性例数,送往上海生物工程有限责任公司进行测序,结果显示经PCR扩增的目的片段与参考序列的同源性吻合率接近100%。
3 讨 论
MBL是天然免疫防御系统的重要组成部分[3],其主要通过调理吞噬和活化补体等方式来清除病原体。MBL发挥免疫防御功能有赖于一定的血清浓度和四级结构的多聚形式,血清MBL水平低下将导致机体调理吞噬功能缺损,而结构缺失将影响MBL发挥正常的补体活化功能,从而使机体易患感染[4]。
目前有较多的研究报道MBL基因多态性与结核病的易感性相关。国外有研究者发现[5-6],印度人与美国黑人肺结核病例MBL-54位点基因突变频率高于对照组;而在美国白种人、西班牙裔人、土耳其人中未发现MBL基因突变与肺结核有关联[6-7],甚至发现MBL-57位点基因突变型为肺结核的保护基因[8];Hoal-Van等[9]在南美研究发现MBL-54位点杂合子突变型与对抗结核性脑膜炎;另外有研究显示,在南非黑人当中,携带MBL的B等位基因的人不易患结核性脑膜炎和肺结核;LE Mombo[10]对非洲人群调查研究发现MBL-54、57位点基因突变型与结核病相关;Cosar[11]则发现 AB基因型和MBL血清低水平有益于抵抗结核病,特别是对于非洲肺结核儿童患者而言。国内学者冯福民[12-13]等人研究发现MBL-52、54位点基因突变型与北方汉族肺结核发病有关;而刘玮博士[14]等人对中国汉族人群的MBL基因H/L、X/Y、P/Q和A/B四个多态性位点进行基因型及单倍体型分析后发现HL和 LL基因型是结核病的抵抗基因;并且发现LPYB、LPXA单倍体型与肺结核发病有关联。
本课题采用序列特异性引物-聚合酶链反应(PCR-SSP)技术对MBL基因H/L、P/Q和A/B三个位点的多态性进行基因型和单倍体分型,发现MBL基因AB基因型可能是新疆汉族人群结核病的易感基因,这与冯福民文献报道的我国北方汉族人群结核易感等位基因结论相同,与国外部分文献报道的印度人、美国黑人、非洲人群的结核易感等位基因也一致;但与国外其它有些文献报道的结论相悖;而MBL基因AA基因型可能是结核病的抵抗基因这一结论迄今为止国内外尚未见有关报道。这进一步证实了结核病MBL基因的相关等位基因的分布存在人种、民族和地域的差异。
新疆汉族是我国比较特殊的一个群体,其特殊性在于它来源广泛。自古以来新疆就经历着各民族的迁徙融合,从西汉时起,中原汉族人就通过屯垦戍边的途径流入新疆。随着新中国的成立以及屯垦戌边政策的继续推行,全国各地更多的汉族人涌入该区域;所以我们从理论上可以推测其MBL基因的多态性融合了不同地区汉族人的特性,加上新疆地理、气候、饮食等环境因素与内地相差比较显著,有可能会引起久居于此的汉族人群这一整体的MBL基因多态性结构发生深刻的变化。而这很可能就是新疆汉族人群为什么是我国结核病高发人群的一个重要原因,也可能是当地汉族人MBL结核易感基因型独特性的原因所在。
虽然本课题研究未发现MBL基因H/L、P/Q位点的基因型以及其单倍体型与结核病有关联,但仅仅依据某次研究结果并不能完全否认其与结核病的发生发展有内在联系的可能。这是因为:MBL基因启动子区有三个SNP位点,分别为-550位的H/L,-221位的X/Y及+4位的P/Q,研究表明这三个位点并不独立,而是以一定形式的单倍体型存在,因此如果想探讨MBL基因多态性与结核病的关联,最好要对三个位点进行单倍体型检测,缺乏其中任何一个位点的研究都不会具备充足的意义。据以往的研究发现我国汉族人群外显子区仅有54位点突变,如果可以同时联合考察MBL基因结构区和启动子区在研究人群的连锁不平衡模式并进行单倍体型分析,或许更有助于找出与结核病相关联的遗传标记[15]。
由于结核病是多基因遗传病,个体对结核病易感性的差异,可能是由少数几个主效基因(major gene)或多个微效基因(minor gene)共同决定的[16];因此我们无法单从某个基因的多态性角度来完整的解释其与结核病易感性之间真正的关联;且结核病的发病与周围环境因素密切相关,这提醒我们在从宿主遗传角度探讨结核病易感性的时侯,要注意进行主效基因和微效基因间以及基因与特定环境因素间交互作用的研究。此外,无法排除样本量的不均和基因分型技术的不统一造成的研究结果缺乏可比性。因此,只有全面考察和分析比较结核病发病的各个层面和所有环节,我们最终才能确切清晰结核病发病的相关机制,为今后制定完善的防痨和抗痨等医疗措施奠定坚实的理论基础。
[1]Chou Koo I,Ohol YM,Wu P,et al.Role for lysosomal enzymeβhexosaminidase in the control of mycobacteria infection[J].Proc Natl Acad Sci USA,2008,105:710-5.
[2]Nair C.Working towards T B elimination the WHO Regional Strategic Plan[J].Commun Dis,2006,38:185-190.
[3]Ezekowitz RA,Role of the mannose-binding lectin in innate immunity[J].Infect Dis,2003,187(Suppl 2):S335-339.
[4]Fujita T.Evolution of the lectin-complement pathway and its role in innate immunity[J].Nat Rev Immunol,2002,2(5):346-353.
[5]Selvaraj P,Narayanan PR,Reetha AM.A ssociation of functional mutant homozygotes of the mannose binding protein gene with susceptibility to pulmonary tuberculosis in Indian[J].Tuber Lung Dis,1999,79(4):221-227.
[6]EL Sahly HM,Reich RA,Dou SJ,et al.The effect of mannose binding lectin gene poly morphisms on susceptibility to tuberculosis in different ethnic groups[J].Scand J Infect Dis,2004,36(2):106-108.
[7]Ozhas-Gerceker F,T ezcean I,Berkel AI,et al.The effect of mannose binding-protein gene polymorphisms in recurrent respiratory system infections in children and lung tuberculosis[J].Turk J Pediatr,2003,45(2):95-98.
[8]Bellamy R,Ruwende C,M cAdam KP,et al.Mannose binding protein deficiency is not associated with malaria,hepatitis B carriage nor tuberculosis in Africans[J].QJM,1998,91(1):13-18.
[9]Hoal-Van Helden EG,Epstein J,Victor TC,et al.Mannose-binding protein B allele confers protection against tuberculosis meningitis[J].Pediatr Res,1999,45:459-464.
[10]Mombo LE,Lu CY,Ossari S,et al.Mannose-binding lectin alleles in sub-Saharan Africans and relation with susceptibility to infections[J].Genes and Immunity,2003,4:362-367.
[11]Cosar H,Ozkinay F,Onay H,et al.Low leves of mannose-binding lectin confers protection against tuberculosis in Turkish children[J].Eur J Clin Microbiol Infect Dis,2008,27:1165-1169.
[12]冯福民,刘茜,郭梅,等.甘露醇结合蛋白基因突变与肺结核发病关系[J].中国公共卫生,2006,22(11):1353-1355.
[13]冯福民,郭梅,刘茜,等.甘露醇结合蛋白基因多态性与肺结核发病关系的研究[J].中华流行病学,2006,27(12):1082-1085.
[14]刘玮,张芳,赵秋敏,等.甘露糖结合凝集素基因多态性与肺结核易感性的研究[J].中国热带医学,2006,6(3):387-389.
[15]刘玮,张芳,赵秋敏,等.中国汉族军人甘露糖结合凝集素基因多态性分析[J].军事医学院,院刊,2006,30(1):22-25.
[16]Cheepsattayakorn A,Cheepsattayakorn R.Human genetic influence on susceptility of tuberculos-is:from infection to disease[J].J Med Assoc Thai,2009,92(1):136-141.
