日本血吸虫SCP/TAPS基因家族的生物信息学分析和克隆表达
2011-11-13陈静芳胡旭初王乐旬余新炳
陈静芳,胡旭初,王乐旬,余新炳
2.中山大学中山医学院病原微生物学教研室
血吸虫病是一个重大的全球性公共健康问题,据世界卫生组织调查统计,全球超过70个国家、高达2千万人口感染血吸虫;在中国,据统计2009年全国感染血吸虫病的人数为36.6万[1-2]。继人类基因组计划后,血吸虫基因组计划于1992年正式启动。2003年,nature杂志同时报道了对日本血吸虫和曼氏血吸虫转录谱的初期研究结果[3-4],随着日本血吸虫基因组测序的完成,对其不同发育阶段基因和蛋白表达动态变化的了解,将有助于探索血吸虫生长发育机制,寻找与其生长发育相关的关键的酶、功能蛋白或基因,为研制有效的阻断传播疫苗和新药开发提供科学指导。本研究从日本血吸虫EST数据库中筛选出一感兴趣的基因家族——SCP/Tpx-1/Ag5/Pr-1/ScT(SCP/TAPS)蛋白家族,通过生物信息学工具对日本血吸虫SCP/TAPS蛋白家族进行分析,并挑选出SjVAL2基因,将其构建到pET-28a(+)原核表达载体中,对表达产物进行初步的研究,为进一步阐明该基因家族的功能打下基础。
1 材料与方法
1.1 材料
1.1.1 血吸虫成虫、质粒及菌株 血吸虫成虫由感染的兔体内获得,原核表达质粒pET-28a(+)和大肠杆菌BL21/DE3由本室保存。
1.1.2 主要试剂与工具酶 Ex Taq酶(含dNTP)、BamH I、XhoI、T4 DNA 连接酶 、DNA 分子量标准(DL2,000)购自大连宝生物公司;异丙硫代-β-D半乳糖苷(IPTG)购自美国Promega公司;Ni-IDA Agarose(镍-亚氨基二乙酸琼脂糖)(cat No:69670)购自美国Novagen公司;蛋白分子量标准购自立陶宛MBI公司;DNA凝胶回收试剂盒及质粒纯化试剂盒购自北京赛百盛基因公司;抗6×His单克隆抗体购自美国Invitrogen公司;辣根过氧化物酶标记的羊抗小鼠IgG二抗及DAB(3,3二氨基联苯胺)显色试剂盒均购自武汉博士德生物工程有限公司;PVDF膜购自Millipore公司。
1.1.3 引物合成和DNA测序 引物合成和重组质粒DNA测序由上海英俊生物技术有限公司完成。
1.2 方法
1.2.1S.japonicumSCP/TAPS基因家族的获得和生物信息学分析 以黄蜂毒液抗原5(GenBank No.AAA30333)为检索源,通过tBLASTn检索日本血吸虫基因组数据库,检索出同源的EST序列。生物信息学软件分析各序列的结构域,多序列同源比对和分子进化树分析其进化规律,并以AAW24579蛋白为代表进行深入的研究。
1.2.2SjVAL2基因的扩增 根据已获得的编码序列,利用DNAClub和PCRdesign设计引物。上游 引 物 5′-TGCUGGATCCUATTCATT TACT TTATCAACC-3′,带BamH Ⅰ 酶切位点;下游引物5′-GTGUCTCGAGUTCATCTATTACATAACAAGGTC-3′,带XhoⅠ酶切位点。以日本血吸虫成虫cDNA为模板,95℃预变性10min后,热循环参数为 95℃1min,54℃1min,72℃1min,共 32个循环,最后72℃延伸10min。PCR产物行1%琼脂糖凝胶电泳回收。
1.2.3 重组表达质粒pET-28a(+)-SjVAL2的构建和鉴定 将PCR产物和原核表达质粒pET-28a(+)经BamHⅠ和XhoⅠ双酶切后回收,连接,转化大肠杆菌BL21/DE3感受态细胞,卡那霉素筛选阳性克隆。对阳性克隆提取质粒进行PCR,双酶切和测序鉴定。
1.2.4 重组蛋白的表达 将确定能表达重组蛋白的单菌落接种于5ml LB培养基中,过夜培养后转接到1 000 mL培养基中,培养至A600约为0.6时加入IPTG至终浓度为 l mmol/L,37℃250 r/min进行诱导,诱导5h后离心收菌,分别取上清和沉淀行SDS-PAGE电泳检测蛋白的表达。
1.2.5 菌体裂解、重组蛋白的纯化 按照上述方法对阳性克隆进行大量诱导表达,离心收集菌体,按每克菌体加入4 mL结合缓冲液重悬菌体,冰上放置30min后冰上超声裂解(功率150 W,持续 lS,停2S,共 15min),4℃,13 000 r/min离心20min收集沉淀。重组蛋白的纯化按Liu SenP[5]的方法进行,简而言之,首先用含1%SDS+0.1%β-巯基乙醇的PBS溶解包涵体,100℃加热煮沸10min后,用含0.1%SDS的 PBS溶液透析2次后,最后用含0.1%SDS的1×结合缓冲液透析后过柱纯化,纯化步骤参照Ni-IDA Agarose说明书进行,只是所有的缓冲液均含有0.1%SDS,纯化后的蛋白用PBS透析去除SDS,蔗糖浓缩后进行蛋白浓度测定,-80℃保存备用。
1.2.6 免疫印迹法检测重组蛋白的免疫反应性将纯化的重组蛋白行12%SDS-PAGE电泳,于100V冰浴转印1.5h,将蛋白转印到PVDF膜上,5%脱脂奶粉 4℃封闭过夜,PBS洗涤 3次,每次5min,分别转入抗6×His单克隆抗体(1∶1 000稀释)、日本血吸虫感染小鼠血清(1∶100稀释)和正常小鼠血清(1∶100稀释)中,室温孵育2h,PBS洗涤3次,每次5min。然后于辣根过氧化物酶标记的羊抗小鼠IgG(1∶1 000稀释)中室温孵育1h,PBS洗涤后DAB显色,去离子水终止反应。
2 结 果
2.1 生物信息学分析 以Vv Vesv5为检索源,通过tBLASTn检索S.japonicumEST数据库,共搜索出65条EST序列,经过序列比列,排除重复序列,共得到17条Unigene。NCBI保守结构域搜索,发现它们均具有SCP保守结构域;多序列比对分析发现S.japonicumSCP/TAPS蛋白可以分成三个亚组(图1),首先相较于第一组和第三组,第二组各成员存在一个相同的缺失区域(D1,图1);其次,第一组和第三组各蛋白所具有的保守半胱氨酸残基,第二组中的蛋白均没有;再次,目前为止有报道的植物寄生线虫 SCP/TAPS蛋白的标志之一——H YTQ保守基序在这三个组中均不相同P[6]。SjVAL2(AAW24579)属于第一组。SjVAL2基因全长654bp,编码区为15~596bp,编码193个氨基酸,同源比对分析发现其氨基酸序列与曼氏血吸虫SmVAL12一致性最高,达60%。

图1 日本血吸虫SCP/TAPS蛋白家族多序列比对图Fig.1 Multiple sequence alignment of S.japonicum SCP/TAPS family
2.2 重组质粒的鉴定 将重组质粒行PCR和双酶切鉴定,产物行1%琼脂糖凝胶电泳,在500~750bp之间有一清晰条带,与目的基因的大小基本相符,证明重组质粒构建成功。
2.3 重组蛋白表达纯化结果 将构建好的重组质粒转化入大肠杆菌BL21/DE3中,SDS-PAGE电泳分析结果显示如图3,第5泳道约25 kDa处出现表达条带,与目的蛋白分子量基本相符;第6泳道显示为蛋白纯化结果,纯化后测得蛋白浓度约0.6 mg/mL。
2.4 免疫反应性分析 Western-bloting显示,用日本血吸虫感染的小鼠血清(图4第1道)和抗His单克隆抗体(图4第2道)能识别纯化的重组蛋白,而正常小鼠血清(图4第3道)则不能识别。
3 讨 论
在病原体入侵宿主的过程中,许多蛋白、因子参与病原体——宿主的相互作用,如感染的发生和保持、激活或逃避宿主的免疫应答以及导致宿主病理的损伤。不同的蛋白超家族在病原体与宿主的相互作用中发挥着不同的生物学功能,sperm-coating protein(SCP)样蛋白就是其中的一员。SCP样蛋白也称为 SCP/Tpx-1/Ag5/PR-1/Sc7(SCP/TAPS),在许多真核生物中均发现有SCP/TAPS蛋白的存在,如果蝇、秀丽隐杆线虫、曼氏血吸虫、哺乳动物等[7-10]。不同物种中的SCP/TAPS蛋白一级结构具有一定的同源性,就是在一段信号肽后面是一个SCP保守结构域;不同物种之间以及同一物种内不同SCP/TAPS蛋白氨基酸序列也存在着显著的变异。有研究报道一些物种SCP/TAPS蛋白家族可以分为不同的亚群,如线虫SCP/TAPS蛋白家族可以分为3种类型P[11];果蝇和曼氏血吸虫则可分为2种亚群[7,9]。通过以黄蜂VvVesv5为检索源,tBLASTn检索日本血吸虫EST数据库,我们发现日本血吸虫中SCP/TAPS蛋白家族的存在,目前发现日本血吸虫有17个SCP/TAPS蛋白成员;多序列比对分析后,我们发现相对于曼氏血吸虫而言它们存在更多的变异,但基本上可以分为3个亚群(图1)。
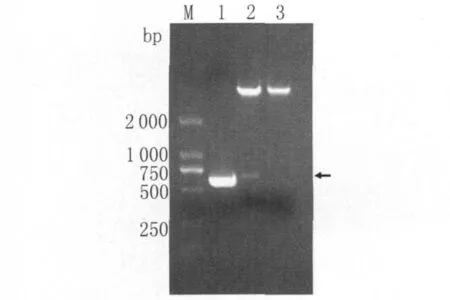
图2 重组质粒PCR及双酶切鉴定图M :DNA marker(DL 2000);1:PCR 产物;2:重组质粒pET-28a(+)-SjVAL2双酶切;3:空质粒 pET-28a(+)双酶切Fig.2 The identification of pET-28a(+)-SjVAL2 by PCR and digestion with restriction enzymesM :DL 2000 marker;1:PCR amplification;2:recombinant pET-28a(+)-SjVAL2 digested with BamHⅠand XhoⅠ restriction enzymes;3:empty pET-28a(+)digested with BamHⅠand XhoⅠ

图3 重组质粒原核表达产物的12%SDS-PAGE电泳分析M:蛋白Marker;1:pET-28a(+)质粒IPTG未诱导;2:pET-28a(+)质粒IPTG诱导;3:重组质粒 pET-28a(+)-SjVAL2 IPTG未诱导;4:重组质粒 pET-28a(+)-SjVAL2 IPTG诱导;5:超声后沉淀;6:纯化重组蛋白Fig.3 12%SDS-PAGE analysis of prokaryotic expression and purified productM :protein marker;1:pET-28a(+)without IPTG induction;2:pET-28a(+)after IPTG induction;3:pET-28a(+)-SjVAL2 without IPTG induction;4:pET-28a(+)-SjVAL2 inducted with IPTG;5:precipitants of lysate of E.coli with pET-28a(+)-SjVAL2 induced with IPTG;6:purified rSjVAL2
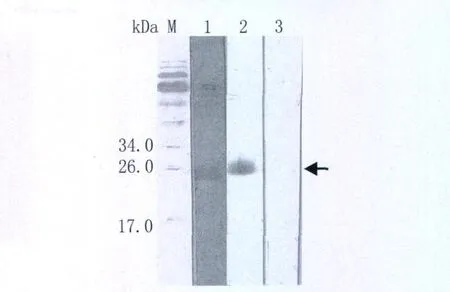
图4 纯化重组蛋白Western-blotting分析M:蛋白Marker;1:日本血吸虫感染小鼠血清;2:抗His单克隆抗体;3:正常小鼠血清Fig.4 Western blot analysis of rSjVAL2M,protein marker;1:rSjVAL2 probed with mouse serum infected with S.japonicum;2:with mAb-His;3:with normal mouse serum
SCP/TAPS蛋白在真核生物中发挥着重要的生物学功能,大多数SCP/TAPS蛋白为分泌性蛋白在细胞外起作用。目前,SCP/TAPS家族蛋白的确切功能还不是很清楚,不同物种有不同的功能报道,如免疫应答、生殖、病原体入侵、变态反应等,同时也是疫苗候选分子之一[12-14]。为研究日本血吸虫SCP/TAPS蛋白家族的功能,我们从中挑选出SjVAL2为代表作进一步的研究。在本研究中,我们成功构建了SjVAL2原核表达质粒,并获得重组表达蛋白。Western-blotting结果显示重组蛋白可被日本血吸虫感染小鼠血清识别,证实重组蛋白具有免疫反应性,为进一步研究日本血吸虫SCP/TAPS蛋白家族的功能打下基础,但日本血吸虫SCP/TAPS蛋白家族的具体功能还有待于进一步的研究。
[1]郝阳,郑浩,朱蓉,等.2009年全国血吸虫病疫情通报[J].中国血吸虫病防治杂志,2010,22(6):521-526.
[2]Bergquist N R.Schistosomiasis:from risk assessment to control[J].T rends Parasitol,2002,18(7):309-314.
[3]Hu W,Yan Q,Shen DK,et al.Evolutionary and biomedical implications of aSchistosoma japonicumcomplementary DNA resource[J].Nat Genet,2003,35(2):139-147.
[4]Verjovski-Almeida S,DeMarco RH,HMartins EA,et al.T ranscriptome analysis of the acoelomate human parasiteSchistosoma mansoni[J].Nat Gen,2003,35(2):148-157.
[5]Sen L,Ghosh K,Bin Z,et al.Hookwo rm burden reductions in BALB/c mice vaccinated with recombinant Ancylostoma secreted proteins(ASPs)fromAncy lostoma duodenale,Ancy lostoma caninumandNecator americanus[J].Vaccine,2000,18(11-12):1096-1102.
[6]Hawdon JM,HJones BFH,HHoffman DR,et al.Cloning and characterization ofAncylostoma-secreted protein,a novel protein associated with the transition to parasitism by infective hookwo rm larvae[J].J Biol Chem,1996,27(12):6672-6678.
[7]Kovalick GE,G riffin DL.Characterization of the SCP/TAPS gene family inDrosophila melanogaster[J].Insect Biochem Mol Biol,2005,35(8):825-835.
[8]O'Rourke D,Baban D,HDemidova M,et al.Genomic clusters,putative pathogen recognition molecules,and antimicrobial genes are induced by infection ofC.eleganswithM.nematophilum[J].Genome Res,2006,16(8):1005-1016.
[9]Chalmers IW,M cArdle AJ,Coulson RM,et al.Developmentally regulated expression,alternative splicing and distinct sub-groupings in members of theSchistosoma mansonivenom allergen-like(SmVA L)gene family[J].BMC Genomics,2008,9:89.
[10]Kasahara M,Gutknecht J,Brew K,et al.Cloning and mapping of a testis-specific gene with sequence similarity to a sperm-coating glycoprotein gene[J].Genomics,1989,5(3):527-534.
[11]Cantacessi C,Campbell BE,Visser A,et al.A portrait of the"SCP/T APS"proteins of eukaryotes-developing a framework for fundamental research and biotechnological outcomes[J].Biotechnol Adv,2009,27(4):376-388.
[12]Fitzpatrick JM,Johnston DA,Williams GW,et al.An oligonucleotide microarray for transcriptome analysis ofSchistosoma mansoniand its application/use to investigate gender-associated gene expression[J].Mol Biochem Parasitol,2005,141(1):1-13.
[13]Murray J,Gregory WF,Gomez-Escobar N,et al.Expression and immune recognition ofBrugiamalay iVAL-1,a homologue of vespid venom allergens andAncy lostomasecreted proteins[J].Mol Biochem Parasitol,2001,118(1):89-96.
[14]Ghosh K,Hotez PJ.Antibody-dependent reductions in mouse hookworm burden after vaccination withAncylostoma caninumsecreted protein[J].J Infect Dis,1999,180(5):1674-1681.
