一维链状三环己基锡羧酸酯的合成、晶体结构及生物活性
2011-11-09阿达玛杜大峰朱东升
阿达玛 杜大峰 朱东升 许 林
(东北师范大学化学学院,长春 130024)
一维链状三环己基锡羧酸酯的合成、晶体结构及生物活性
阿达玛 杜大峰 朱东升*许 林
(东北师范大学化学学院,长春 130024)
本文以含酯基刚性一元酸L1H(8-乙氧羰基-1-萘甲酸)和含羰基柔性一元酸L2H(4-羰基-4-苯基丁酸)作为多齿配体,分别与三环己基氢氧化锡发生自组装反应,获得了2个新型三环己基锡羧酸酯配合物[(C6H11)3SnL1](1)和[(C6H11)3SnL2](2)(C6H11为环己基)。采用元素分析、1H NMR、FTIR及晶体结构测定等手段对配合物1和2进行了结构表征,在2个新配合物中,锡原子均为六配位,构成以锡原子为中心的扭曲单加帽三角双锥构型,并且通过O→Sn分子间配位键形成了一维超分子链。初步研究了杀菌活性和抗癌活性。
有机锡羧酸酯;三环己基氢氧化锡;8-乙氧羰基-1-萘甲酸;4-羰基-4-苯基丁酸;晶体结构;生物活性
在过去的几十年里,有机锡碳酸酯由于具有广泛的生物活性、催化活性和新奇多变的结构[1-4],一直受到人们的高度重视。文献报道了单体、二聚体、四聚体、低聚梯形、六聚鼓形、一维、二维和三维等结构的有机锡羧酸酯[5-6]。到目前为止,通过O→Sn分子间配位形成的一维链状有机锡羧酸酯中,与锡原子成键和分子间配位的2个氧原子来源于同1个羧基(Scheme 1)[7-9],2个相邻锡原子均间隔3个原子(0.519±0.021)nm[8]。
为了使与锡原子成键和分子间配位的2个氧原子来源不同的基团,也就是使2个相邻的锡原子间隔更多个原子,进一步探究一维链状有机锡羧酸酯新的配位模式。本文以含酯基刚性一元酸L1H(8-乙氧羰基-1-萘甲酸)和含羰基柔性一元酸L2H(4-羰基-4-苯基丁酸)作为多齿配体,分别与三环己基氢氧化锡发生自组装反应,获得了2个未见文献报道的三环己基锡羧酸酯配合物[(C6H11)3SnL1](1)和[(C6H11)3SnL2](2)(C6H11为环己基)(Scheme 2)。在配合物1中,8-乙氧羰基-1-萘甲酸的羧基氧原子与锡原子成键,酯基氧原子与锡原子形成分子间配位键,2个相邻锡原子间隔7个原子(0.699 6 nm);在配合物2中,4-羰基-4-苯基丁酸的羧基氧原子与锡原子成键,并发现尚未见报道的羰基氧原子与锡原子形成分子间配位键,2个相邻锡原子间隔6个原子 (0.7280 nm);获得的重要结果是使相邻的2个锡原子距离从(0.519±0.021)nm 增大到 0.7280 nm,2 个新配合物均通过O→Sn分子间配位键形成一维超分子链。初步生物活性测试结果表明,新配合物1和2具有一定抑菌性和抗癌活性,这一结果为进一步研究有机锡羧酸酯的构效关系,提供了重要信息。

Scheme 1 One-dimensional supramolecular chain through intermolecular Sn…O interactions

Scheme 2 Synthetic routes of the complexes 1 and 2
1 实验部分
1.1 试剂与仪器
4-羰基-4-苯基丁酸L2H按文献[10]方法合成;其它试剂均为分析纯。
Perkin-Elmer PE 2400 CHN元素分析仪(美国);锡含量用重量法测定;Vertex 70 FTIR型红外光谱仪 (德国),KBr压片;WRS-1A 数字熔点仪 (上海);Bruker AV 300 MHz型核磁共振仪 (瑞士),溶剂为CDCl3,内标 TMS;Bruker Smart Apex CCD 射线衍射仪(德国)。
1.2 配合物1和2的合成
将三环己基氢氧化锡(0.385 g,1 mmol)和配体L1H(0.244 g,1 mmol)加入到 50 mL 苯中,搅拌回流分水,反应6 h,达到理论脱水量。减压蒸去溶剂,剩余物用乙醇重结晶2次,获得配合物1,产率62%。m.p.138~140 ℃。IR(KBr压片,cm-1):480,539,1 397,1 638;1H NMR (CDCl3,ppm),δ:1.33(t,3H,CCH3),1.42~1.52(m,33H,cyclohexyl-H),4.25(q,2H,OCH2),7.15~8.60(m,6H,Ar-H)。Anal.Calcd.for C32H44O4Sn(%):C 62.86,H 7.25,Sn 19.42;found(%):C 62.88,H 7.20,Sn 19.35。
同上操作,将配体L1H换成配体L2H(0.178 g,1 mmol),获得配合物 2,产率 68%。m.p.110~112 ℃。IR(KBr压片,cm-1):485,549,1414,1637;1H NMR(CDCl3,ppm),δ:1.43 ~1.54(m,33H,cyclohexane-H),2.39(t,2H,CH2-COOSn),2.79(t,2H,CH2-COC6H5),7.34~7.89(m,5H,Ar-H)。Anal.Calcd.for C28H42O3Sn(%):C 68.85,H 4.95,Sn 26.20;found(%):C 68.87,H 4.90,Sn 26.17。
1.3 晶体结构测定
在乙醇中培养配合物1和2的单晶,分别取尺寸为 0.42 mm×0.37 mm×0.32 mm 和 0.40 mm×0.32 mm×0.27 mm 的单晶,用 Bruker Smart Apex CCD 单晶衍射仪收集衍射数据。在(296±2)K下,用经过石墨单色化的 Mo Kα(λ=0.071073 nm)作为入射辐射,以 ω-φ 扫描方式,分别在 3.62°≤2θ≤52.92°和 3.72°≤2θ≤50.04°范围内共收集 6111 和 4705 个独立衍射强度数据,其中3 488和3 968个为可观测点(I>2σ(I)),并用于结构修正,晶体结构用 SHEXS-97程序由直接法解解出,部分非氢原子坐标在随后的数轮差值Fourier合成中陆续确定。全部非氢原子坐标及其各向异性热参数用SHEXL-97程序[11]进行最小二乘法精修,最终残差因子R1=0.0487和0.0350。
1.4 生物活性实验
1.4.1 抑菌实验
培养皿及实验器材均经180℃的高温灭菌处理2 h。普通肉汤琼脂培养基用稀碱调节pH值为7.2~7.4 后,于 20 ℃灭菌处理 30 min。取 5 mL 培养基倾入培养皿中,制成平板,冷却至室温,将2 mL(1×1012cfu·mL-1)菌液平铺于平板中,涂抹均匀,形成菌液膜。吸取0.2 mL一定浓度样品的乙醇溶液,均匀喷洒到直径为0.3 cm的滤纸片上,待乙醇挥发后,将滤纸片盖在培养皿的中央,置于37℃培养箱中恒温培养24 h,取出,测量抑菌圈直径。
1.4.2 抗癌实验
取处于对数生长期的Hela细胞,加入适量的Trypsin液消化,使贴壁细胞脱落,用10 mL含质量分数为10%的新生牛血清的RPMI 1640培养液配成单细胞悬液。计数后,用完全培养液稀释成10×105cell·mL-1的细胞悬液。取96孔板,每孔加上述细胞悬液100 μL,在含体积分数为5%的CO2的培养箱内于37℃下培养24 h。依次加入6个浓度的样品和DMSO,每个浓度4孔。于前述培养箱条件下,继续培养48 h,培养终止前2 h,每孔加入1 mg·mL-1的 MTT 100 μL,继续温育 4 h,吸去上清液,每孔加入150 μL的酸性DMSO,摇匀,用酶标仪于570 nm处测定每个小孔的OD值。
2 结果与讨论
2.1 红外光谱分析
配体L1H和L2H的红外光谱中,在3 443和2 800 cm-1处存在O-H伸缩振动和OH…O缔合吸收峰。羧基与锡原子成键后,O-H和OH…O的吸收峰消失,相应的吸收峰发生了明显变化,νas(COO)和νsym(COO)分别发生红移[10]。用 νas(COO)与 νsym(COO)的差值Δν可以判断有机酸配体与金属原子反应后羧基的配位模式,如果Δν小于200 cm-1羧基是双齿配位,如果大于200 cm-1羧基是单齿配位[12-13]。配合物1和2的不对称振动νas(COO)和对称伸缩振动νsym(COO)的吸收峰分别为 1 638,1 637 和 1 397,1414 cm-1,二者相差 Δν(νas(COO)-νsym(COO))分别为241和223 cm-1,表明配合物1和2的羧基应该均以单齿形式与Sn原子配位[12-13]。但由于Δν值与200 cm-1非常接近,可能羧基上未成键氧原子与锡原子形成了分子内配位,而且配合物2的配位键比配合物1强,该结果与X射线单晶衍射结果一致。480和485 cm-1归属为Sn-O的振动吸收峰,539和549 cm-1归属为Sn-C的振动吸收峰[14-15]。
2.2 配合物1和2的晶体结构分析
配合物1和2的晶体学参数列于表1,部分键长和键角数据列于表2,分子结构见图1,通过O→Sn分子间配位键形成一维超分子链见图2。
CCDC:796811,1;796812,2。

表1 配合物1和2的晶体学参数Table 1 Crystal data and structural refinement parameters for complexes 1 and 2

表2 配合物1和2部分键长和键角数据Table 2 Selected bond lengths(nm)and angles(°)for complexes 1 and 2

H atoms are omitted for clarity,thermal ellipsoids are drawn at 30%probability level

图2 配合物1和2分别通过O→Sn分子间配位键形成一维超分子链Fig.2 Perspective view of one-dimentional chain formed by intermolecular O→Sn interactions of complexs 1 and 2
在配合物1和2解析结构过程中,对配合物1的无序的环戊烷通过设置自由变量精修进行了无序的处理,在此基础上对 C21、C22a、C22b、C35 进行了限制性精修。对配合物2的C18和C19进行了限制性精修,对C3-C4,C20-C21的键长进行了限制性精修,C3-C4和C20-C21的键长均在C-C单键允许的键长范围。从图1可以看出,在配合物1和2的晶体结构中,各存在1个独立分子,没有溶剂分子。锡原子均为四配位,分别与来自3个环己基3个碳原子和羧基1个氧原子相连,构成以锡原子为中心的畸变四面体构型[SnC3O]。二者的Sn-O键长比与类似报道的相应键长要短0.04 nm左右[16]。值得注意的是,配合物1和2的Sn1…O2距离分别为0.3209和0.294 3 nm,远大于共价半径之和0.216 nm,却明显小于Sn-O范德华半径之和0.368 nm[17],可以认为它们之间存在着弱相互作用,这种Sn1…O2弱配位分别靠近配合物1的键角C27-Sn1-C21和配合物2的键角C27-Sn1-C21。由于Sn1…O2弱配位的存在,使键角C27-Sn1-C21(119.8(2)°)和C17-Sn1-C11(122.4(2)°)大于所有以锡原子为顶点的键角;使键角 O1-Sn1-C33(91.21(16)°)和 O1-Sn1-O31(92.46(16)°)小于所有以锡原子为顶点的键角(见表2)。由于配合物1和2的有机酸配体分别是刚性和柔性的,配合物1的配体空阻碍要比配合物2的大,使配合物2的配位键键长0.294 3 nm比配合物1的配位键键长0.320 9 nm短,表明配合物2的分子内配位能力比配合物1强。
更值得注意的是,配合物1和2的中心锡原子偏离由C21、C27和C33组成的平面及由C11、C17和C31组成的平面距离分别为0.03687和0.04100 nm,偏离的距离很微小,可以证明配合物1的中心锡原子处于由C21、C27和C33组成的平面上,配合物2的中心锡原子处于由C11、C17和C31组成的平面上,构型趋向于三角锥形构型(见图1),由此可以判断,锡原子还应该存在配位键。经计算结果表明,在配合物1和2的中心锡原子Sn1与另一分子的O3A之间的距离分别为0.316 8和0.318 4 nm,均小于范德华半径之和(0.368 nm)[17],证明锡原子分别与配合物1中的酯基氧原子或配合物2的羰基氧原子形成了O→Sn分子间配位。这种模式的分子间配位是非常特殊的,到目前为止没有类似报道。已经报道的分子间配位都是与锡原子成键和分子间配位的2个氧原子来源于同一个羧基,2个相邻锡原子均间隔 3 个原子(0.519±0.021)nm[7-9]。由于分子内和分子间配位的存在,使配合物1和2的中心锡原子成为了六配位,分别与来自3个环己基3碳原子、羧基2个氧原子和另1个分子的酯基或羰基1个氧原子相连,中心锡原子的几何配位更确切地应描述为的扭曲单加帽三角双锥构型。
通过O→Sn分子间配位键无限地连接,使2个新配合物形成了一维链状超分子有机锡羧酸酯(见图2)。在配合物1和2中,2个相邻锡原子间分别相隔7和6个原子,Sn…Sn间距离分别是0.6996和0.7280 nm,比已报道的相邻的 2 个锡原子距离(0.519±0.021)nm更长[8],这是一个非常重要的结果。
2.3 生物活性
2.3.1 抑菌活性
分别检测了配体L1H、配体L2H、三环己基氢氧化锡、配合物1和2对大肠杆菌的抑制作用,结果列于表3。从表3结果可以看出,配体L1H和配体L2H对大肠杆菌的抑制效果较差,三环己基氢氧化锡具有一定的抑菌效果,相比之下,配合物1和2对大肠杆菌的抑制效果较高。可见抑菌活性的大小顺序为配合物1>配合物2>三环己基氢氧化锡>配体L1H>配体L2H。

表3 在37℃抗菌活性Table 3 Antimicrobial abilities at 37℃
2.3.2 抗癌活性
实验采用四氮唑盐还原法(MTT法)[20]测定了L1H、配体L2H、三环己基氢氧化锡、配合物1和配合物2对Hela肿瘤细胞的抑制作用,测试结果见图3。在所设计的最高浓度 6.4 μg·mL-1时,L1H 和 L2H对Hela肿瘤细胞的抑制率分别为12.8%±1.6%和13.5%±2.1%,可以看出配体L1H对Hela肿瘤细胞抑制率比配体L2H略低。从图3和测试数据可知,三环己基氢氧化锡对Hela肿瘤细胞抑制率比配体L1H和L2H高,但比由其获得的配合物低,配合物1对Hela肿瘤细胞抑制率比配合物2高。相比之下,抑制率高低顺序为配合物1>配合物2>三环己基氢氧化锡>L2H>L1H(见图 3)。当质量浓度达到最高 6.4 μg·mL-1时,配合物1和2对HeLa细胞的抑制率分别达到 91.6%±0.9%和 87.7%±0.3%,其 IC50值分别为 2.2 和 2.4 μg·mL-1,从而说明配合物 1 和 2 具有一定的抗肿瘤作用。
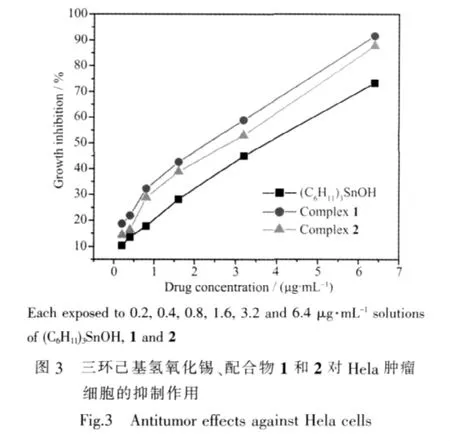
图3 三环己基氢氧化锡、配合物1和2对Hela肿瘤细胞的抑制作用Fig.3 Antitumor effects against Hela cells
从抑菌和抗癌的生物活性测试结果来看,可以发现三环己基氢氧化锡的生物活性大于配体,由二者通过自组装反应,互相修饰,获得的配合物的生物活性最高。因此,可以选择各种有机酸和有机锡,经过修饰,检测生物活性,研究构效关系,发现规律,必将设计出生物活性更强的有机锡羧酸酯。
[1]DU Zhi-Ping(杜治平),LIU Liang(刘亮),WANG Gong-Ying(王公应),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(12):2225-2228
[2]WANGJian-Qiu(王剑秋),ZHANGFu-Xing(张复兴),KUANG Dai-Zhi(邝代治),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(5):2225-2228
[3]YINHan-Dong(尹汉东),WANG Chuan-Hua(王传华),WANG Yong(王勇),et al.Acta Chim.Sinica(Huaxue Xuebao),2002,60:143-149
[4]GAO Zhong-Ju(高中军),MU Jin-Xiu(牟金秀),WANG Guang-Hui(王广辉).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(11):1916-1918
[5]DENGYi-Fang(邓奕芳),CHENMan-Sheng(陈满生),ZHANG Chun-Hua(张春华),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(12):2229-2232
[6]Chandrasekhar V,Nagendran S,Baskar V.Coord.Chem.Rev.,2002,235:1-52
[7]Willem R,Verbruggen I,Gielen M,et al.Organometallics,1998,17:5758-5766
[8]Baul T S B,Masharing C,Basu S,et al.J.Organomet.Chem.,2006,691:952-965
[9]WANG Yan-Hua(王艳华),YE Zhang-Ji(叶章基),JIN Xiao-Hong(金晓鸿),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(1):145-148
[10]Sun H T,Li Y,Duan X H.J.Dystuffs.Color.,2004,41:289-292
[11]Sheldrick G M.SHELXL-97,A Program for Structure Refinement,Göttingen,University of Göttingen,1997.
[12]Zubita J A,Zuckerman J.J.Inorg.Chem.,1987,24:251-258
[13]Teoh S G,Ang S H,Declercq J P D.Polyhedron.,1997,16:3729-3735
[14]Dey D K,Saha M K,Das M K,et al.Polyhedron.,1999,18:2687-2696
[15]Kovala-Demertzi D,Dokorou V N,Jasinski J P,et al.J.Organomet.Chem.,2005,690:1800-1086
[16]Ng S W,Chen W,Kumar Das V G.J.Organomet.Chem.,1988,345:59-64
[17]Bondi A.J.Phys.Chem.,1964,68:441-451
[18]GAO Jian(高健),XU Xing-You(许兴友),XU Tong-Tao(许同桃),et al.Chin.J.Appl.Chem.(Yingyong Huaxue),2006,23:173-176
[19]WANG Zhan-Liang(王占良),ZHU Dong-Sheng(朱东升),WANG Rong-Sun(王荣顺).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2008,29:876-881
[20]Varvaresou A,Iakovou K.Anticancer Research,2005,25:2253-2258
The One-Dimensional Chain:Synthesis,Crystal Structure and Biological Activities of Tricyclohexyl Tin Carboxylates
ADAMA Moussa Sakho DU Da-Feng ZHU Dong-Sheng*XU Lin
(Faculty of Chemistry,Northeast Normal University,Changchun 130024,China)
Two new supramolecular chains,namely[(R)3SnL1](1)and[(R)3SnL2](2)(where R=cyclohexyl,HL1=8-(ethoxycarbonyl)-1-naphthoic acid,HL2=4-cyclohexyl-4-oxobutanoic acid),were synthesized by the self-assemble reaction of R3SnOH with the corresponding acids in a suitable mole ratios respectively.Complexes 1 and 2 were structurally characterized by elemental analyses,FTIR spectroscopy,1H NMR spectroscopy and single crystal X-ray diffraction analysis.The tin atom in complexes 1 and 2 adopts distorted monocapped trigonal bipyramidal geometry with six-coordinated,and exhibits a one-dimensional supramolecular chain through intermolecular O→Sn interactions.The complexes 1 and 2 show antibiotic and anti-tumour activities in vitro experiments.CCDC:796811,1;796812,2.
organotin carboxylate;tricyclohexyltin hydroxide;8-(ethoxycarbonyl)-1-naphthoic acid,4-cyclohexyl-4-oxobutanoic acid;crystal structure;biological activity
O614.43+2
A
1001-4861(2011)01-0107-07
2010-05-24。收修改稿日期:2010-08-24。
国家自然科学基金(No.20971019)和吉林省科学技术厅科研基金(No.20060571,20070406)资助项目。*
。E-mail:zhuds206@nenu.edu.cn
