金龙胆草总皂苷诱导Hela细胞和SPC-A1细胞凋亡的研究
2011-11-09刘培周立军苏艳芳颜世伦天津大学药物科学与技术学院天津市300072河北化工医药职业技术学院石家庄市050026
刘培,周立军,苏艳芳,颜世伦(.天津大学药物科学与技术学院,天津市300072;2.河北化工医药职业技术学院,石家庄市 050026)
金龙胆草为白酒草属植物苦蒿Conyza bliniiLevl.的干燥全草,主要分布于我国西南地区,系20世纪70年代四川省发掘的民间草药,具有清热解毒、消炎祛痰、止咳平喘之功效,临床用于治疗慢性气管炎、胃肠炎、肾炎、肝炎、痢疾、口腔炎、中耳炎、风火牙痛、湿疹、痔疮、外伤出血、烫火伤及牲畜创伤[1]。金龙胆草及其制剂在1997年版《中国药典》(一部)和《四川省药品标准》中收载[2]。目前关于金龙胆草是否具有抗癌活性的报道尚未发现。本研究以宫颈癌Hela细胞和肺癌SPC-A1细胞为模型,旨在通过研究金龙胆草总皂苷对Hela细胞和SPC-A1细胞增殖的影响,探讨金龙胆草总皂苷的抗癌机制。
1 仪器与材料
1.1 仪器
XD-101型倒置生物显微镜(南京江南光电股份有限公司);SUNRISE型酶标仪(上海麦莎生物科技有限公司);BioDoc-It 220型凝胶成像系统(美国UVP公司)。
1.2 试药
金龙胆草产于四川省凉山州,经天津大学药物科学与技术学院周立军副教授鉴定为真品;RPMI 1640培养基(美国Gibco公司);胰蛋白酶(美国Amresco公司);蛋白酶K、RNA酶A(RnaseA,上海生工生物工程技术服务有限公司);羊抗兔半胱氨酰天冬氨酸特异性蛋白酶-3(Caspase-3)单克隆抗体、羊抗兔α-actin单克隆抗体、羊抗兔IgG-HRP抗体(武汉博士德生物工程技术服务有限公司)。
1.3 细胞
宫颈癌细胞系Hela细胞和肺癌细胞系SPC-A1细胞,购自天津市肿瘤研究所。
2 方法
2.1 金龙胆草总皂苷的制备
按顺序进行下列步骤:(1)将经过粉粹的金龙胆草在90%无水乙醇中加热回流提取2次,每次2 h,过滤后将滤渣用55%~65%的乙醇加热回流提取2 h并过滤,将2次滤液合并,然后减压浓缩至乙醇完全挥发;(2)将上述浓缩液用蒸馏水稀释至浓度为10~20 g·100 mL-1,然后在分液漏斗中用等量乙酸乙酯萃取4次以去除杂质,并将水层减压蒸至乙酸乙酯完全挥发,之后再于分液漏斗中用等量正丁醇萃取多次,直至萃取完全,最后将合并后的正丁醇萃取液减压浓缩而得到粗皂苷;(3)将上述粗皂苷溶于水并经大孔树脂D101柱层析,然后依次用水、30%乙醇、70%乙醇和95%乙醇进行梯度洗脱,最后将70%的乙醇洗脱物减压浓缩,即可得到金龙胆草总皂苷[3]。
2.2 细胞培养
细胞以1×107个·mL-1的浓度接种于25 cm2培养瓶中,加入RPMI 1640培养液(含5%胎牛血清、100 U·mL-1青霉素、100 U·mL-1链霉素)适量,置于37℃、5%CO2培养箱中培养,培养24 h后换液去除未贴壁细胞,倒置生物显微镜下每天观察细胞生长情况。将长成致密单层细胞的细胞瓶中原培养液弃去,PBS漂洗2次,加入0.25%胰酶溶液,以使充分浸润,一般消化时间为3 min,肉眼观察瓶壁半透明的细胞层,当出现细针孔空隙时,加入适量细胞培养液中和胰酶,终止消化,视试验要求传入多瓶继续培养,一般为一传二到一传四的比例[4]。
2.3 MTT法检测金龙胆草总皂苷对细胞的抑制作用
用0.25%的胰酶消化液1 mL,37℃消化细胞3 min,显微镜下观察胞质回缩、细胞间隙增大即细胞变圆后,终止消化;加入含10%胎牛血清(FBS)的培养液中和胰酶;细胞计数,将细胞稀释至2×104个·mL-1,加入96孔板中,每孔加200 μL细胞悬液;待细胞进入指数生长期加入药物;用培养基将试验组(金龙胆草总皂苷,根据提取单品的质量和分子量计算出总皂苷的分子量约为1 200)和阳性对照组(顺铂,DDP)10倍系列稀释,浓度依次为 10-3、10-4、10-5、10-6、10-7mol·L-1,并做空白对照。加药分别孵育24、48、72 h后,加5 g·L-1MTT继续孵育4 h,弃培养液,每孔加入DMSO 150 μL,酶标仪490 nm波长测吸光度(A)值,计算细胞半数抑制率(IC50)。细胞抑制率(%)=(1-试验或阳性对照组A值)/空白对照组A值×100%。试验重复3次,每个浓度设5个复孔。
2.4DNA凝胶电泳
将阳性对照组和试验组分别加入含有IC50(mol·L-1)浓度药物的培养液,空白对照组更换新鲜培养液,培养48 h后吸出培养液并用胰酶消化,离心弃上清,PBS漂洗2次,加细胞核裂解液500 μL重悬细胞,50℃水浴3 h;加0.5 mL Tris饱和酚抽提,4 ℃、6 000 r·min-1离心5 min,上清移至新离心管;加入等体积氯仿-异戊醇(24∶1)抽提,离心,上清移至新离心管;加50 μL 3 mol·L-1乙酸钠和2 mL预冷无水乙醇,上下颠倒几次混匀,可见絮状白色沉淀物。置-20℃冰箱中30 min,4℃、12 000 r·min-1离心10 min沉淀 DNA,晾至半干后,加入含5 μL Rnase A的TE缓冲液50 μL,37℃水浴30 min即可。制备1%琼脂糖凝胶电泳,DNA样品与上样缓冲液混匀上样,置1×TAE电泳缓冲液中,室温、恒流75 mA电泳1~2 h,以DNA Marker DL2 000为分子量标准,UVP凝胶成像系统观察结果。
2.5 Western Blot法[5]检测药物对Caspase-3含量的影响
将细胞传代至培养瓶中,待细胞长至80%融合时,阳性对照组和试验组分别加入含有IC50(mol·L-1)浓度药物的培养液,空白对照更换新鲜培养液,于37℃、5%CO2的细胞培养箱中培养48 h,PBS漂洗,加4℃预冷的细胞裂解液[1 mol·L-1Tris-HCl(pH8.0)、0.15 mol·L-1NaCl、1%TritonX-100、0.5 mmol·L-1PMSF),于冰上裂解30 min后,4 ℃、12 000 r·min-1离心5 min。最后将离心后的上清液分装到离心管中放于-20℃保存。采用10%分离胶、4%浓缩胶进行聚丙烯酰胺凝胶电泳,经转膜仪(400 mA,2 h)将蛋白转于PVDF膜上,用5%脱脂奶粉封闭,摇床轻摇1 h,TBST(包含Tris-Hcl缓冲液+吐温20)漂洗15 min×3次,加一抗(含兔抗鼠Caspase-3单克隆抗体和兔抗鼠α-actin单克隆抗体的5%脱脂奶粉液),4℃轻摇过夜。次日取出膜,用TBST漂洗15 min×3次,加入二抗(含羊抗兔IgG-HRP的5%脱脂奶粉液),室温轻摇1 h,TBST洗膜15 min×3次。滴加1∶1 ECL显色液于膜上,反应3 min,压片5 min,将胶片置于显影液和定影液各5 min后观察。
2.6 统计学方法
所得数据均以±s表示,采用SPSS11.50统计软件进行分析。
3 结果
3.1 形态学观察
Hela细胞和SPC-A1细胞均为上皮样细胞,呈多角形、铺路石状生长。倒置显微镜下细胞形态见图1。
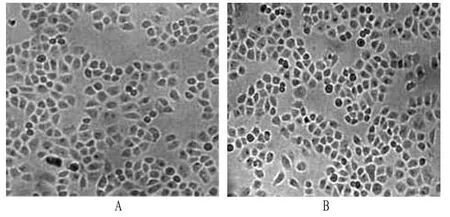
图1 倒置显微镜下细胞形态A.Hela细胞;B.SPC-A1细胞Fig1 Morphology of cells observed by inverted microscopeA.Hela cells;B.SPC-A1 cells
3.2 金龙胆草总皂苷对Hela和SPC-A1细胞的抑制作用
以10-3~10-7mol·L-1浓度金龙胆草总皂苷孵育细胞24、48、72 h后,测定金龙胆草总皂苷对Hela细胞和SPC-A1细胞的生长抑制作用。细胞抑制率与药物浓度及作用时间相关。随药物浓度增加,金龙胆草总皂苷对2种细胞的抑制率增高。随作用时间延长,金龙胆草总皂苷对细胞的抑制作用越发明显。48 h时,Hela细胞的IC50=1.25×10-5mol·L-1,SPC-A1细胞的IC50=1.03×10-5mol·L-1。金龙胆草总皂苷对Hela、SPC-A1细胞抑制作用的影响见表1、表2。
3.3 DNA凝胶电泳分析
表1 金龙胆草总皂苷对Hela细胞抑制作用的影响(±s)Tab1 Influence of total saponins from C.blinii on Hela cell(±s)
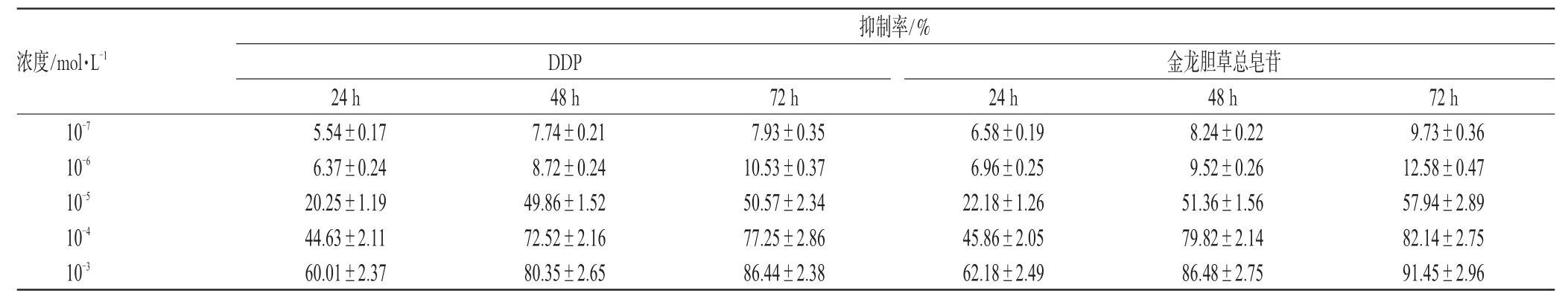
表1 金龙胆草总皂苷对Hela细胞抑制作用的影响(±s)Tab1 Influence of total saponins from C.blinii on Hela cell(±s)
抑制率/%浓度/mol·L-1DDP 金龙胆草总皂苷10-7 10-6 10-5 10-4 10-3 24 h 5.54±0.17 6.37±0.24 20.25±1.19 44.63±2.11 60.01±2.37 48 h 7.74±0.21 8.72±0.24 49.86±1.52 72.52±2.16 80.35±2.65 72 h 7.93±0.35 10.53±0.37 50.57±2.34 77.25±2.86 86.44±2.38 24 h 6.58±0.19 6.96±0.25 22.18±1.26 45.86±2.05 62.18±2.49 48 h 8.24±0.22 9.52±0.26 51.36±1.56 79.82±2.14 86.48±2.75 72 h 9.73±0.36 12.58±0.47 57.94±2.89 82.14±2.75 91.45±2.96
DNA凝胶电泳图谱呈现梯子状断裂现象是细胞凋亡的一个重要标志[6]。凋亡时限制性核酸内切酶被激活,将DNA切成50~300 kb的大分子量DNA,进一步分解成规则的180~200 bp DNA片段或它的倍数片段。结果显示,空白对照在琼脂糖凝胶电泳上显示相对分子质量很大的一条带,这是基因组DNA条带,说明没有发生凋亡,而金龙胆草总皂苷出现了凋亡的特征性DNA ladder,并且有模糊的连续条带出现,说明金龙胆草总皂苷除诱导细胞发生凋亡外,也导致少数细胞坏死。DNA琼脂糖凝胶电泳分析见图2。
表2 金龙胆草总皂苷对SPC-A1细胞抑制作用的影响(±s)Tab2 Influence of total saponins of C.blinii on SPC-A1cells(±s)
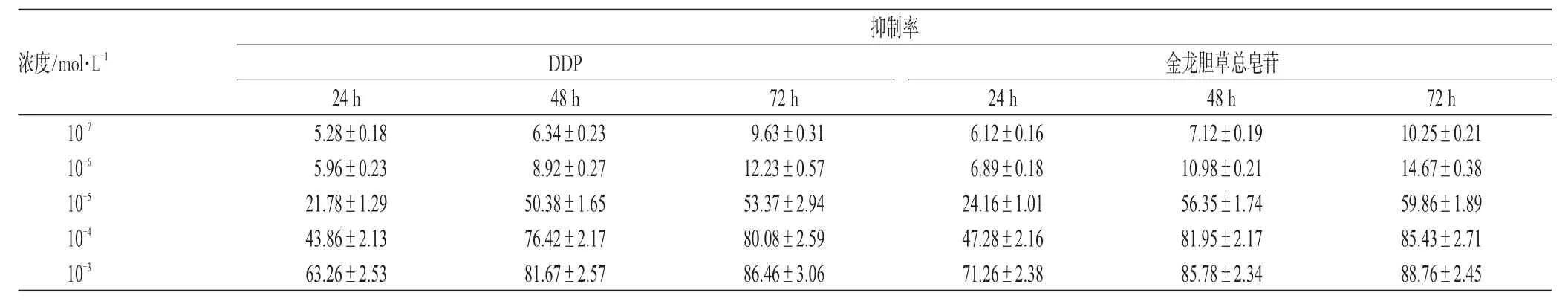
表2 金龙胆草总皂苷对SPC-A1细胞抑制作用的影响(±s)Tab2 Influence of total saponins of C.blinii on SPC-A1cells(±s)
抑制率浓度/mol·L-1DDP 金龙胆草总皂苷10-7 10-6 10-5 10-4 10-3 24 h 5.28±0.18 5.96±0.23 21.78±1.29 43.86±2.13 63.26±2.53 48 h 6.34±0.23 8.92±0.27 50.38±1.65 76.42±2.17 81.67±2.57 72 h 9.63±0.31 12.23±0.57 53.37±2.94 80.08±2.59 86.46±3.06 24 h 6.12±0.16 6.89±0.18 24.16±1.01 47.28±2.16 71.26±2.38 48 h 7.12±0.19 10.98±0.21 56.35±1.74 81.95±2.17 85.78±2.34 72 h 10.25±0.21 14.67±0.38 59.86±1.89 85.43±2.71 88.76±2.45
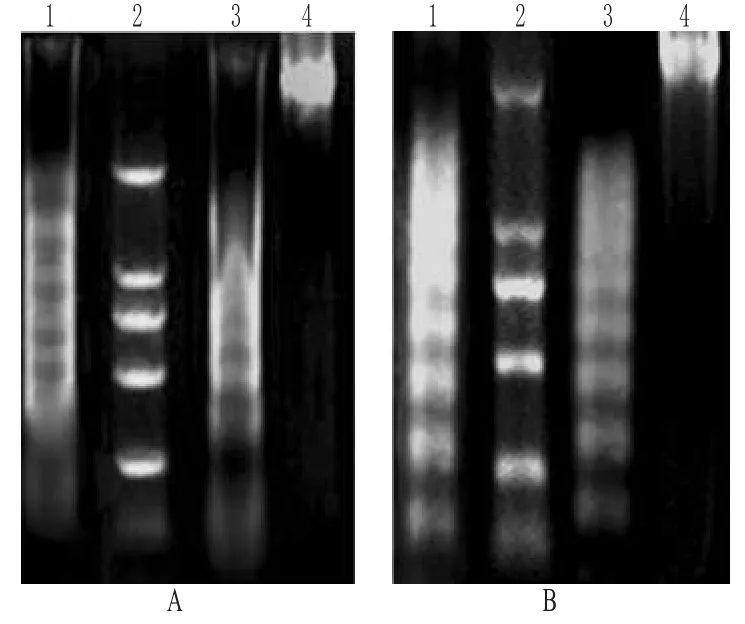
图2 DNA琼脂糖凝胶电泳分析A.Hela细胞;B.SPC-A1细胞;1.DDP;2.Marker;3.金龙胆草总皂苷;4.空白对照Fig2 Agarose gel electrophoresis analysis of DNAA.Hela cells;B.SPC-A1 cells;1.DDP;2.Marker;3.Total saponins of C.blinii;4.blank control
3.4 细胞内Caspase-3蛋白含量测定结果
药物作用前后Caspase-3的表达量有显著变化,Hela细胞和SPC-A1细胞Caspase-3的表达量均明显高于空白对照,进一步从蛋白水平上说明金龙胆草总皂苷能诱导细胞发生凋亡。Western blot检测金胆草总皂苷对Caspase-3表达量的影响见图3。
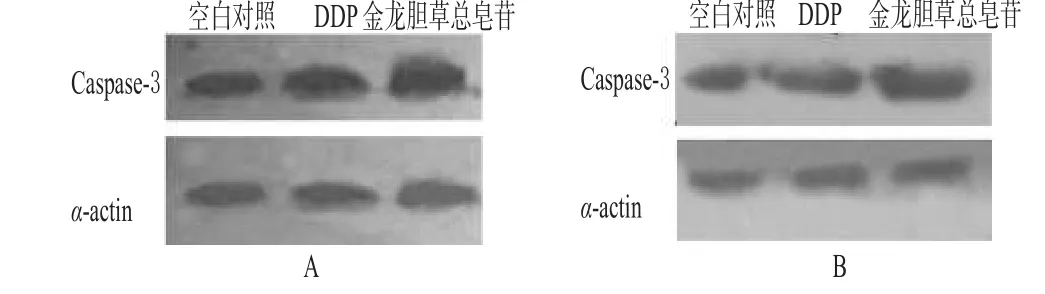
图3 Western blot检测金龙胆草总皂苷对Caspase-3表达量的影响A.Hela细胞;B.SPC-A1细胞Fig3 Effects of Total saponins of C.blinii on Caspase-3 deteced by Western blot assayA.Hela cells;B.SPC-A1 cells
4 讨论
金龙胆草系菊科白酒草属植物,全世界共有80余种,对其中约20种植物的化学研究表明,二萜类、黄酮类和多聚炔类化合物是白酒草属植物的特征成分。早在2000年,Su YF等[7]对金龙胆草黄酮类成分、萜类成分、皂苷类成分等进行了系统的研究。除黄酮类、二萜类化合物外,从白酒草属植物中获得的天然产物的新类型包括三萜皂苷、鞘脂化合物、γ-吡喃酮3种。近年来,对白酒草属植物化学成分的研究取得较大进展,但有关白酒草属植物化学成分生物活性的研究很少,仅有报道conyzasaponin D和conyzasaponin F对HL-60具有中等强度的细胞毒性[8],γ-吡喃酮类化合物具有抗真菌活性[9],黄酮luteolin、apigenin、takakin 8-O-glucuronide 对黄嘌呤氧化酶具有抑制活性等。因此,有必要系统研究白酒草属植物化学成分的生物活性,以期阐明其药用物质基础。
在肿瘤的分子生物学研究中,肿瘤的发生机制有很多,但细胞凋亡始终是学术界的研究热点。细胞凋亡又称程序性细胞死亡,凋亡是通过启动其自身遗传机制,内源性DNA内切酶的激活,而发生自动死亡的过程。各种组织的细胞凋亡都要激活Caspase家族,Caspase家族成员能迅速启动序列性酶解死亡程序并激活核酸内切酶[10]。在内源性核酸内切酶作用下,DNA进行有控降解。其中,Caspase-3是介导细胞凋亡的一类蛋白水解酶,即Caspase家族中的关键效应酶,是凋亡途径的最终执行者,可直接降解细胞内的结构蛋白和功能蛋白,引起细胞凋亡[11]。
本试验以宫颈癌Hela细胞和肺癌SPC-A1细胞为研究模型,选择临床常用的顺铂作为阳性对照,通过MTT试验、琼脂糖凝胶电泳和Western Blot试验,说明金龙胆草总皂苷可抑制癌细胞生长,并出现特征性DNA ladder,增加Caspase-3表达量,即依次从细胞水平、分子水平和蛋白水平表明金龙胆草总皂苷抑制Hela细胞和SPC-A1细胞的增殖活性是通过诱导细胞凋亡来实现的。但是,有关金龙胆草总皂苷诱导宫颈癌Hela细胞和肺癌SPC-A1细胞凋亡的具体机制尚需进一步探讨。
[1]苏艳芳,陈 磊,罗 洋.金龙胆草化学成分及其抗溃疡活性研究[J].中草药,2007,38(3):332.
[2]国家药典委员会编.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:45.
[3]苏艳芳,杨凤英,陈 磊,等.金龙胆草总皂苷的制备方法及其应用[P].中国专利:CN1957962,2007.
[4]周彦明.曲格列酮抑制肝癌细胞增殖及其作用机制的实验研究[D].上海:第二军医大学,2007.
[5]Marcel NA,Bijman Cristian A,Hermelink PA,et al.Interaction between celecoxib and docetaxel or cisplatin in human cell lines of ovarian cancer and colon cancer is independent of COX-2 expression levels[J].Biochem Pharmacol,2008,75(2):427.
[6]Azuma M,Tamatani T,Ashida Y.Cisplatin induces apoptosis in oral squamous carcinoma cells by the mitochondria-mediated but not the NF-κB suppressed pathway[J].Oral Oncology,2003,39(4):282.
[7]Su YF,Kazuo Koike,Tamotsu Nikaido,et al.Conyzasaponins I-Q,nine new triterpenoid saponins fromConyza blinii[J].Nat Prod,2003,66(12):1 593.
[8]Su YF,Koike K,Guo DA,et al.New apiose-containing triterpenoid saponins fromConyza blinii[J].Tetrahedron,2001,57:6 721.
[9]Ahmed AA,Mohamed AE,Tzakou O,et al.Three pyroneglucosidic derivatives fromConyza albida[J].Planta Med,2002,68(6):664.
[10]朱海升,刘鄂湖,鞠 娟,等.抗老年性痴呆的天然药物研究进展[J].中国药房,2007,18(3):223.
[11]杜春华,成 炜,胡晓玲,等.茶多酚对肺癌SPC-A1细胞增殖的影响[J].山东医药,2007,47(31):1.
