不同负荷运动对大鼠Th1/Th2平衡及脾淋巴细胞PKC活性的影响
2011-11-09苏利强张利明赵广高郑里翔
苏利强,张利明,张 玮,赵广高,郑里翔
(1.江西中医学院体育教学部,江西南昌 330004;2.四川省运动技术学院,四川成都 610043; 3.南昌大学教育学院,江西南昌 330031;4.江西中医学院基础医学院,江西南昌 330004)
不同负荷运动对大鼠Th1/Th2平衡及脾淋巴细胞PKC活性的影响
苏利强1,张利明2,张 玮1,赵广高3,郑里翔4
(1.江西中医学院体育教学部,江西南昌 330004;2.四川省运动技术学院,四川成都 610043; 3.南昌大学教育学院,江西南昌 330031;4.江西中医学院基础医学院,江西南昌 330004)
目的:探讨运动中淋巴细胞PKC活性对大鼠Th1/Th2平衡的影响。方法:随机将48只大鼠分成不同运动负荷组及对照组,完成相应负荷运动后采集外周血和脾脏,采用ELISA法测试血清IFN-γ、IL-4含量,分离并裂解脾脏淋巴细胞获得上清液,采用BCA法定蛋白浓度,通过ELISA分析P-PKC的含量。结果:一次中等负荷运动对Thl/Th2平衡影响不大,一次负重力竭运动后即刻会使IFN-γ和IL-4均下调,超负荷运动10天则使IFN-γ在8h的恢复期内得不到恢复,使Thl/Th2平衡向Th2方向漂移。脾脏淋巴细胞PKC的活性在一次中等负荷运动过程中、后变化不明显,一次负重力竭运动使其活性下降,8h后即可恢复,但经过10天的超负荷运动后恢复8h的PKC活性仍处于较低水平。结论:中等负荷运动对Thl/Th2平衡和PKC活性影响不大,10天超负荷运动可以使Thl/Th2平衡向Th2方向漂移,可能是脾淋巴细胞PKC活性下降所致。
运动负荷;干扰素γ;白细胞介素4;蛋白激酶C
运动与免疫机能的关系成为国内外众多学者关注的焦点,在研究的基础上相继提出“J形(J-shaped)理论”“开窗(open window)理论”,以及“神经-内分泌模型”、“免疫抑制因子调节学说”。然而,随着研究的不断深入,新的研究成果不断出现,其中对Th细胞(help T cell,Th)的研究成果令人瞩目。Th细胞在运动免疫应答中起重要的调节作用,根据其分泌的细胞因子不同,CD4+T细胞又分为Thl细胞和Th2细胞两大亚群,在不同的刺激下可以使CD4+T细胞向Thl细胞或Th2细胞分化,从而引发不同的免疫效应[1]。Th1细胞主要分泌IFN-γ和IL-2等,介导细胞免疫;Th2细胞分泌IL-4和IL-10等,介导体液免疫[2,3]。二者各自通过其细胞因子的旁分泌作用,表现出交互抑制现象[4],从而调节细胞免疫和体液免疫之间的平衡,维持免疫稳态。免疫稳态的实质是指免疫细胞的总数及其各亚群的数量百分比,尤其是Th1和Th2细胞之间以及细胞免疫和体液免疫之间的平衡[5]。在免疫应答和保持免疫系统内的自稳状态中,Th1、Th2细胞扮演了重要的角色,临床上许多疾病与免疫稳态失调、Th1/Th2细胞间的偏移有关[6]。据国内外文献报道,运动性免疫抑制的发生与大强度运动或超量运动以及运动后疲劳所致CD4+T细胞向Th2分化,Thl/Th2的失衡有关[7-9]。
目前上海体育学院陈佩杰教授对运动引起Thl/Th2平衡变化进行了深入的研究,从Thl、Th2分泌特异细胞因子的基因表达以及一些重要蛋白的表达入手分析运动对Thl/Th2平衡的影响。但细胞膜上的重要信号物质蛋白激酶C(PKC)对运动导致免疫失衡的作用研究较少,PKC信号途径是调节细胞功能的重要信号转导通路之一,在调节细胞的增殖、凋亡、分化或其他生物学效应中扮演着十分重要的角色,成为治疗许多相关疾病的靶点。在T细胞的活化过程中,PKC起着极其重要的作用,而不同负荷运动对机体产生刺激后PKC活性和T淋巴细胞活化、分化之间关系国内尚未见报道。笔者观察不同负荷运动对PKC活性和Thl、Th2特异细胞因子的影响,探讨不同负荷运动对免疫机能影响的机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂 大鼠IL-4酶联免疫分析试剂盒96T,大鼠IFN-γ酶联免疫分析试剂盒96T,磷酸化蛋白激酶C(PPKC),酶联免疫分析试剂盒96T,BCA法蛋白定量试剂盒,红细胞裂解液、细胞裂解液,PBS缓冲液等。
1.1.2 主要仪器 台式冷冻离心机,酶标仪(480nm波长),分光光度计(540~595nm波长),恒温培养箱,制冰机,电子天平,大鼠游泳池等。
1.1.3 实验对象 48只清洁级SD大鼠190~220g,7周龄,由江西中医学院动物实验中心提供,实验动物合格证号: JZDWNo:2010-0011。
1.2 实验方法
1.2.1 分组 随机将动物分成正常对照组(A组),反复力竭组(B组),一次力竭即刻组(C组),一次力竭恢复8h组(D组),一次中等强度运动即刻组(E组),一次中等强度运动恢复8h组(F组),每组8只。
1.2.2 运动模型建立 大鼠适应性饲养5天后,大鼠先进行3天适应性游泳训练,每天1次,每次15min,然后开始正式实验。各组游泳方案:B组第1、2天游泳时间为30min,第3~5天每天递增30min,并在游泳时负重体重的3%,第6~7天每天进行1次力竭性游泳(负重体重的3%),第8~9天每天进行2次力竭性游泳(负重体重的3%),次间间隔6小时,第10天进行3次力竭性游泳(负重体重的3%),次间间隔6小时,B组在完成运动后8h取材;C组和D组运动方式为一次力竭(负重体重3%),C组运动完成即刻取材,D组在运动完成后恢复8h后取材,力竭标准参照孙景毅[10]的研究模型结合本研究的需要改进为:大鼠游泳的协调动作消失,水淹没鼻尖,身体下沉,至再次浮出水面的时间超过10s,并连续3次者且放在平面无法完成翻正反射;游泳训练期间对大鼠运动能力及活动状态进行详细观察并记录;中等强度运动组采用无负重一次游泳30min,分别运动后即刻和恢复8h取材;游泳时水深为50cm,水温(28±1)℃。对照组大鼠相同条件常规饲养,不参加游泳训练。
1.2.3 样本收集 完成相应运动后在相应时间股动脉取血,无菌取脾脏。
1.2.4 样本处理 血清制备:外周血常温静置30min后,3 000r/min离心5min取上清,-20℃保存,用于细胞因子测定。脾淋巴细胞制备:大鼠颈椎脱臼处死,75%乙醇浸泡3min,取出大鼠置于无菌纸上,取出脾脏进行称重。取新鲜脾脏的四分之一左右,用镊子轻轻将脾撕碎,用注射器针芯轻轻研压脾脏,经200目筛网过滤,制成单细胞悬液,收集滤过物质,离心1 000r/min5min,去上清,再加三倍体积的红细胞裂解液进行涡旋混匀,离心1 000r/min5min,此过程反复操作3次,直至上清完全清亮透明,弃上清,保留沉淀,整个操作过程均在冰上完成,保持在4℃。
裂解淋巴细胞:将上面收集的沉淀(脾淋巴细胞)加相应比例的细胞裂解液,用枪吹打数下,使裂解液与细胞充分接触,将裂解后的样品4℃10 000r/min离心5min,取上清,-20℃保存,用于磷酸化蛋白激酶C(P-PKC)测定。
1.2.5 样品测试 对血清样品中IL-4、IFN-γ进行测试,采用ELISA在酶标仪上读出OD值,所有OD值减去除零孔值后再行计算。以标准品的OD值使用CurveExpert1.3软件绘制出标准曲线,计算样品含量。
脾脏淋巴细胞PKC活性测试:脾脏淋巴细胞裂解制备的上清液用BCA法对蛋白浓度进行测定,用ELISA法(方法同上)得出样品浓度,计算出单位蛋白浓度的P-PKC含量。1.2.6 数据处理 各指标采用SPSS 11.5统计软件进行统计学处理,各组进行t检验,P<0.05为差异性显著水平,P<0.01为非常显著性差异。
2 结果
2.1 运动力竭时间情况
B组在第7天负重力竭游泳时溺水死亡1只,其余均完成相应的负荷;大鼠在6~10天游泳的力竭时间情况见表1,8~10天的反复力竭游泳时间显示第二、第三次力竭时间较当天第一次力竭时间显著下降。
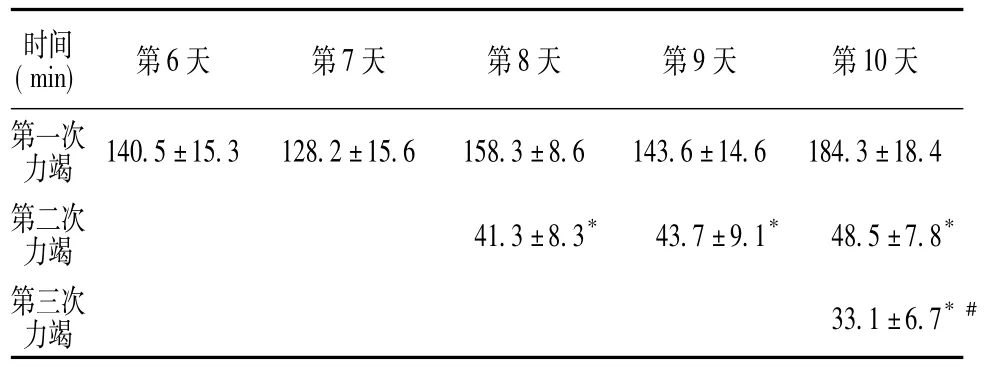
表1 B组第6~10天游泳力竭时间情况
2.2 运动对脾脏指数的影响
经过对脾脏指数的计算,结果显示C组较对照组脾脏指数显著下降(P<0.01),E组较对照组也有显著下降(P<0.05),在恢复8h后,只有B组仍然显著低于对照组,一次力竭、中等强度运动组则在恢复8h后基本恢复到对照组水平(P>0.05)。
2.3 运动对脾淋巴细胞PKC活性的影响
经过对脾脏淋巴细胞匀浆所得上清液进行PKC磷酸化的程度进行检测,结果显示C组淋巴细胞PKC磷酸化程度显著低于A组(P<0.05),E组和A组比较没有显著性差异(P>0.05),在恢复8h时后,只有B组仍未恢复到正常对照组水平(P<0.01)。
2.4 运动对IFN-γ的影响
采用ELISA方法对IFN-γ进行测试。结果显示:与A组比较,除D组外,其余均显著低于对照组;与B组比较,D组(P<0.05)、E组(P<0.05)、F组(P<0.01)均有显著升高;F组与D组比较则显著增加(P<0.05)。
2.5 运动对IL-4的影响
对大鼠外周血清中IL-4进行测定,结果显示C组、D组与A组、B组比较血清中IL-4含量明显减少(P<0.01),E组较C组有增加趋势(P<0.01),而F组则显著高于D组(P<0.01)。
2.6 运动对Thl/Th2平衡的影响
经过对外周血Thl、Th2分泌的特异细胞因子IFN-γ、IL-4进行比较来反映Thl/Th2平衡,结果显示与A组比较,B组显著低于A组(P<0.05),D组显著高于A组(P<0.05),C组、D组、F组均显著高于B组(P<0.01),E组则显著低于C组(P<0.01),F组显著低于D组(P<0.05)。

表6 各组相应指标变化情况表
3 讨论
3.1 运动模型建立
从淋巴再循环角度出发,由胸腺迁出的T细胞和骨髓迁出的B细胞通过血液循环分别到达脾、淋巴结和其他淋巴组织,定位在其中的一定部位。淋巴细胞定位在周围免疫器官后并非始终固定不动,而可从这里重新迁出转入血流。淋巴细胞通过淋巴结再循环的周期为24~48h,通过脾则较快,约为5~10h。参加再循环的淋巴细胞,绝大部分位于免疫器官内,约相当于血液内淋巴细胞数量的50倍。淋巴细胞再循环可显著提高免疫系统的效能。机体运动可使淋巴细胞再循环更快,本实验模型之一是递增运动至反复力竭运动10天,可以使淋巴细胞在机体内充分循环,将运动对免疫系统的影响充分表现出来。
从抗原对淋巴细胞基因的活化来看,抗原刺激T细胞后基因激活及mRNA功能,15min左右就可以使核转录因子结合到AP-1位点,并控制G0向G1转化,30min开始活化T细胞中的转录因子,数小时后一些IL-2、3、4、5、6、9、10、13,等细胞因子及其受体开始影响髓系及淋巴系细胞增殖和分化,GM-CSF、IFN-γ则控制介导炎症过程。在有病原生物或其他免疫原刺激时,T细胞活化后迅速克隆扩增,约在10天左右就可以克隆扩增1 000倍以上[11]。本研究通过对外周血IL-4和IFN-γ的检查发现10天超负荷游泳后恢复8h Th1/Th2处于失衡状态,显示反复力竭负荷可导致大鼠免疫失衡;一次力竭组和中等强度组运动模型采用控制运动负荷的方法建立,结合反复力竭组,构建不同的负荷对机体的免疫机能的影响。
3.2 不同负荷运动对IFN-γ、IL-4的影响
Th1细胞主要分泌IFN-γ等,能刺激介导细胞免疫、巨噬细胞活化、细胞毒性T细胞和迟发性超敏反应,并对胞内寄生菌的感染有清除作用,Th1细胞免疫应答能增强宿主对微生物感染,尤其是病毒与胞内病原体的免疫性和防御功能,Th1优势的反应利于机体清除感染原(包括胞内感染),但易引起宿主损伤;Th2细胞则刺激体液免疫,其分泌的IL-4能促进B细胞的增殖和诱导抗体的产生,Th2细胞免疫应答则与感染的进展、持续性和慢性化有关,对微生物感染有负调节作用,常引起疾病慢性化[12-13]。Th1和Th2细胞所诱导的免疫反应能互相调节或产生交叉调节作用,IL-4和IL-10下调Th1应答反应,而IFN-γ可抑制Th2细胞的增殖[14-15]。Th1、Th2平衡通常用其分泌的特异细胞因子IFN-γ、IL-4的比值来表示。
本研究结果显示,经过一次中等强度、一次负重力竭、反复力竭运动后都可以使IFN-γ表达下降,只有中等强度运动恢复8h后IFN-γ表达有所回升,显示中等强度运动对IFN-γ的影响是短暂的,而力竭运动,特别是反复力竭运动,超出了机体的承受范围,造成IFN-γ显著下降,推断超负荷或过量运动使细胞免疫功能受到抑制;这种过量运动导致的细胞免疫功能下降的原因有多种,从抗原提呈细胞(APC)处理成多肽到T淋巴细胞被激活后转化为淋巴母细胞,并迅速增殖、分化产生免疫应答,该过程的每一环节变化都可能引起细胞免疫功能的下降;另外运动导致内分泌激素的分泌,神经系统神经递质的作用也可以造成细胞免疫功能下降。
有实验将动物分为两组。60分种组每天进行一次无负重游泳60min,120min组每天进行一次无负重游泳120min,两组分别进行8周训练,结果与对照组比较,120min组血清IL-2含量显著下降,而60min组血清IL-2水平显著高于对照组[16]。说明适宜的运动可以使IL-2水平升高,IL-2也是Th1细胞的特异性细胞因子,因此可以推测适宜的运动可以使Th1/Th2向Th1偏移。Steensberg[5]报告,采用75% VO2max强度运动2.5h,结果血浆IFN-γ明显下降,而IL-4却升高,Lancaster[17]等也报道以65%VO2max进行自行车运动2.5h后IFN-γ明显减少,这一运动方式使Th1/Th2向Th2偏移,Th1相对受到抑制。因此,长时间、超负荷运动后机体的细胞免疫功能受抑制,体液免疫功能绝对或相对亢进[18]。
IL-4的变化则与IFN-γ不同,IL-4主要是由Th2细胞、肥大细胞和碱性粒细胞产生,中等负荷运动即刻、恢复8h、反复力竭运动后IL-4变化不大,只有一次力竭运动后即刻和恢复8h显著低于对照组,可能是由于中等强度运动时间较短,负荷小,产生的刺激对IL-4表达没有多大的影响,而经过一次负重力竭运动后Th2细胞暂时受到抑制,血液中的嗜碱性粒细胞数量和功能均下降,导致其分泌的IL-4减少,并且影响时间较长;10天反复力竭运动组在恢复8h后和对照组没有显著性差异,造成的原因可能是长期的负荷使机体不断产生抗原,产生慢性应答和适应性免疫应答,在此过程中发生持续性炎症和多种组织在运动适应过程中重建,这些因素会导致肥大细胞数量发生变化,从而分泌更多的IL-4;此外,长期超负荷运动导致Th0向Th2方向分化,使IL-4相对过多分泌。由此推断长期超负荷运动使机体处于持续、慢性清理抗原过程,这是可能使机体对外界的抗感染的能量下降,容易引起慢性疾病。
本研究结果显示中等强度运动对机体免疫平衡影响不大,在一次负重力竭游泳恢复8h后出现Th1/Th2平衡向Th1方向偏移,可能由于在一次运动后IL-4处于较低的水平的结果,反复力竭组的IL-4含量则显著低于正常组,说明该负荷使机体体液免疫处于相对优势的状况,免疫平衡处于向Th2方向漂移,这一结果与Steensberg[5]和Lancaster[17]的研究一致。推断,一次中等负荷运动对免疫平衡影响不大,而一次力竭运动即刻可以导致细胞免疫和体液免疫机能均下降,但免疫基本处于平衡状况,在恢复过程中细胞免疫功能相对恢复较快,但是长期超负荷运动后的8h左右机体的体液免疫机能则占优势,出现明显的Th2漂移状况。这种免疫平衡向Th2方向漂移的状况可能与机体易感程度增加有关[19,20]。
3.3 不同负荷运动PKC活性变化对Thl/Th2的失衡的影响及可能机制探讨
PKC是一种丝氨酸/苏氨酸激酶,作为细胞信号转导通路中的重要成员,参与受体的去敏感化、膜结构和细胞生长及转录的调节、免疫反应、脑的发生、突触的可塑性、学习和记忆等多种生理过程[21,22]。T淋巴细胞主要通过抗原受体介导途径及CD2或CD28旁路途径活化。经典的PI途径认为,当淋巴细胞接受到胞外信息的刺激后,激活膜中的磷酯酶C,诱发PI降解,生成IP3和DG,IP3可促进肌浆网释放Ca2+,使细胞内钙水平提高,DG与PKC结合,并在Ca2+作用下促发PKC从胞浆转位至胞膜而被激活。在磷酯酶D或磷酯酶A2作用下,磷脂酰胆碱(Pch)被降解并产生DG,在后期维持PKC的持续活化。CD2旁路亦可通过PI途径激活PKC来传递其信息。CD28旁路则主要依赖Pch途径生成DG,它还可通过增加PS的合成而提高PKC的活性,增强细胞对抗原的免疫反应[23]。由于PKC从胞浆转位至胞膜而被激活,激活时PKC随即发生磷酸化,反之,如果没有磷酸化的PKC则不具有活性,因此本研究采用细胞内磷酸化的PKC来反映PKC的活性。
本研究显示,当一次负重体重3%力竭运动恢复8h后,发现PKC活性恢复到和对照组相当水平,可能是由于一次力竭游泳的影响因素在一定的时间内可以恢复,而经过反复力竭运动后8h的PKC活性仍然低于对照组,说明10天的反复力竭运动造成了机体内环境的紊乱,如运动产生的抗原得不到及时的清理,细胞内Ca2+浓度下降,运动过量消耗ATP,导致磷酸的代谢失调,以及神经-内分泌系统紊乱等。从脾脏指数上也可反映出短期运动不会对脾脏指数产生影响,而10天的反复力竭运动可以导致脾脏指数在运动后8h仍未恢复,这也可能是PKC活性下降的原因之一。分析原因:由于运动也是一种应激[24],骨骼肌的微损伤、神经-内分泌的作用均会产生抗原,从而导致免疫应答。一次中等强度运动引起PKC发生磷酸化的因素还没有发生,所以经过半小时游泳后PKC活性没有发生变化;当采用一次负重体重3%力竭游泳后,造成PKC活性明显低于对照组,可能是游泳时间较长,负荷较大,导致骨骼肌蛋白变性、发生降解等,导致大量抗原的产生且不能及时清除,从而影响PKC的活性;另外,过量的游泳运动需要骨骼肌不断收缩才能完成,骨骼肌的过度收缩对Ca2+的依赖性非常大,而长时间的运动也会调动周围组织的Ca2+来维持骨骼肌的收缩,这样会造成淋巴细胞缺少充分的Ca2+来维持PKC从胞浆转位到胞膜而磷酸化,致使PKC活性下降。
研究发现PKC的活化和Th细胞的分化有一定的联系[25-27]。观察到反复力竭运动导致大鼠 Thl/Th2失衡,同时PKC活性显著下降,推测PKC活性变化与Thl/Th2失衡密切有关。分析其机理:PKC是一类非常重要的信号转导分子,可以激活许多细胞的功能,其基本过程为:激活剂→PKC→转录因子磷酸化→进入细胞核→基因表达控制→细胞增殖。PKC在T细胞的活化尤其是Th0的活化中具有重要作用,Th0的活化是由TCR介导的非受体型蛋白酪氨酸激(PTK)途径信号转导过程,TCR通过与其相连的CD3将Ag信号传入胞内,在TCR共同受体CD4/Lck协同作用下幕集、结合并激活ZAP-70分子,通过ZAP-70→Ras→MAPK和 Lck→PLC→Ca2+以及两者之间的交叉通路经LCK→PLCV→DAG→PKC→RasMAPK将活化信号传入核内。Th细胞在抗原刺激后在TCR共同受体CD4/Lck协同作用下幕集、结合并激活ZAP-70分子,引发PKC进一步活化NF-kB,并幕集GEF、RasGRP至胞浆膜,进一步活化 Ras[28-29],Ras经RaI、MAPK活化AP-1;NF-kB、AP-1活化后可结合IL-2、IL-4、IL-12等有关基因的调控区,促进相应的细胞因子及其受体转录,进一步介导Th0分别向Th1、Th2分化。并进一步分化为以表达IFN-γ为特征因子的Thl细胞介导细胞免疫和以表达IL-4为代表因子的Th2细胞介导体液免疫,对免疫平衡发挥关键性的调节作用。在本研究中反复力竭运动后发现Th0向Th2方向偏移,同时脾脏淋巴细胞PKC活性下降,而一次中等强度运动PKC活性没有显著变化,这是Th0分化处于平衡状态,因此推断Th0分化可能和PKC活性有一定的关联。
4 结论
1)一次中等负荷运动30min对Thl/Th2平衡影响不大,一次负重力竭运动后即刻会使IFN-γ和IL-4均下调,在恢复期内IFN-γ恢复较快,超负荷运动10天则使IFN-γ在8h的恢复期内得不到恢复,使Thl/Th2平衡出现向Th2方向漂移。
2)脾脏淋巴细胞PKC的活性在一次中等负荷运动过程中、后变化不明显,较大负荷的力竭运动使其活性下降,一次力竭恢复8h后即可恢复,但经过10天递增负荷至反复负重力竭运动后恢复8h后PKC活性仍处于较低水平。提示中等强度对其影响不大,一次超负荷运动可使其活性暂时下降,而反复超负荷运动则使PKC活性较长时间处于较低水平。
3)经过数据分析,推断超负荷运动导致Thl/Th2平衡向Th2方向漂移的细胞内信号机制可能与PKC活性降低有关。
[1]Zhang YL,Dong C.MAP Kinases in immune responses[J].Cell Mol Immunol,2005,2(1):20-27.
[2]唐恩洁.医学免疫学[M].成都:四川大学出版社,2004:190-191.
[3]W.E.保罗.基础免疫学[M].吴玉章等译.北京:科学出版社,2003:988-989.
[4]何 伟.医学免疫学[M].北京:科学出版社,2005:280.
[5]Adam Steensberg,Anders Dyhr Toft,Helle Bruunsgaard,et al.Strenuous exercise decreases the percentage of type 1 T cells in the circulation[J].J Appl Physio,2001,91:1708-1712.
[6]Matsuzaki J,Tsuji T,Imazeki,Ikeda H,Nishimura T.Immunosteroid as a regulator for Th1/Th2 balance:Its possible role in autoimmune diseases[J].Autoimmunity,2005,38(5):369-37.
[7]Hsu TG,Hsu KM,Kong CW,et al.Leukocytes mitochondria alterations after aerobic exercise in trained hunan subjects[J].Med Sci Sports Exe,2002,34(3):458.
[8]何 伟.运动应激对Th1和Th2偏移的影响及其与Cor、BLA和BUN的关系[J].体育学刊,2009,16(5):95-99.
[9]张宏杰,陈佩杰,段子才.大学生篮球运动员集训期间部分淋巴细胞亚群和Th1/Th2细胞因子mRNA表达变化分析[J].中国运动医学杂志,2006,25(4):393-396.
[10]孙景毅.过度训练大鼠肾组织IL-6、IL-18、凝血因子Ⅷ相关抗原的表达及山莨菪碱干预的影响[D].石家庄:河北医科大学,2008:11-17.
[11]陈慰峰.医学医学免疫学[M].北京:人民卫生出版社,2001: 153-155.
[12]刘加洪,王英年,赵云峰,等.Th1/Th2平衡失调与人类疾病关系及其相关治疗研究现状[J].青岛大学医学院学报,2002,38 (4):366-368.
[13]Dales R,Chen Y,Lin M,Karsh J.The association between allergy and diabetes in the Canadian population:implications for the Th1-Th2 hypothesis[J].Eur J Epidemiol,2005,20(8):713-717.
[14]顾国浩,彭群新.Th1/Th2细胞的免疫功能变化及其意义[J].国外医学临床生物化学与检验学分册,2003,24(6):333-334.
[15]谭锦泉,黄士昂,张秋萍.治疗免疫学[M].北京:科学出版社,2007:27-28.
[16]尹剑春.不同负荷运动训练对大鼠血清白细胞介素2皮质酮下丘脑和血清β内啡肽及血浆T淋巴细胞亚群的影响[J].中国康复医学杂志,2006,21(7):593-595.
[17]Lancaster G I,Halson S L,Khan Q,et al.Effects of acute exhaustive exercise and chronic exercise training on type 1 and type 2 T lymphocytes[J].Exerc Immunol Rev,2004,10:91-106.
[18]谢东北,郝选明.运动与免疫关系研究进展述评[J].体育学刊,2009,16(5):100-103.
[19]黄立新,杨 斌,何 敏.运动与Th1和Th2细胞平衡研究进展[J].中国运动医学杂志,2007,26(3):378-381.
[20]王 茹,陈佩杰.运动诱导的Th1/Th2淋巴细胞亚群失衡机制研究进展[J].上海体育学院学报,2009,28(1):112-117.
[21]曲彦明,李俊发,张晓东.蛋白激酶C适配器蛋白研究进展[J].医学研究通讯,2004,33(10):38-40.
[22]Koponen S,Kurkinen K,Akerman KE,et al.Prevention of NMDA-induced death of cortical neurons by inhibition of protein kinase Cζ[J].J Neu-rochem,2003,86(2):442-450.
[23]谭余庆,张永祥.蛋白激酶C和IKB/NFkB在免疫调节中的作用[J].免疫学杂志,2000,16(6):464-467.
[24]Smith L L.Overtraining,Excessive Exercise,and Altered Immunity: Is This a T Helper-1 Versus T Helper-2 Lymphocyte Response?[J].Sports Med,2003,33(5):347-364.
[25]郑爱华,李家邦,蔡光先,等.柴胡疏肝散、四君子汤对肝郁、脾虚病人Th细胞分化信号蛋白PKC表达的影响[J].贵阳中医学院学报,2003,25(4):14-17.
[26]张建军.阴黄证本质及温阳活血退黄方作用机制的研究[D].武汉:湖北中医学院,2003.
[27]何贤辉,曾耀英.棉酚对多克隆激活剂活化人T淋巴细胞的抑制作用[J].中国病理生理杂志,2002,18(5):522-525.
[28]Choi IS,Koh YI.Therapeutic effects of BCG vaccination in adult asthmatic patients:a randomized,controlled trial[J].Ann Allergy Asthma Immunol,2002,88(6):584-591.
[29]Carmelo Libetta,Teresa Rampino,Antonio Dal Canton.Polarization of T-helper lymphocytes toward the Th2 phenotype in uremic patients[J].Am J Kidney Dis,2001,38(2):286-295.
Effects of Different Load Exercises on Th1/Th2 Balances and Activity of PKC in Splenic Lymphocyte of Rats
SU Liqiang1,ZHANG Liming2,ZHANG Wei1,ZHAO Guanggao3,ZHENG Lixiang4
(1.Department of Physical Education,Jiangxi University of Traditional Chinese Medicine,Jiangxi 330004,Nanchang,China;2.Sichuan Sports Skill Institute,Sichuan 610043,Chengdu,China; 3.Physical Education Department of Nanchang University,Jiangxi 330031,Nanchang,China; 4.Basic Medical Science of Jiangxi University of Traditional Chinese Medicine School,Jiangxi 330004,Nanchang,China)
To explore the effect of different load exercises on Th1/Th2 balances and the activity of PKC in splenic lymphocyte of rats.48 rats were randomly separated into different load exercises group and control group respectively.The authors collected peripheral blood and Spleen after they finished load exercises accordingly,tested the contents of IFN-γ and IL-4 of serum by ELISA,split spleen and lymph to get clear supernatant liquid,tested the density of albumen using BCA and analyzed the contents of P-PKC through ELISA.Results show that one moderately load exercise doesn’t have great effect on Thl/Th2 balances,IFN-γ and IL-4 are down at the immediate postexercise after weight loading exercises,and IFN-γ can’t be recovered in 8h with overload for 10 days,which cause the drift from Thl/Th2 balances to Th2.It’s not obvious for the changes of the activity of PKC in splenic lymphocyte,while the activity is lower after a weight loading exhausting exercise and it can be recovered in 8h.However,the activity of PKC is at low level after 10 days overload exercises and recovery in 8h.The conclusion is that a moderately load exercise doesn’t have great effect on Thl/Th2 balance and the activity of PKC.However,overloading for 10 days makes it drift from Thl/Th2 balance to Th2,which may be caused by the much lower activity PKC in splenic lymphocyte.
exercise load;interferon gamma;interleukin 4;protien kinase C
G804.21
A
1004-0560(2011)05-0064-05
2010-11-17;
2011-02-05
江西省教育厅科学技术研究项目(项目编号为GJJ09284)。
苏利强(1979-),男,讲师,硕士,主要研究方向为运动生理生化。
张 玮(1972-),男,副教授,硕士,主要研究方向为运动医学,E-mail:s-2005100153@163.com;jxzw666@163.com。
责任编辑:乔艳春
◂运动人体科学
