微小毛霉凝乳酶基因在毕赤酵母中的诱导表达研究
2011-11-06王景会杨贞耐
郑 丽,王 昕,王景会,杨贞耐,,*
(1.吉林大学生物与农业工程学院,吉林长春130024; 2.吉林省农业科学院农产品加工研究中心,吉林长春130033)
微小毛霉凝乳酶基因在毕赤酵母中的诱导表达研究
郑 丽1,王 昕1,王景会2,杨贞耐1,2,*
(1.吉林大学生物与农业工程学院,吉林长春130024; 2.吉林省农业科学院农产品加工研究中心,吉林长春130033)
目的:研究重组毕赤酵母GS115PJ5诱导表达微小毛霉凝乳酶过程中酵母生长、产酶及培养液总蛋白变化情况。方法:测定毕赤酵母生长曲线、凝乳酶凝乳活性、蛋白水解活性、培养基上清液总蛋白含量。结果:毕赤酵母在开始诱导24h后即进入稳定生长期,并保持到240h,然后进入衰亡期。SDS-PAGE显示在分子量约为47000处有目的凝乳酶条带,凝乳酶在培养144h后开始大量积累,酶活性迅速提高,192h时凝乳活性达到最大值300SU/mL,蛋白水解活性为10.75U/mL,凝乳活性与蛋白水解活性的比值(C/P)达到最大值27.9,上清液总蛋白含量为0.189mg/mL。结论:微小毛霉凝乳酶基因在毕赤酵母中得到了有效的表达。
微小毛霉凝乳酶,巴斯德毕赤酵母,表达
1 材料与方法
1.1 材料与仪器
重组巴斯德毕赤酵母菌株GS115PJ5(基因组中整合有微小毛霉凝乳酶基因) 由本实验室构建获得;YPD BMGY BMMY培养基组成和配制 见Invitrogen公司毕赤酵母培养手册。
全自动凝胶成像系统 AlphaImager HP;蛋白电泳设备 Bio-rad Mini-Protean;台式离心机Eppendorf 5415D;紫外可见分光光度计 Varian Cary 300;高速冷冻离心机 Thermo Sorvall Evolution RC; -80℃超低温冰箱 Thermo Electron 705;显微镜图像处理系统 BX51+DP71;全温振荡培养箱 HZQ -X100;高压蒸汽灭菌器 MLS-3780。
1.2 实验方法
1.2.1 重组毕赤酵母诱导表达 将重组毕赤酵母GS115PJ5接种于 YPD固体培养基中,划线分离,30℃培养2d,挑取单菌落接种于装有50mLBMGY培养基并经过灭菌的500mL三角瓶中,30℃、260r/min培养24~32h,至OD600达到2.0~6.0。镜检确保菌株没有染菌。将培养基于4℃、6000r/min离心5min,弃去上清,收集菌体,悬浮于100mL BMMY培养基中,使其OD600值达到2.0左右。用双层封口膜封口,于30℃、260r/min的摇床上进行诱导表达。每24h向培养基中添加100%甲醇,至最终浓度为1%。每24h取样测定所产凝乳酶的凝乳活性、蛋白水解活性和总蛋白含量。并于培养结束后镜检确定诱导过程中没有染菌。
1.2.2 重组毕赤酵母生长曲线测定
1.2.2.1 总菌数 每24h取样检测菌液的OD600,直至培养结束。
1.2.2.2 活菌数 每24h取样,用0.9%生理盐水将菌液稀释至适当浓度,涂布于YPD固体平板,30℃培养48h,记录平板的菌落数。每个样品做3个平行,取平均值。
1.2.3 凝乳酶酶活测定 将重组酵母培养液10000r/min,离心1min,弃去菌体,测定上清液的各项指标。
凝乳酶酶活的测定采用改进的Arima K[9]方法: 0.01mol/L CaCl2溶液配制10%脱脂乳,吸取35℃下保温10min的脱脂乳溶液1mL加入试管,加入0.1mL凝乳酶上清液,迅速振荡摇匀,开始计时,当试管壁出现凝集小颗粒计时终止。凝乳活性定义:40min凝集1mL 10%脱脂乳的酶量定义为一个活力单位SU。
凝乳酶活力(SU)=(供试乳数量/凝乳酶量)× 2400/t×n
其中:n-稀释倍数:t-凝乳时间。
1.2.4 凝乳酶蛋白水解活力检测 凝乳酶蛋白水解活力检测采用中华人民共和国专业标准SB/T10317 -1999蛋白酶水解活力测定方法[10]:取试管,每管加入样品稀释液1mL,置于40℃水浴中预热2min,各加入经同样预热的酪蛋白1mL,精确保温10min,时间到后,立即各加入0.4mol/L三氯乙酸2mL,终止反应,继续置于水浴中保温20min,残余蛋白质沉淀离心后,取试管,每管内加入滤液1mL,再加0.4mol/L碳酸钠5mL,0.7mol/L的福林试剂1mL,摇匀,40℃保温发色20min后进行OD680测定。空白样品,测定同上,加酪蛋白之前先加0.4mol/L三氯乙酸2mL,使酶失活,再加入酪蛋白。
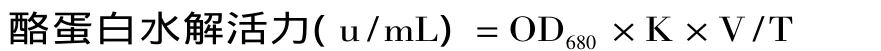
式中:OD680-680nm波长下,样品与空白实验的读数差;K-常数,由标准曲线得出,数值上等于OD680为1时相当的酪氨酸的微克数;V-反应液体积;T-反应时间(10min)。
1.2.5 重组毕赤酵母发酵液中总蛋白含量测定 总蛋白含量测定采用Bradford法[11]:标准曲线以牛血清蛋白为标准蛋白绘制。加入适当体积的样品,加入0.15mol/L NaCl溶液补足至0.1mL。各试管中加入5.0mL考马斯亮蓝G-250,每加完一管立即在漩涡振荡器上混匀。加完试剂2min后即可在OD595下比色。
2 结果与分析
2.1 重组蛋白的诱导表达
取发酵 72h和192h上清液加入 2×Loading Buffer蛋白上样液,95℃加热 5min后上样。SDSPAGE电泳结果如图1所示,从图中可以看出,在发酵72h的上清液中已有分子量约47000的重组蛋白条带,说明微小毛霉凝乳酶在重组菌中得到了表达。并且随着培养时间增加到192h时,目的蛋白酶的条带加重,说明目的蛋白的表达量在逐步增加。

图1 重组毕赤酵母GS115PJ5上清液SDS-PAGE检测注:M:蛋白marker;1:72h上清液;2:192h上清液。
2.2 重组毕赤酵母的生长曲线测定
实验结果如图2所示,在酶的诱导表达过程中,重组毕赤酵母生长状况良好。开始诱导表达时的OD600为1.93,经过24h的诱导达到菌体OD600为2.83,进入稳定生长期。至216h总菌数与活菌数均达到最大值,之后总菌数基本保持不变,而活菌数开始急剧减少,240h时活菌数为稳定生长期活菌数的50%,312h时活菌数仅为稳定生长期的25%左右。
2.3 重组毕赤酵母产凝乳酶的凝乳活性曲线测定
在凝乳酶诱导表达过程中凝乳活性变化情况如图3所示,诱导48h之后随着培养时间的增加,凝乳活性也快速提高。至192h达到最大值,然后活力逐步下降,可能由于菌体自溶或产生其他杂蛋白将凝乳酶水解所致。该结果与图2毕赤酵母在216h后开始进入衰亡期结果相一致。

图2 重组毕赤酵母GS115PJ5生长曲线
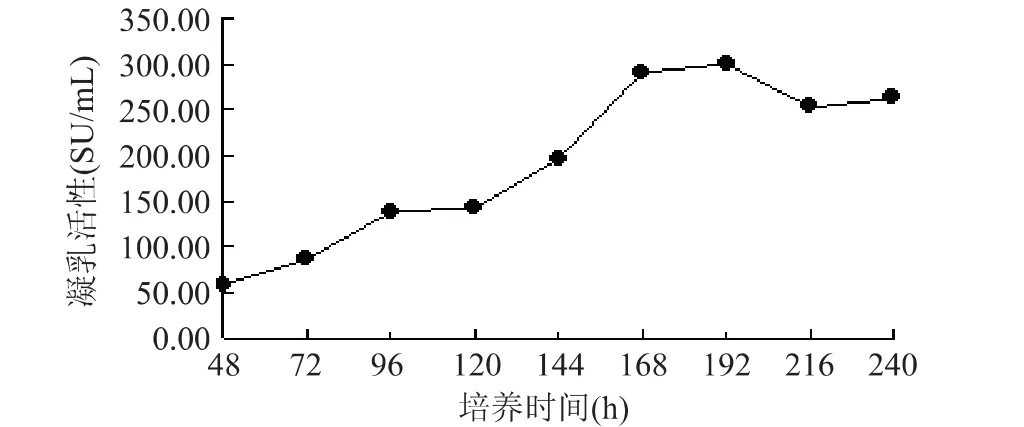
图3 重组毕赤酵母GS115PJ5产凝乳酶酶活曲线
2.4 重组毕赤酵母产凝乳酶的蛋白水解活性曲线测定
如图4(a)所示,随着培养时间的增加蛋白水解活性也逐步上升,但上升幅度较小,在192h之后蛋白水解活性开始明显上升,可能由于菌体进入衰亡期,各种杂质的产生对重组蛋白水解活性有较大的影响。图4(b)为蛋白水解活性测定用酪氨酸标准曲线:y=0.0101x+0.0070;相关系数R2=0.9995,K值为98.32。
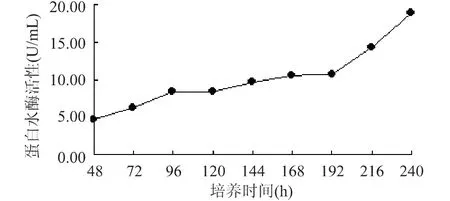
图4 (a) 重组毕赤酵母GS115PJ5产凝乳酶蛋白水解活性曲线

图4 (b) 酪氨酸标准曲线
2.5 重组毕赤酵母总蛋白含量测定
如图5(a)所示,培养液总蛋白含量在培养初期缓慢增长,经过168h培养后有明显上升趋势,但凝乳酶酶活并没有显著提高(图3),说明在诱导后期总蛋白含量的增加,并不能进一步增加凝乳酶活力,可能是菌体破裂后胞内蛋白溶出或是进入衰亡期的菌体产生的其他蛋白组分所致。图5(b)为总蛋白含量测定用标准曲线:y=0.0074x-0.0037,相关系数R2= 0.9999。
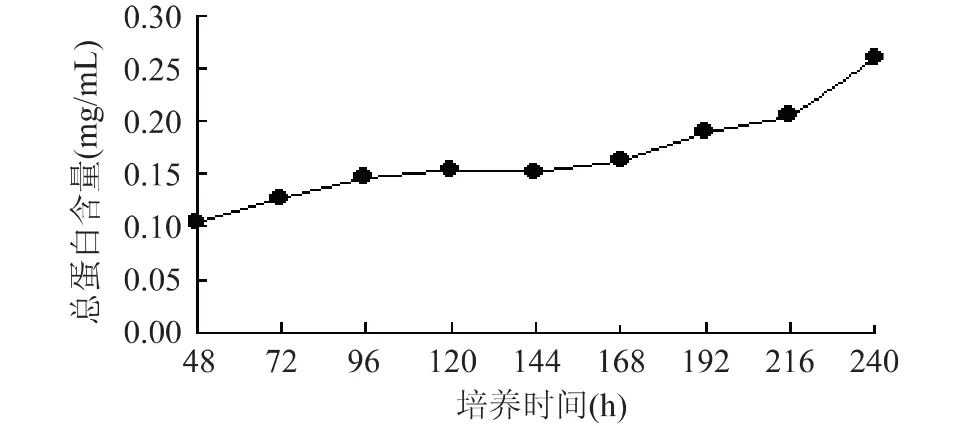
图5 (a) 重组毕赤酵母GS115PJ5上清液总蛋白含量测定曲线

图5 (b) 牛血清蛋白标准曲线
2.6 重组毕赤酵母产凝乳酶综合评价
通过上述对重组毕赤酵母在诱导表达过程中不同时间培养液的连续取样测定分析,表明重组酵母菌在诱导表达开始后48h即出现较高的酶活,随着培养时间的增加,总蛋白含量稳步增加,凝乳活性和水解活性也相应提高,培养144h后凝乳活性相对于水解活性和总蛋白含量增加幅度较大。如图6所示,凝乳活性和蛋白水解活性比值,即C/P在144h后上升幅度较大,在培养168h和192h时达到最大值约27,而192h凝乳活性达到最大值(图3),因此可以考虑在192h时结束诱导。

图6 重组毕赤酵母GS115PJ5产凝乳酶C/P值
3 讨论
本研究通过对重组毕赤酵母GS115PJ5诱导表达凝乳酶的分析表明,毕赤酵母培养24h后进入稳定期,216h后进入衰亡期,菌体数量急剧减少,细胞开始自溶。诱导192h后酶活可达300SU/mL,蛋白水解活性为10.75U/mL,总蛋白含量为0.189mg/mL,C/P达27.9,所产凝乳酶分子量约为47000。
重组毕赤酵母GS115PJ5表达的凝乳酶属于胞外分泌型,所表达的酶直接分泌到培养基中,可通过离心将菌体除去后获得粗酶液,不必经过细胞破壁等过程,大大地减少了提纯的工作量,减少了杂质对凝乳酶活性的影响。同时,毕赤酵母发酵产物的积累不会对自身产生毒副作用,通过大批量高密度培养可使酶的产量较摇瓶培养提高十几到几十倍,适于酶的工业化生产。
本研究通过毕赤酵母表达所得凝乳酶的产量较丘重晏[12]和本实验室采用9K载体在毕赤酵母中表达的酶量分别高50倍和15倍[13]。同时,本研究所获得的重组毕赤酵母GS115PJ5的生长曲线和酶活曲线与张莉[14]报道的产牛凝乳酶的重组毕赤酵母GS115相一致。通过SDS-PAGE电泳可知,本研究采用重组毕赤酵母GS115PJ5表达的产物中杂蛋白较少,与野生微小毛霉产生的凝乳酶相比,前者菌体产酶相对单一,为酶的提纯提供了便利条件。
[1]张国农.乳制品生产技术[M].北京:中国轻工业出版社,2002:388.
[2]闫美丽.干酪在中国的发展潜力[J].中国食品与营养,2005(3):19.
[3]董暮萤,任发政.世界干酪文化鉴赏[M].北京:化学工业出版社,2004:192-198.
[4]Ematage JS,Angal S,Doel MT,et al.Synthesis of calf Prochymosin(Pro-rennin)in Escherichia Coli[J].Biochemistry,1983,80:3671-3675.
[5]Goffer CG,Moir DT,Gravius TC,et al.Expression of Calf Prochymosin in Saccharomyces Cerevisae,Gene[J].1984,27(1): 35-46.
[6]Thames P.Biotechnological Innovation in Food Processing[M].England:Butterworth-Heineman Ltd,1991:113-145.
[7]于平.巴斯德毕赤酵母表达系统研究进展[J].工业微生物,2005,35(3):50-54.
[8]Cereghino JL,Cregg JM.Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J].FEMS Microbiology Reviews,2000,24(1):46-53.
[9]Arima K,Yu J,Iwasaki S,et al.Milk-clotting Enzyme from Microorganisms:V.Purification and Crystallization ofMucor Rennin from Mucor pusillus var.Lindt[J].Applied Microbiology,1968,16(11):1727-1733.
[10]SB/T 10317-1999.蛋白酶活力测定法[S].
[11]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:42-46.
[12]张丽红.微小毛霉凝乳酶及其重组酶的产酶条件和酶学特性的研究[D].吉林大学,2009:35.
[13]丘重晏,徐敏,王正祥.凝乳酶的基因克隆序列分析及初步表达[J].食品科学,2005(7):58-62.
[14]张莉,姜媛媛,张健,等.牛凝乳酶基因在毕赤酵母中的重组表达[J].食品生物技术,2009,25(8):1160-1165.
Study on induced expression of the rennin gene of Mucor pusillus by Pichia pastoris
ZHENG Li1,WANG Xin1,WANG Jing-hui2,YANG Zhen-nai1,2,*
(1.College of Biological and Agricultural Engineering,Jilin University,Changchun 130024,China; 2.Jilin Academy of Agricultural Sciences,Center of Agro-food Technology,Changchun 130033,China)
Objectives:To study the growth,enzyme-producing properties of the yeast and total protein of cultures during the induced expression of Mucor pusillus rennin in recombinant Pichia pastoris GS115PJ5.Method:Growth curve,milk-clotting activity,proteolytic activity,total protein content were determined.Results:The results showed that the yeast entered the stationary phase after incubation for 24h,and started to enter the decline phase after 240h.A strong band at about 47000 was shown by SDS-PAGE.Analysis of enzymatic activity showed that rennin accumulated rapidly after incubation for 144h and reached the maximum milk-clotting activity(300SU/mL)at 192h. Proteolytic activity,the ratio of milk-clotting activity and proteolytic activity(C/P)and total protein content were determined to be 10.75U/mL,27.9,0.189mg/mL,respectively.Conclusion:Mucor pusillus rennin was expressed effectively in Pichia pastoris.
Mucor pusillus rennin;Pichia pastoris;expression
Q786
A
1002-0306(2011)07-0178-04
干酪是牛乳经凝乳处理、排乳清和压榨等加工而成的产品,其中含有大量必需氨基酸、丰富的盐类、维生素A等营养成分。同时,食用干酪还具有缓解乳糖不耐症,平衡肠道菌群,护肝抗癌的功效[1]。随着经济和贸易的全球化,干酪生产被认为是当今我国乳品业发展新的增长点,其必将成为未来我国乳品工业的主要产品之一[2]。凝乳酶是干酪加工过程中的必需酶,主要作用包括两个方面:一是使牛乳凝结,二是在成熟过程中改善风味。传统的凝乳酶来源于小牛皱胃,由于全球性的小牛短缺使其来源变得不稳定。基因工程生产的重组凝乳酶已成为食品加工业中最先使用的重组酶产品之一。世界上已有美、英、意、德等19个国家能够生产基因工程凝乳酶[3]。目前我国干酪生产所用的凝乳酶以进口为主,成本较高,凝乳酶缺乏已成为制约我国乳品工业干酪生产的重要因素。据报道,凝乳酶基因已经在大肠杆菌[4]、酵母菌[5]、黑曲毛霉[6]等宿主菌中表达。巴斯德毕赤酵母表达系统是近几年来新兴的基因工程表达系统,因其具有高表达、高稳定、高分泌、容易放大、成本低等[7]多项优点,已被广泛用于表达多种蛋白[8]。另外,由于用于诱导的甲醇的易挥性使得其在酵母培养及制备凝乳酶制剂的过程中挥发殆尽,不会影响到该重组酶在干酪加工中的应用。本实验研究了微小毛霉凝乳酶基因在毕赤酵母中的诱导表达,对其生长和产酶特性进行研究,为基因工程凝乳酶的开发利用奠定基础。
2010-06-07 *通讯联系人
郑丽(1985-),女,硕士研究生,研究方向:食品生物技术。
国家高技术研究发展计划(863计划)(2006AA10Z306);农业部现代农业产业技术体系建设专项资金资助项目(nycytx -0502)。
