阿魏侧耳多糖酶水解制备工艺研究△
2011-11-03王莹李国玉黄健魏秀岩马跃平高建波王金辉
王莹,李国玉,黄健,魏秀岩,马跃平,高建波,王金辉,,3*
(1.石河子大学药学院,新疆 石河子 832002;2.沈阳药科大学中药学院,辽宁 沈阳 110016;3.教育部省部共建新疆特种植物药资源重点实验室,新疆 石河子 832002)
国家863项目(2008AA10Z323)
*王金辉,E-mail:tcm_shz@yahoo.cn
阿魏侧耳多糖酶水解制备工艺研究△
王莹1,李国玉1,黄健2,魏秀岩2,马跃平2,高建波1,王金辉1,2,3*
(1.石河子大学药学院,新疆 石河子832002;2.沈阳药科大学中药学院,辽宁 沈阳110016;3.教育部省部共建新疆特种植物药资源重点实验室,新疆 石河子832002)
目的采用蛋白酶水解法提取制备阿魏侧耳多糖。方法采用硫酸-苯酚显色测定多糖的含量,采用UV法测定蛋白质的含量。研究不同蛋白酶在不同条件下对阿魏侧耳多糖提取率和除蛋白效果的影响。结果最佳酶底比为8mg·g-1,温度60℃,最适pH值为6.0,最佳酶解时间为90min。结论采用蛋白酶水解法可以制得纯度很高的阿魏侧耳多糖。
蛋白酶水解法;阿魏侧耳多糖;提取制备工艺
阿魏侧耳PleurotusferulaeLanzi又名阿魏菇,是一种新疆特色的食、药两用大型真菌,因寄生或腐生在药用植物阿魏上而得名[1]。试验研究表明阿魏侧耳多糖(Pleurotusferulaepolysaccharide, PFP)对γ辐射产生的自由基所造成的鼠肝线粒体细胞膜伤害具有抗氧化抑制效果[2]。巨噬细胞吞噬作用试验、迟发型变态反应试验、白细胞介素-2(IL-2)的诱生与检测试验测得阿魏侧耳粗多糖具有免疫增强活性[3]。同时,还发现阿魏菇多糖具有明显的抗氧化[4]、延缓衰老[5]、抗肿瘤[6-11]、抑制核糖核酸酶[12]等作用。
阿魏侧耳多糖的提取方法研究,多简单采用热水浸提的方法[3,12-14]。笔者研究表明,阿魏侧耳多糖提取过程中,蛋白质类成分干扰很大,采用常规的离子交换色谱法、溶剂法(Sevage法)除蛋白的过程复杂,并且容易引进有机溶剂等杂质,严重影响阿魏侧耳多糖的质量。因此,本研究采用蛋白酶水解的方法,建立了阿魏侧耳多糖的高效的提取纯化方法。
1 仪器与试药
1.1仪器
SartoriusBP211D型电子分析天平(北京赛多利斯仪器系统有限公司),SK5200HP型超声波清洗机(上海科导超声有限公司),UV-2409型紫外分光光度计,DZKW型电热恒温水浴锅(北京市永光明医疗仪器厂),791型磁力加热搅拌器(南汇电讯器材厂),EYBLA旋转蒸发仪(上海爱朗仪器有限公司),SHZ-D9(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司),DzF型真空干燥箱(上海市精密实验设备有限公司)。
1.2试药
阿魏侧耳购于新疆石河子市,经石河子大学谭勇博士鉴定为阿魏侧耳PleurotusferulaeLanzi。标本号为No.20071002001,保存在石河子大学药学院。葡萄糖、苯酚、无水乙醇、浓硫酸等均为分析纯,水为二重蒸馏水。
2 方法与结果
2.1利用文献硫酸-苯酚法[12]测定多糖的含量
2.1.1 苯酚溶液制备 苯酚5g,用少量水溶解,转移至100mL容量瓶中,用水定容至刻度,配成苯酚溶液。
2.1.2 标准曲线的绘制 称取烘干至恒重的无水葡萄糖0.101 1g,溶于100mL蒸馏水中,配成1.011mg·mL-1的标准溶液。然后分别取标准溶液0.2,0.3,0.4,0.6,0.8mL置5只试管中,加蒸馏水至1.0mL,加入硫酸-苯酚显色液(加1mL苯酚溶液和5mL硫酸),沸水浴30min,放至室温,在490nm处,测其吸光度A。用同样处理的蒸馏水做空白对照,以吸光度A为纵坐标,糖浓度为横坐标绘制标准曲线,得回归方程Y=1.429 3X-0.044 5,r=0.999 8,表明多糖在0.028 89~0.115 5 mg·mL-1具有良好的线性关系。
2.1.3 测定法 样品加1 mL苯酚溶液和5 mL硫酸,沸水浴30 min,冷却至室温,490 nm处测吸光度A,利用标准曲线法,计算,即得。
2.2多糖提取条件正交试验优化
2.2.1因素水平设计 选取影响多糖提取的3个主要因素:温度(A)、时间(B)、料液比(C),采用L9(34)进行了正交试验,以多糖得率为指标,优选最佳工艺。为了提高统计分析的可靠性,每一条件下都作了重复试验(n=3),测定结果取其平均值。因素水平表见表1。

表1 阿魏侧耳多糖提取正交试验因素水平表
2.2.2 正交试验结果及分析 试验设计及结果见表2,方差分析结果见表3。

表2 阿魏侧耳多糖提取正交试验设计及结果

表3 方差分析表
表2直观分析可知,RC>RA>RB,即影响阿魏菇多糖提取率的诸因素的主次关系依次是料液比(C)>浸提温度(A)>浸提时间(B)。
表3方差分析表明,最佳工艺条件为A1B1C3。即浸提温度70 ℃,浸提时间2 h,料液比1∶40。
2.3阿魏侧耳多糖木瓜蛋白酶解纯化工艺的考察
2.3.1最适酶用量的确定 取7个具塞锥形瓶,每瓶加入阿魏侧耳提取液20mL(0.5568g·mL-1),分别加入木瓜蛋白酶(酶与底物质量比)0,2,4,6,8,10,12mg·g-1,用HCL调pH6,50℃水浴2h后沸水浴10min使酶灭活,冷却至室温,3000r·min-1离心5min,取上清液加95%乙醇至醇浓度80%,3000r·min-1离心10min取沉淀,同法洗涤沉淀3次,测多糖得率,结果见表4,确定最佳酶底比为8mg·g-1。
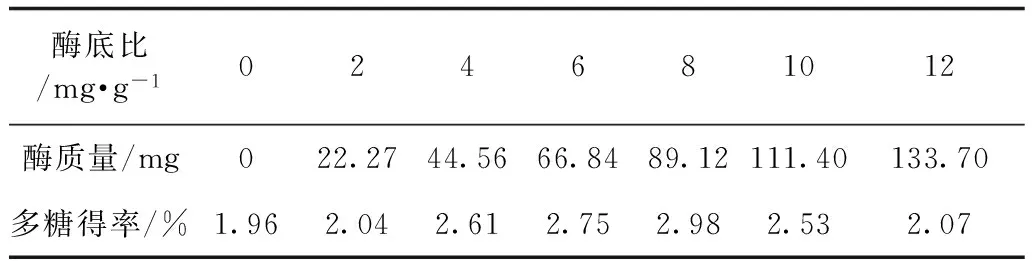
表4 最适酶用量考察结果
2.3.2 最适酶解时间的确定 取7个具塞锥形瓶,每瓶加入阿魏侧耳提取液20 mL(0.556 8 g·mL-1),分别加入木瓜蛋白酶89.12 mg用HCL调pH 6,分别50℃水浴0,30,60,90,120,150,180 min后沸水浴10 min使酶灭活,冷却至室温,3 000 r·min-1离心5 min,取上清液加95 %乙醇至醇浓度80 %,3 000 r·min-1离心10 min取沉淀,同法洗涤沉淀3次,测多糖得率,结果见表5,确定最佳酶解时间为90 min。
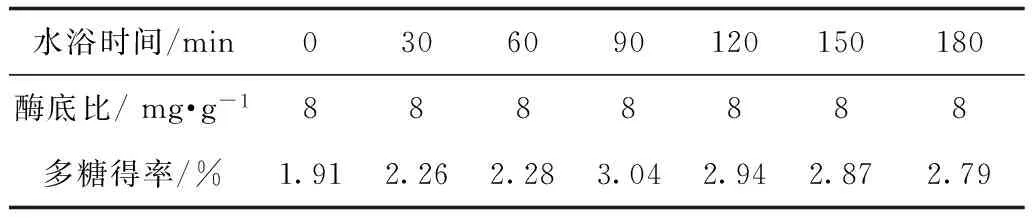
表5 最适酶解时间考察结果
2.3.3 最适pH值的确定 取3个具塞锥形瓶,每瓶加入阿魏侧耳提取液20 mL(0.556 8 g·mL-1),分别加入木瓜蛋白酶89.12 mg用HCL分别调pH为3、4、5、6、7、8、9,分别50 ℃水浴90 min后沸水浴10 min使酶灭活,冷却至室温,3 000 r·min-1离心5 min,取上清液加95 %乙醇至醇浓度80 %,3 000 r·min-1离心10 min取沉淀,同法洗涤沉淀3次,测多糖得率,结果见表6,确定最佳酶解pH值为6。

表6 最适酶解时间考察结果
2.3.4 最适酶解温度的确定 取7个具塞锥形瓶,每瓶加入阿魏侧耳提取液20 mL(0.556 8 g·mL-1),分别加入木瓜蛋白酶89.12 mg用HCL分别调pH为6,分别30,40,50,60,70,80,90 ℃水浴90 min后沸水浴10 min使酶灭活,冷却至室温,3 000 r·min-1离心5 min,取上清液加95 %乙醇至醇浓度80 %,3 000 r·min-1离心10 min取沉淀,同法洗涤沉淀3次,测多糖得率,结果见表7,确定最佳酶解温度为60 ℃。

表7 最适酶解温度考察结果
2.3.5 工艺验证 取3个具塞锥形瓶平行做3组,每瓶加入阿魏侧耳提取液20 mL(0.556 8g·mL-1),分别加入木瓜蛋白酶89.12 mg用HCL分别调pH为6,60 ℃水浴90 min后沸水浴10 min使酶灭活,冷却至室温,3 000 r·min-1离心5 min,取上清液加95 %乙醇至醇浓度80 %,3 000 r·min-1离心10 min取沉淀,同法洗涤沉淀3次,测多糖得率分别为3.11 %,3.15 %,3.09 %,RSD=0.8 %(n=3)。
3 讨论
影响阿魏侧耳多糖提取工艺的各因素重要程度依次为料液比、浸提温度、浸提时间,且料液比对阿魏侧耳多糖提取有显著性影响。正交分析得到的阿魏侧耳多糖提取工艺最佳参数为浸提温度70℃,浸提时间2h,料液比1∶40。

[1] 蒋秋燕,凌沛学,黄思玲,等.口服透明质酸在大鼠体内吸收机制的研究[J].中国药学杂志,2005,40(23):1811-1813.
[2] 田金强,朱克瑞.两种多糖对γ辐射诱导的鼠肝线粒体伤害的抑制[J].食品科学,2006,27(5):235-238.
[3] 甘勇,吕作舟.阿魏蘑多糖理化性质及免疫活性研究[J].菌物系统,2001,20(2):228-232.
[4] 郑琳,蒲训,毕玉蓉.白阿魏侧耳子实体抗氧化活性的研究[J].中国食用菌,2003,22(1):23-25.
[5] 田金强,朱克瑞,李新明,等.阿魏菇多糖的抗氧化功能及其对果蝇寿命的影响[J].食品科学,2006,27(4):223-226.
[6] 宋旭红,张月明,邓红.阿魏蘑菇提取物对肿瘤细胞p53表达的影响[J].中国公共卫生,2003,19(6):690-691.
[7] 宋旭红,张月明,王颖,等.新疆阿魏蘑菇提取物对不同肿瘤细胞p53,Fas基因表达的影响[J].疾病控制杂志,2003,(4):297-300.
[8] 宋旭红,张月明,丁红,等.新疆阿魏蘑菇提取物抗肿瘤作用及其有效成分分析[J].营养学报,2002,24(2):139-143.
[9] 宋旭红,张月明,邓红.新疆阿魏蘑菇提取物体外肿瘤实验研究[J].癌变·畸变·突变,2002,14(2):107-110.
[10] 宋旭红,张月明,刘金宝,等.新疆阿魏菇粗提物抗肿瘤效应研究[J].营养学报,2004,(2):127-130.
[11] 宋旭红,张月明,刘金宝,等.新疆阿魏菇提取物对4种肿瘤细胞p53表达的影响[J].新疆医科大学学报,2003,(2):98-102.
[12] 董洪新,吕作舟.阿魏侧耳酸提水溶性多糖的研究[J].微生物学报,2004,44(1):101-103.
[13] 董洪新,吕作舟.阿魏侧耳多糖的分离纯化与抗肿瘤活性的研究[J].微生物学通报,2003,30(2):16-19.
[14] 李永泉,吴炬,花立民,等.白阿魏菇菌丝体多糖分离纯化工艺的优化和结构分析[J].兰州大学学报(自然科学版),2003,39(4):50-54.
StudyonExtractionofPolysaccharideofPleurotusferulae
WANG Ying1,LI Guo-yu1,HUANG Jian2,WEI Xiu-yan2,MA Yue-ping2,GAO Jian-bo1,WANG Jin-hui1,2,3
(1.SchoolofPharmacy,ShiheziUniversity,Shihezi832002,China; 2.SchoolofTraditionalChineseMateriaMedica,ShenyangPharmaceuticalUniversity,Shenyang110016,China; 3.KeyLaboratoryofPhytomedicineResources&ModernizationofTCM,Shihezi832002,China)
Objective: Enzymatic hydrolysis processes of polysaccharides fromPleurotusferulaewere investigated.
: Enzymatic hydrolysis processes were developed by determination the concentration of the polysaccharides from by using UV spectrophotometry method. : The enzyme concentration ( mg·g),time ( ℃),pH .,and temperature ( min) of hydrolysis processes, was developed. : Enzymatic hydrolysis is powerful for extracting the polysaccharide from .
Enzymatic hydrolysis; polysaccharide; Extraction processes
--)
