多西他赛脂质体制备工艺研究
2011-11-01池王胄
池王胄
(上海新先锋药业有限公司,上海 201203)
多西他赛脂质体制备工艺研究
池王胄
(上海新先锋药业有限公司,上海 201203)
现阶段,研究抗肿瘤药物脂质体制剂项目是国内外新型给药系统的一大热点,本文研究一种具备较好稳定性的多西他赛脂质体的制备方法,并考察其理化性质及体外释放特性。
多西他赛;脂质体;制备工艺
1 材料与仪器
1.1 药品试剂
试验用药品及试剂包括:含量为99.48%的多西他赛;PC含量为97.5%z的注射用蛋黄卵磷脂;德国LipoidGmbH公司生产的二硬脂酰磷脂酰乙醇胺-PEG 2000;规格为20mg/0.5mL的多西他赛注射液;美国天地公司生产的乙腈;美国Gibco公司所生产的RPMI1640;小牛血清;美国Sigma公司生产的噻唑蓝;其余试剂为市场销售分析纯。
1.2 仪器
试验用仪器包括:美国沃特斯公司所生产的沃特斯高效液相色谱仪;英国马尔文仪器有限分司所产的Nano ZS 90纳米激光粒度电位测定仪;瑞士布琦公司所产的旋转蒸发仪;意大利GEA Niro Soavi公司所生产的高压均质机;上海东富龙所产的Lyo0.4真空冷冻干燥机;上海和杰科技公司所产的Biomax-10超滤膜Millipore超滤管;上海绿鸟科技公司所产的透析袋,截留相对分子质量为14 000;以及JEM-1010透射电子显微镜和ZRS-8G智能溶出仪。
2 试验方法
2.1 建立多西他赛含量的测定方法
本文利用HPLC法测量多西他赛和脂质体中多西他赛的含量,脂质体冻干粉针再添加蒸馏水进行重建为脂质体胶体溶液,再将其精密移取适量,用甲醇破乳、定容。色谱的条件为:色谱柱250mm×4.6mm,5μm,为LichrospherC18;流动相为60∶40的乙腈-水,流速1mL/min;柱温30℃;进样量20μL;检测波长229nm。经方法学考察证明:处于本色谱条件下,多西他赛的测定不会受到辅料的干扰;多西他赛峰面积和药物质量浓度的回归方程如下所示:

式中:A:多西他赛峰面积;c:药物质量浓度
线性范围:0.025~5μg/mL
2.2 制备注射用西他赛脂质体
先把2g多西他赛和30g注射用蛋黄卵磷脂,还有2.4g DSPE-PEG 2000共同放入茄形瓶,然后将乙醇添加进去充分溶解脂质。接着将茄形瓶放在旋转蒸发仪上,温度调至40℃,使溶剂减压蒸发,从而类脂溶液就结成一层非常均匀的薄膜状。把茄形瓶由蒸发仪中取下后置于干燥箱中,干燥箱为真空,过夜除尽溶剂。再取用pH值为5.5、10mmol/L的磷酸盐缓冲液(该缓冲液中溶有9%的蔗糖)以及直径3mm左右的玻璃珠适量,在氮气的保护作用下旋转洗膜,水化液转至高压均质机中,以100MPa压力进行5次均质,获取半透明的脂质体胶体深液,过滤膜后将滤液分装于西林瓶。然后进行冻干,冻干条件如下:-45℃的预冻温度,再进行4h保温;第1次干燥温度为-30℃,进行30h的保温;第二次的干燥温度为25℃,再进行10h保温,即可获取注射用多西他赛脂质体,置于4℃环境保存以备后用。
2.3 外观性状
注射用多西他赛脂质体外观为白色完整块状,色泽均一且外形饱满。取用一瓶多西他赛冻干脂质体,加入5mL水后室温环境摇匀,即可获得半透明的蓝色乳光状胶体。
2.4 测定多西他赛脂质体的载药量及包封率
因为多西他赛的溶水性较差,因此将其进行水合重建时,在未经包封的情况下,多西他赛呈药物晶体的形式析出,将物晶体进行过滤去除,水中所残留的即为包裹多西他赛脂质体及未少量未包裹的游离药物。取用一瓶冻干脂质体,将5mL水加入其中进行水合重建,再用5%的葡萄糖进行稀释,直至浓度为0.5mg/mL,即临床给药浓度,过滤后取用续滤液4mL,放入超滤管后进行超滤处理,设定转速3000r/min,离心转20min,将下清液收集起来直接HPLC进样。同时要取利用过滤膜过滤前的脂体混悬液2mL以及滤液2mL,将二者分别放在规格为10mL的量瓶中,利用甲醇定容,通过超声促使其完全挥发,再分取20μL进样,其浓度计算方法为将所得峰面积代入标准曲线,则包封率可表达为下式:

式中:A:过滤膜前脂体混悬液;B:滤液;C:下清液
2.5 体外释放度对释放行为的影响
透析袋经过预处理后,置于释放介质中过夜浸泡。将冻干脂质体蒸馏水复溶后,采用5%的葡萄糖稀释,直至DTX质量浓度达0.5mg/mL。将1mL置于透析袋中,扎紧两端,后绑在溶出仪小浆上,置于小杯,该小杯内盛放100mL的1mol/L水杨酸钠-pH 7.4 PBS,然后做体外释放实验,实验介质温度为(37±0.5)℃,转速100r/min。根据设定好的时间间隔取5mL释放介质进行浓度的测定,并补充释放介质5mL,HPLC测定DTX在释放介质中的深度,并算出药物累积释放百分比。
3 试验结果[1-4]
3.1 测定多西他赛脂质体包封率和载药量
经测定,多西他赛冻干脂质体重建后其包封率为99.89%,误差为±0.06;总脂质按照投药量来计算,其载药量为5.7%,误差为±0.01。
3.2 考察脂质体形态
通过透射电镜对重建后的脂质体进行观察,观察结果显示其大小与粒径测定仪的检测结果接近,并且多数粒子圆整结构为球形、近球性,并且可以看到非常清晰的、类似指纹环状的螺旋结构。
3.3 多西他赛脂质体体外释放度
在未加入血浆时,注射液与脂质体的体外释放行为相接近,在8h以内,释放时间越长释放量会随之增加,拟合释放度数据,与Higuchi方程相符,释放方程为别表达如下,其中脂质体释放方程式为:

注射液释放方程式为:

而在8h以后,无论是脂质体还是注射液,释放均达到一定的平台期,时间变化对释放量的影响不再明显。脂质体与注射液在加入血浆后,其释放量均有明显降低,在8h以内二者的释放行为差异显著,脂质体1h内的释放为0,而注射液在0.5h内释放为0。拟合释放数据,与Higuchi方程相符,其方程表达式分别如下,其中脂质体:

注射液:
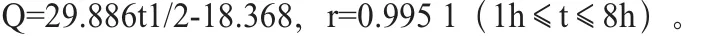
在8~24h以内,二者的释放行为差异不明显。
[1] 陆彬.药物新剂型与新技术[M].北京:人民卫生出版社,2005.
[2] 林巧平,郭仁平,王青松,等.注射多西他赛脂质体的制备、体外释放及细胞毒作用[J].中国药科大学学报,2008,39(5):39-43.
[3] 程小蓉.欧盟和美国批准多西他赛增加治疗头颈肿瘤的适应证[J].中国医药导刊,2006,8(6):52.
[4] 徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,2005.
R979.1
B
1671-8194(2011)23-0232-02
