荔枝与荔枝酒褐变控制
2011-10-28冯卫华林丽棉
冯卫华,林丽棉,秦 艳
(仲恺农业工程学院轻工食品学院,广东 广州 510225)
荔枝与荔枝酒褐变控制
冯卫华,林丽棉,秦 艳
(仲恺农业工程学院轻工食品学院,广东 广州 510225)
以荔枝及荔枝酒为试料,研究荔枝多酚氧化酶(PPO)的酶学特性及荔枝酒发酵过程中的褐变机理及控制措施。结果表明:荔枝PPO存在同功酶,荔枝PPO最适底物为没食子酸;以没食子酸为底物,荔枝PPO最适反应pH值为8.0,最适反应温度50℃,荔枝PPO的动力学参数为:米氏参数(Km)为26.033mmol/L,最大反应速度(Vmax)为34.816g/(L·min);荔枝PPO对酸碱、对热稳定性较差;荔枝酒发酵过程中褐变的主要原因是其PPO引起的酶促褐变。因此,低温贮藏和高温热处理可有效抑制荔枝及荔枝酒在贮藏和加工中酶促褐变反应。
荔枝;荔枝酒;多酚氧化酶;酶促褐变
荔枝(Litchi chinensis Liquor)为我国亚热带特有水果,营养价值高,风味独特,素有“果中之王”之美称。每100g荔枝果肉中含有水分84g、含碳水化合物14g(热量64千卡)、VC 36mg、蛋白质0.7g、脂肪0.6g、磷32mg、钙6mg、铁0.5mg、硫胺素0.02mg、核黄素0.04mg和尼克酸0.4mg[1-2]。由于荔枝采后极易褐变腐烂,所以荔枝的深加工迫在眉睫。目前荔枝的深加工产品主要有荔枝干、荔枝罐头、荔枝果冻、荔枝浓缩汁和荔枝酒。其中,酿酒提高了荔枝的商品价值,对荔枝产业的持续发展有重要的意义[3]。
近几年各企业纷纷推出100%荔枝汁发酵酒,其口感和工艺上都有较大的突破,但是由于技术储备不够完善,经验积累不够成熟,产品在装瓶后或货架期时仍然存在氧化褐变、失光等问题[3]。
褐变是果蔬在贮藏、加工期间的一个突出问题,给生产造成较大损失,国内外就这一问题成立了专门的研究机构,关于这方面的报道也很多。果蔬贮藏加工期间褐变的原因,很多研究认为主要是酶促褐变,即果蔬中的酚类物质在多酚氧化酶(polyphenol oxidase,E.C. 1. 14. 18. 1,PPO)的作用下被氧化的结果[4-6]。因此,酶促褐变的控制已成为食品工业研究的焦点[7-8]。据报道,荔枝与荔枝壳褐变其主要原因是多酚氧化酶引起的酶促褐变[9-10],然而荔枝及其加工过程中褐变与荔枝多酚氧化酶引起的酶促褐变的相关性研究尚未报道,因而不能断定荔枝酒加工中褐变的主要原因。本研究通过测定荔枝与荔枝酒的褐变程度及其多酚氧化酶的活性大小,考察了二者的相关性,从而确定荔枝酒褐变的主要原因;考察荔枝与荔枝酒中多酚氧化酶的最适底物、最适pH值、最适温度以及荔枝多酚氧化酶的动力学参数、酸碱稳定性、热稳定性及热稳定参数,为防治荔枝及荔枝酒贮藏与加工过程中的酶褐变提供一定参考。
1 材料与方法
1.1 材料与试剂
本实验所采用的荔枝与荔枝酒均由广州市从化顺昌源绿色食品有限公司提供。其中荔枝酒为分别发酵4、8、12、15d的样品,样品密封后于-25℃下保存备用。新鲜的荔枝用不锈钢刀迅速将其果皮、果肉和果心分离,迅速装入保鲜袋中密封于-25℃下冷冻,再用不锈钢刀将冷冻的荔枝果肉剁碎混均,迅速装入保鲜袋中密封,于-25℃下保存备用。
没食子酸、福林试剂、2,2’-d i p h e n y l-1-picrylhydrazyl(DPPH)、2,4,6-tris-2,4,6-tripyridyl-2-triazine(TPTZ)等 美国 Sigma公司。
1.2 仪器与设备
UV 762紫外/可见分光光度计 上海精密科学仪器有限公司;TGL-16G-A冷冻离心机 上海安亭科学仪器厂。
1.3 荔枝果肉PPO的提取及最适底物的测定
1.3.1 荔枝果肉PPO的提取
称取2.0g荔枝果肉,加入2mL 100mmol/L磷酸缓冲液(pH6.8),冰浴研磨匀浆,然后于10000×g离心15min,收集上清液作为荔枝果肉PPO粗酶液,用于荔枝果肉PPO活性测定。
1.3.2 荔枝果肉PPO最适底物的测定
在4.0mL反应体系中,加入2.3mL 100mmol/L磷酸缓冲液(pH6.8)和0.2mL酶液、然后分别加入1.5mL 40mmol/L 邻苯二酚、对苯二酚、间苯二酚和没食子酸溶液(100mmol/L pH6.8的磷酸缓冲液溶解),分别混匀后在室温下420nm处测定其吸光度,从0min开始记录每分钟反应体系的吸光度,连续测定10min。空白为不加酶液的反应体系。在测定条件下,以每分钟吸光度改变0.001为一个酶活力单位(U),酶活性表示为U/g 。
1.3.3 反应温度对荔枝果肉PPO活性的影响
在4.0mL反应体系中,加入2.3mL 100mmol/L磷酸缓冲液(pH6.8)、1.5mL 40mmol/L没食子酸溶液(100mmol/L pH6.8磷酸缓冲液溶解)和0.2mL酶液,混匀后,分别于20、25、30、35、40、45、50、55、60℃和65℃下反应,记录每分钟反应体系在420nm吸光度,连续测定10min,空白为不加酶液的反应体系。PPO活性以其最高酶活性相对值表示,最高相对酶活性定为100%。
1.3.4 反应pH值对荔枝果肉PPO活性的影响
首先配制100mmol/L醋酸缓冲液pH5.0及100mmol/L磷酸缓冲液(pH6.0、6.8、8.0和8.5),并配制40mmol/L没食子酸溶液(分别用不同pH值的醋酸缓冲液或磷酸缓冲液溶解)。在4.0mL反应体系中,加入2.3mL 100mmol/L的不同pH值的缓冲液、1.5mL 40mmol/L最适底物溶液和0.2mL酶液,混匀后于50℃温度下反应,酶液加入后开始计时,记录每分钟反应体系在420nm的吸光度,连续测定10min。空白为不加酶液的反应体系。PPO活性以其最高酶活性相对值表示,最高酶活性定为100%。
1.3.5 荔枝果肉PPO酶促动力学参数Km与Vmax
用100mmol/L pH8.0的磷酸缓冲液分别配制浓度30、50、70、90mmol/L没食子酸溶液。在4.0mL反应体系中,加入2.3mL 100mmol/L磷酸缓冲液(pH8.0)、1.5mL不同浓度的没食子酸溶液和0.2mL酶液,混匀后于50℃温度下反应,测定PPO的活性。空白为不加酶液的反应体系。求得荔枝果肉PPO的Vmax和Km值。
1.3.6 荔枝果肉PPO的热稳定性及热失活参数
PPO热稳定性:将PPO酶液分别在40、50、60、70℃和80℃水浴中保温15、30、45min和60min,迅速冰浴冷却,然后于10000×g离心5min,收集上清液,按照酶活性测定体系测定PPO活性。PPO活性分别以其未加热的酶活性相对值表示,未加热的酶相对酶活定为100%。
PPO热失活参数的计算按照Galani等的方法[11]。
1.3.7 pH值对PPO活性的影响
首先配制100mmol/L醋酸缓冲液(pH4.0~5.0)及100mmol/L磷酸缓冲液(pH6.0~9.0),将荔枝肉按1:1的比例分别用不同pH值的缓冲液研磨提取,于10000×g离心15min,再放入4℃左右的冰箱中保持30min,最后再离心5min,并配制40mmol/L 没食子酸溶液(分别用不同pH值的醋酸缓冲液和磷酸缓冲液溶解)。在4.0mL反应体系中,加入2.3mL 100mmol/L的不同pH值的缓冲液、1.5mL 40mmol/L 没食子酸溶液和0.2mL酶液,混匀后于50℃温度下反应,酶液加入后开始计时,记录每分钟反应体系在420nm的吸光度,连续测定10min。空白为不加酶液的反应体系。PPO活性分别以其最高酶活性相对值表示,最高酶相对酶活定为100%。
1.3.8 荔枝酒PPO活性变化
在4.0mL反应体系中,分别加入0.2mL不同发酵天数的荔枝酒,然后加入2.3mL 100mmol/L磷酸缓冲液(pH8.0)和1.5mL 40mmol/L没食子酸溶液(100mmol/L pH8.0的磷酸缓冲液溶解),混匀后于50℃条件反应,酶液加入后开始计时,记录每分钟反应体系在420nm的吸光度,连续测定10min。空白为不加荔枝酒的反应体系。荔枝酒PPO活性以其最高酶活性相对值表示,最高相对酶活定为100%。
1.3.9 荔枝酒色泽的测定
分别取不同发酵天数的荔枝酒,用蒸馏水作空白液,在420nm波长下分别测定荔枝酒吸光度。
1.4 数据统计与分析
每个提取试验均重复3次,每个测定均重复3次。结果表示为平均值±标准偏差。应用SPSS 11.5软件的One-Way ANOVA对所有数据进行方差分析,利用邓肯式多重比较对差异显著性进行分析;应用Pearson correlation test进行变量之间的相关性分析。P<0.05,表示差异显著;P<0.01,表示差异极显著。
2 结果与分析
2.1 荔枝果肉PPO最适底物的测定
2016年至今,王世君担任鸡东县农村公路县乡路网改造工程建设指挥部总工程师,负责农村公路工程建设及质量管理工作。农村公路施工队伍情况复杂,管理难度大,为了保证工程质量,他从招标履约开始,对进场人员从严管理,对进场材料严格把关,对施工步骤认真监控,对工程质量做到达不到标准不验收、不允许进入下道工序,在同事的支持下,克服重重困难,完美地完成了各项工作。

图1 荔枝果肉PPO底物特异性Fig.1 Substrate specificity of PPO from litchi
底物不同,荔枝果肉PPO活性有很大区别。图1结果显示,采用没食子酸为底物,荔枝果肉PPO活性极显著高于邻苯二酚、间苯二酚和对苯二酚(P<0.01)。因此,荔枝果肉PPO的最适底物是没食子酸。
据文献报道,不同果蔬PPO最适底物差异很大,例如甘蓝PPO最适底物为间苯三酚,茄子、生菜、苹果PPO最适底物为绿原酸[12-15],紫甘薯PPO最适底物是4-甲基邻苯二酚[16]。然而,蒋世云等[10]报道,白蜡荔枝果肉多酚氧化酶最佳底物为4-甲基儿茶酚,可能荔枝品种不同,其果肉多酚氧化酶的类型存在差异,因而其果肉多酚氧化酶最适底物也有区别。
2.2 反应温度对荔枝果肉PPO活性的影响
图2表明荔枝果肉PPO最适反应温度为35~50℃,其中,50℃时PPO相对酶活最大。特别是,荔枝果肉PPO活性在反应温度35~55℃之间出现两个吸收峰,分别在35℃和50℃,这表明荔枝果肉PPO有同功酶存在,已有文献报道了牛蒡[17]、草菇[18]、板栗[19]等的多酚氧化酶为同功酶。
温度对PPO的活性影响很大,一方面温度升高,提高了反应的活化能,因而加快了其催化反应的进行;另一方面,温度升高使酶蛋白质变性,导致酶失活,降低催化反应速度,酶促褐变是这两种作用的协同效果[20]。因此,低温贮藏是延缓荔枝贮藏中酶褐变的有效方法,高温热处理是抑制荔枝加工过程中酶褐变的有效方法。

图2 反应温度对PPO活性的影响Fig.2 Effect of reaction temperature on PPO activity
2.3 反应pH值对荔枝果肉PPO活性的影响

图3 pH值对PPO活性的影响Fig.3 Effect of pH on PPO activity
2.4 荔枝果肉PPO酶促动力学参数Km与Vmax
尽管PPO对于不同的底物会显示出不同的活性,但是不能仅依此作为PPO最适底物的判定标准。PPO最适底物的选择主要依据以下两个因素:强底物结合能力和高催化效率,即低Km和高Vmax。Km是PPO对于不同底物的特征性常数,Km值越小,说明达到最大反应速度一半时所需底物浓度就越少,酶对底物的亲和力就越大,反之亦然。Vmax则表示当PPO浓度不变时,PPO被底物饱和,反应速度达到最大的状态[19]。
由Linewear-Burk方程[23]1/V =Km/Vmax{1/[S]}+1/Vmax([S]为没食子酸浓度)可得到荔枝果肉PPO的Km值与Vmax值分别为(26.033±2.188)mmol/L、(34.816±3.733)g/(L·min)。
2.5 荔枝果肉PPO的热稳定性及热失活参数
由图4可见,随着温浴温度的提高(40~80℃),PPO活性下降幅度增加。温浴温度为8 0℃时,温浴前15min,荔枝肉PPO相对酶活下降幅度较大(PPO相对酶活仅剩余40%左右),温浴60min时PPO相对酶活仅剩余20%左右。因此,果蔬生产中常采用的高温短时热处理工艺有利于抑制荔枝PPO酶活性,防止由于PPO引起的荔枝加工过程中的褐变反应。

图4 荔枝果肉PPO的热稳定性Fig.4 Thermal stability of PPO from litchi
按照Galani等[11]方法,荔枝果肉PPO在40、50、60、70℃和80℃条件反应10min的热失活参数如表1所示。在40~80℃,荔枝肉PPO热失活的活化能(ΔE#)为4202.8J/mol,焓变(ΔH#)的平均值为1434.1J/mol,吉布斯自由能(ΔG#)的平均值为102.4kJ/mol,熵变(ΔS#)的平均值为-303.3J/(mol·K)。
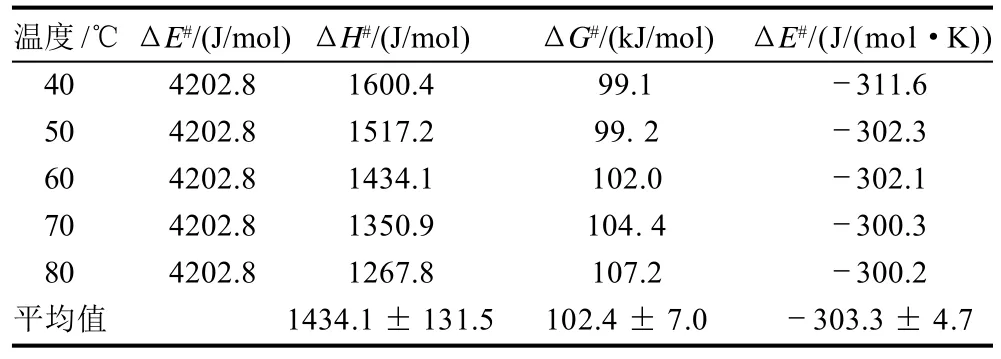
表1 荔枝果肉PPO热失活参数Table 1 Transition state parameters for heating inactivation of PPO from litchi
热失活ΔH#表示的是PPO热失活形成过渡态时非共价键的断裂数目[24],可用于评价PPO热稳定性。荔枝果肉PPO热失活ΔH#低于西红柿(21~29kJ/mol)[25]、蘑菇(49.8~89.3kJ/mol)[26]、紫甘薯(5.5kJ/mol)[16]等中PPO热失活ΔH#,说明荔枝果肉PPO热稳定性较差。荔枝果肉PPO热失活参数结果再次表明,荔枝生产加工时可采用高温处理来抑制荔枝果肉PPO引起的褐变反应。
2.6 pH值对PPO活性的影响
如图5所示,荔枝果肉PPO在pH5.0~6.0时相对酶活最小,随着pH值的上升(pH >6.0)或pH值的下降(pH 4.0~5.0),荔枝果肉PPO相对酶活相对变大,此结果与反应pH值对荔枝果肉PPO相对酶活的影响结果相似。因此,调节pH值能有效抑制PPO相对酶活,可以减轻荔枝加工中的酶褐变的程度。在荔枝加工过程中,为了防止荔枝的酶褐变,可用适当浓度的酸溶液护色(pH5.0~6.0)。

图5 pH值对PPO活性的影响Fig.5 Effect of pH on PPO stability
2.7 荔枝酒PPO活性变化与荔枝酒褐变的相关性

图6 荔枝酒PPO活性变化与荔枝酒褐变的相关性Fig.6 Correlation between the change of PPO activity and the browning of litchi wine
将荔枝酒发酵过程中色泽变化与其PPO相对酶活变化如图6所示,将荔枝酒发酵过程中褐变与其PPO相对酶活变作相关性分析。结果显示,二者变化呈正相关(r =+0.994,双尾检验),而且相关性极显著(P<0.01)。分析结果表明,发酵过程中荔枝酒色泽的变化是由于PPO活性的变化所致,也就是说,荔枝酒发酵过程中的褐变原因主要就是其PPO催化的酶促褐变。果蔬贮藏加工期间褐变的原因,很多研究认为主要是酶促褐变,即果蔬中的酚类物质在多酚氧化酶的作用下被氧化的结果[2-6,8,20,27-28]。这一结果与Iyengar等[5]、郁志芳[8]、Langdon[27]及冯卫华[28]的研究结果一致。
3 结 论
荔枝PPO最适底物为没食子酸,荔枝中PPO存在同功酶。以没食子酸为底物,荔枝PPO最适反应pH8.0,最适反应温度50℃,Km为26.033mmol/L,Vmax为34.816 g/(L·min)。荔枝PPO对酸碱、对热稳定性较差。因此,低温贮藏和高温热处理可有效抑制荔枝在贮藏和加工中的PPO褐变反应,并且荔枝加工过程中可以用酸(pH5.0~6.0)护色。荔枝酒发酵过程中色泽变化与其PPO活性变化呈极显著正相关(P<0.01),荔枝酒发酵过程中的褐变主要是由荔枝PPO引起的酶促褐变。
[1] 岳强, 曾新安, 于淑娟, 等. 新鲜荔枝汁营养成分分析[J]. 食品工业科技, 2006, 27(4): 173-174.
[2] 董周永, 池建伟, 杨公明, 等. 荔枝的保健作用及开发利用前景[J].食品研究与开发, 2005, 26(5): 148-151.
[3] 曾宪远, 曾新安, 彭超英, 等. 几种添加剂对荔枝酒风味的影响[J].酿酒科技, 2006 (11): 27-29.
[4] MANZOCCO L, CALLIGARIS S, MASTROCOLA D, et al. Review of non-enzymatic browning and antioxidant capacity in processed foods[J]. Trends Food Science Technol, 2001, 11(9/10): 340-346.
[5] IYENGAR R, MCEVILY A J. Anti-browing agents: alternative to the use of sulfites in foods[J]. Trends Food Science Technol, 1992, 3: 60-64.
[6] 李桂琴, 刘坤, 张玉星. 雪梨果肉多酚氧化酶的活性研究与纯化[J].食品科学, 2007, 28(12): 297-300.
[7] 杨昌鹏, 杨静, 藤田修二. 番石榴多酚氧化酶的部分纯化及其特性研究[J]. 食品与发酵工业, 2006, 32(9): 23-27.
[8] 郁志芳, 夏志华, 陆兆. 新鲜切甘薯酶促褐变机理的研究[J]. 食品科学, 2005, 26(5): 54-59.
[9] 熊何健, 卢玉兰. 荔枝壳中多酚氧化酶活性研究[J]. 食品科学, 2006,27(12): 182-185.
[10] 蒋世云, 刘光东, 师玉忠, 等. 荔枝褐变及其多酚氧化酶动力学研究[J]. 广西工学院学报, 1999, 17(2): 18-20.
[11] GALANI D, APENTEN R K O. The comparative heat atability of bovine β-lactoglobulin in buffer and complex media[J]. J Food Sci,1997, 74(1): 89-98.
[12] FUJITA S, TONO T. Purification and some properties of polyphenol oxidase in eggplant (Solanum melongena)[J]. J Sci Food Agric, 1988,46(1): 115-123.
[13] FUJITA S, TONO T, KAWAHARA H. Purification and properties of polyphenol oxidase in head lettuce (Lactuca sativa)[J]. J Sci Food Agric, 1991, 55(4): 643-651.
[14] FUJITA S, SAARI N, MAEGAWA M, et al. Purification and properties of polyphenol oxidase from cabbage (Brassica oleracea L.)[J]. Agric Food Chem, 1995, 43(5): 1138 -1142.
[15] MURATA M, KUROKAMI C, HOMMA S. Purification and some properties of chlorogenic acid oxidase from apple (Malus pumula)[J].Biosci Biotech Biochem, 1992, 56(11): 1705-1710.
[16] 许正虹, 刘璇, 高彦祥. 紫甘薯多酚氧化酶性质研究[J]. 食品与发酵工业, 2006, 32(8): 18-23.
[17] 乔旭光, 夏向东, 张步志, 等. 牛蒡多酚氧化酶酶学性质的研究[J].山东农业大学学报, 1997, 28(3): 327-330.
[18] 于新, 黄小丹, 冯彤, 等. 草菇多酚氧化酶及过氧化物酶特性的研究[J]. 仲恺农业技术学院学报, 1998, 11(3): 27-33.
[19] 叶兴乾, 张贵平. 板栗多酚氧化酶性质的研究[J]. 上海交通大学学报, 2001, 19(3): 174-179.
[20] 汤凤霞, 魏好程, 曹禹. 芒果多酚氧化酶的特性及抑制研究[J]. 食品科学, 2006, 27(12): 156-160.
[21] MARUSEK C M, TROBAUGH N M, FLURKEY W H, et al. Comparative analysis of polyphenol oxidase from plant and fungal species[J].J Inorg Biochem, 2006, 100(1): 108-123.
[22] van GELDER C W G, FLURKEY W H, WICHERS H J. Sequence and structural features of plant and fungal tyrosinases[J]. Phytochemistry,1997, 45(7): 1309-1323.
[23] LINEWEAVER H, BURK D. The determination of enzyme dissociation constants[J]. J Am Chem Soc, 1934, 56(3): 658-661.
[24] MARTINEZ M, WHITAKER J R. The biochemistry and control of enzymatic browning[J]. Trends Food Sci Technol, 1995, 6(6): 195-200.
[25] SPAGNA G, BARBAGALLO R N, CHISARI M, et al. Characterization of a tomato polyphenol oxidase and its role in browning and lycopene content[J]. Agric Food Chem, 2005, 53(6): 2032 -2038.
[26] KOLCUOGLU Y, COLAK A, SESLI E, et al. Comparative characterization of monophenolase and diphenolase activities from a wild edible mushroom (Macrolepiota mastoidea)[J]. Food Chem, 2007, 101(2):778-785.
[27] LANGDON T T. Prevent browning in fresh prepared potatoes without the use of sulfating agents[J]. Food Technol, 1987, 41(5): 64-67.
[28] 冯卫华. 采后香椿衰老褐变相关因素分析[D]. 北京: 中国农业大学, 2007.
Browning Control of Litchi and Litchi Wine
FENG Wei-hua,LIN Li-mian,QIN Yan
(College of Light Industry and Food, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China)
In the present study, litchi and litchi wine were used as the materials to study the properties of polyphenol oxidase(PPO) in litchi, and explore browning mechanisms and controlling strategies of litchi wine during fermentation process. The isoenzymes of PPO were observed in litchi and the optimal substrate of PPO in litchi was gallic acid. The optimal pH and temperature for PPO from litchi were 8.0 and 50 ℃ using gallic acid as the substrate. Kinetic parameters such as Kmand Vmaxof PPO from litchi were 26.033 mmol/L and 34.816 g/(L·min), respectively. The PPO from litchi was not stable at the conditions of 50 - 80 ℃, strong acid and strong alkali. Higher PPO activity in litchi was the major browning cause of litchi wine during fermentation process. Therefore, low-temperature storage and heating treatment can effectively inhibit the browning of litchi and litchi wine.
litchi;litchi wine;polyphenol oxidase;browning
TS201.1
A
1002-6630(2011)04-0246-05
2010-04-12
国家科技部星火计划项目子课题( 2007EA781003);广东省科技厅项目(2007B023001002);广州市科技厅项目(2007Z1-E0091);广州市科技计划项目(2009C6-I051);仲恺农业工程学院项目(G2360280)
冯卫华(1968—),女,副教授,博士,研究方向为果蔬贮藏与加工、生物活性成分提取纯化及功能分析。E-mail:fengwh68@163.com
