食品中单增李斯特菌环介导等温扩增检测技术
2011-10-28易海华祝长青宋阳威孙慧宇王云飞吴萍兰徐继承赵金伟
易海华,祝长青,宋阳威,孙慧宇,房 超,王云飞,徐 波,吴萍兰,徐 政,徐继承,赵金伟,*
(1.徐州出入境检验检疫局技术中心,江苏 徐州 221006;2.江苏出入境检验检疫局,江苏 南京 210000;3.徐州医学院公共卫生学院,江苏 徐州 221000)
食品中单增李斯特菌环介导等温扩增检测技术
易海华1,祝长青2,宋阳威1,孙慧宇1,房 超1,王云飞1,徐 波1,吴萍兰1,徐 政1,徐继承3,赵金伟1,*
(1.徐州出入境检验检疫局技术中心,江苏 徐州 221006;2.江苏出入境检验检疫局,江苏 南京 210000;3.徐州医学院公共卫生学院,江苏 徐州 221000)
目的:建立一种快速、简单地检测食品中单增李斯特菌的环介导恒温基因扩增方法(loop-mediated isothermal amplification,LAMP),并初步建立荧光定量LAMP检测单增李斯特菌的方法。方法:根据LAMP方法的原理,设计LAMP检测引物,建立LAMP检测方法,同时对方法的特异性、灵敏度、重复性及初始拷贝数的对数值与反应时间之间的线性关系进行评估。结果:使用LAMP引物可以在0.5h内完成检测工作;LAMP检测技术的灵敏度高出聚合酶链式反应检测技术100倍以上,检出限达到1.72×101拷贝/反应,与其他食源性致病菌无交叉反应,平均实验间变异系数小于5%;反应时间与初始模板浓度的常用对数值有良好的线性关系(R2=0.9994)。结论:本方法具有快速、灵敏、特异、操作简单、设备要求低的特点,具有广阔的应用前景。
单增李斯特菌;环介导恒温基因扩增方法;快速检测
单核细胞增生李斯特氏菌[Listeria monocytogenes,以下简称单增李斯特菌(LM)]是一种革兰氏阳性菌。它是一种人畜共患致病菌,很容易引起食品污染和李斯特菌病爆发[1],近年来,欧美因食品感染的李斯特菌病患者呈上升趋势,WHO已将其列为20世纪90年代以来食品中四大致病菌之一[2]。
李斯特菌检测方法包括传统的分离鉴定法、免疫学鉴定方法等。分离培养鉴定法比较简单,但是操作繁琐、耗时长,不适合日常对于食品的检测。LM免疫学检测操作简便,可在同一时间内检测大量样品,但由于菌体及鞭毛抗原交叉反应的存在,难以进行李斯特菌种间特异性鉴别。随着分子生物学的发展,近年来基于DNA扩增的分子生物学方法如PCR及实时荧光定量PCR不断应用于致病菌的快速检测。与传统检测方法相比较,其具有更高的灵敏度和特异性。然而此类方法本身具有费用高、对设备要求高、实用性差的缺陷限制其在基层医疗防疫和现场查验机构中的广泛应用。有研究者[3-4]报道的环介导等温扩增法(loop-mediated isothermal amplification,LAMP)特异、敏感、快速且不需要特殊仪器[5-6]。为寻找定性定量检测单增李斯特菌更好的方法,本实验拟利用LAMP定性、定量检测食品中的单增李斯特菌。
本实验采用定量LAMP的技术和设备,参考有关使用浊度变化进行相关微生物定量LAMP检测方法和原理,研究单增李斯特菌的定性检测和荧光定量LAMP检测法。本实验选择Genebank登录号为M24199、单增李斯特菌的溶血素基因(hly基因)序列作为目标基因,根据LAMP引物设计的基本原则设计引物,并建立LAMP检测方法。同时,构建含hly基因的重组质粒用于荧光定量LAMP实验标准曲线的制定和检测灵敏度及重复性的评估。
1 材料与方法
1.1 材料
1.1.1 菌株
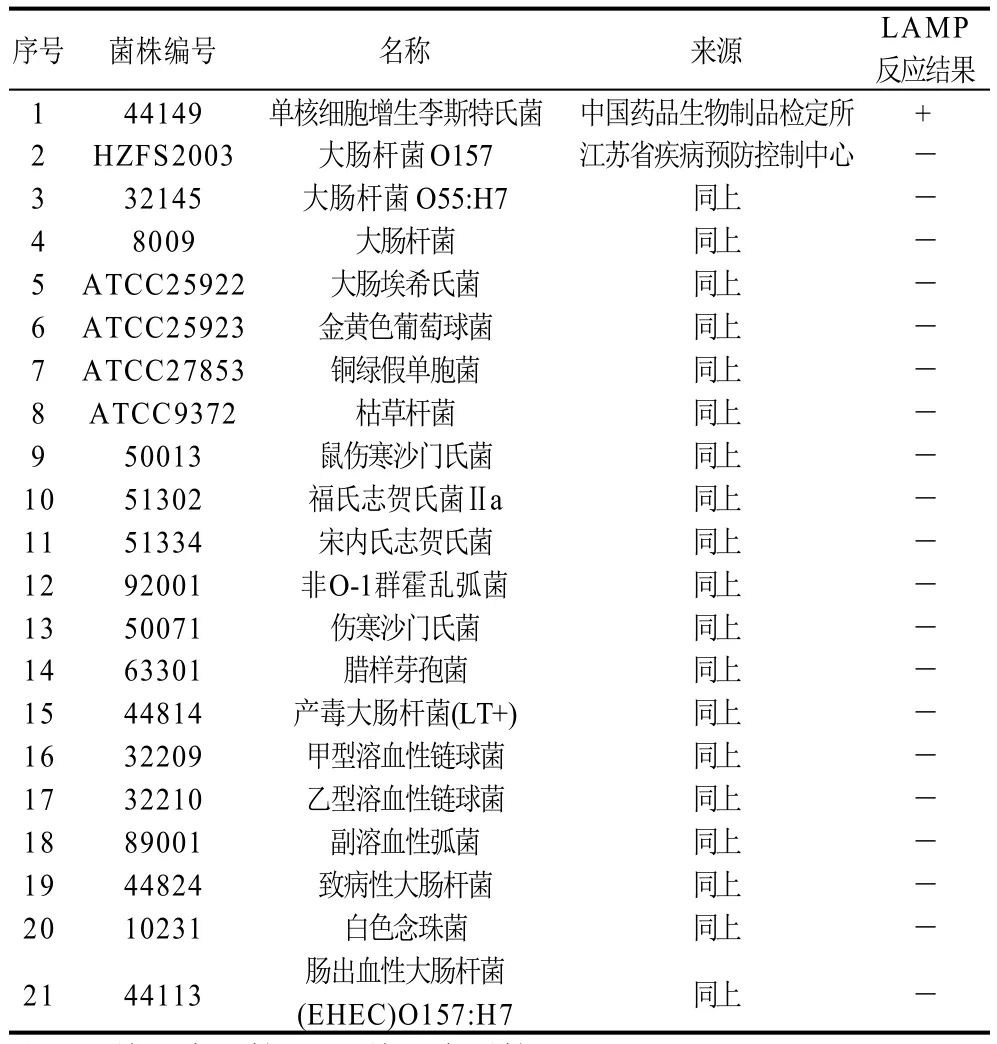
表1 实验所用菌株及LAMP检测实验结果统计Table 1 Examined strains in this study and their specificity to LAMP primers
单增李斯特菌标准株 中国生物制品鉴定所;部分常见的食源性病原菌菌株共20株,用于分析LAMP反应体系引物的特异性,它们的编号及来源如表1所示,均购自江苏疾病预防控制中心微生物制剂公司。
1.1.2 试剂
PCR试剂、SYBR GreenⅠ染料、LAMP引物 上海生工公司;pGEM-T easy载体系统、DNA提取试剂盒 美国Promega公司;质粒DNA提取试剂盒 美国Axygen公司;胶回收试剂盒 美国Omega公司;100bp ladder DNA-Maker 大连TaKara公司;Pico Green染料美国Molecular Probes公司;Bst DNA大片段聚合酶New England Biolabs公司;Betaine 美国Sigma公司;其他试剂为国产分析纯。
1.1.3 仪器与设备
7300 PCR扩增仪 美国ABI公司;紫外凝胶成像分析系统 美国Bio-RAD公司;高速离心机 德国Heraeus公司;HZQ-C空气浴振荡箱 哈尔滨市东明医疗仪器厂;CS-15R低温离心机、pH计 美国Beckman公司;精巧型恒温混匀器 德国Eppendorf公司;AJY1b-5-U微量有机分析专用超纯水机 重庆艾科浦公司;旋涡混匀器 美国IKA公司;恒温水浴锅 美国Memmert公司。
1.2 方法
1.2.1 引物的设计与合成
单增李斯特菌hly基因编码的李斯特菌溶血素是其主要毒力因子[7]。根据单增李斯特菌基因组序列,同时比较GeneBank数据库中相似菌株序列,显示hly基因保守性好。采用引物设计软件Primer Explorer 4.0设计1套2对引物,分别包括外引物F3和B3、内引物FIP和BIP(表 2)。
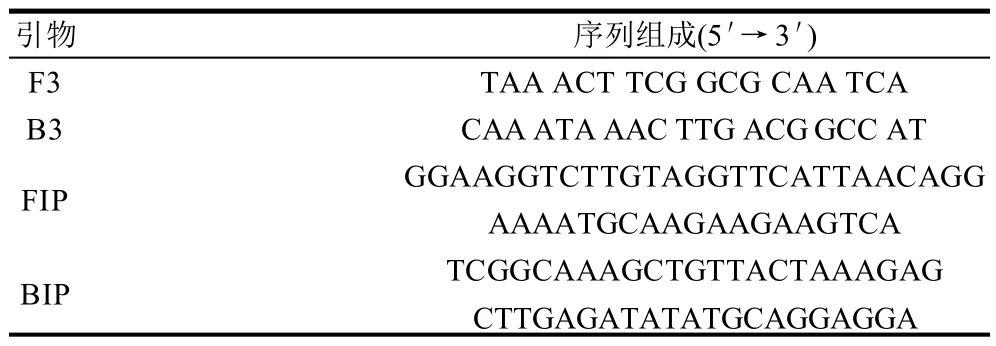
表2 针对单增李斯特菌hly基因序列设计的LAMP反应引物Table 2 LAMP primers based on the hly gene sequence of Listeria monocytogenes
1.2.2 基因组DNA提取及单增李斯特菌PCR扩增
1.2.2.1 DNA样品的制备
采用热裂解法,取适量菌加入50μL重蒸水混匀,沸水浴煮沸l0min,7000r/min离心10min,取上清液即为DNA模板。
1.2.2.2 单增李斯特菌PCR扩增
取0.2mL薄壁PCR管,向各管中加入:2×PCR Taq Mix 10μL;10μmol/L引物Mix(F3/B3) 1μL;模板DNA 2μL;双蒸水7μL。混匀,置于PCR扩增仪中,95℃ 30s→55℃ 30s→72℃ 30s,30个循环;72℃ 5min,4℃中止。取扩增产物各5μL,DL2000(100、250、500、1000、2000bp)分子质量标准5μL/泳道。1g/100mL琼脂糖凝胶120V条件下电泳25min。用凝胶紫外分析仪观察,照相保存。
1.2.3 重组质粒pGEM-T-hly构建及鉴定
用F3、B3为引物扩增hly基因,胶回收纯化后与pGEM-T easy进行连接反应,转化至大肠杆菌DH5α感受态细胞,过夜培养,菌落PCR方法挑选阳性克隆子。选择鉴定为阳性的克隆子扩培,提取质粒,酶切、测序鉴定。将测序正确的质粒保存于-20℃,备用。重组质粒的构建及鉴定由深圳博睿祥晖生物技术有限公司完成。
1.2.4 单增李斯特菌LAMP检测方法的建立
1.2.4.1 单增李斯特菌LAMP反应检测体系的建立
对LAMP反应体系中的关键物质Mg2+浓度、引物浓度、反应温度等影响因素进行探讨,最终确定单增李斯特菌LAMP检测的最佳反应体系。单增李斯特菌LAMP的总反应体系为25μL,成分包括:10×Bst buffer[200mmol/L Tris-HCl(pH8.8、25℃),100mmol/L KCl,100mmol/L (NH4)2SO4,20mmol/L MgSO4,0.1g/100mL Triton-100) 2.5μL;Betaine(4mol/L) 5μL;引物(F3:B3:FIP:BIP=5:5:40:40,μmol/L) 1μL;Bst酶(8U) 1μL;dNTPs(10mmol/L)3.5μL;MgCl2(25mol/L) 6μL;模板1μL;灭菌去离子水4μL。反应体系配制后,立即60℃反应60min,再置80℃反应10min灭活Bst DNA聚合酶以终止反应。
1.2.4.2 单增李斯特菌LAMP扩增产物的检测
反应结束后,6000r/min离心5min观察沉淀结果。或加入20×Pico Green染料1μL,混匀,观察反应管颜色是否发生变化。或取5μL单增李斯特菌LAMP反应产物,于1g/100mL琼脂糖凝胶120V条件下电泳25min。用凝胶紫外分析仪观察,照相保存。
1.2.5 单增李斯特菌荧光定量LAMP检测方法的建立及标准曲线的制作
LAMP反应体系中加入1μL 10×SYBR GreenⅠ,置于PCR仪上进行等温扩增反应。以测序正确并定量的重组质粒pGEM-T-hly为模板。反应结束后,以反应时间和模板拷贝数绘制曲线。
1.2.6 特异性实验
以阳性质粒pGEM-T-hly、单增李斯特菌基因组DNA为模板进行LAMP扩增,LAMP产物进行琼脂糖凝胶电泳,观察结果。
同时以阳性质粒pGEM-T-hly、单增李斯特菌基因组DNA及相关致病菌基因组DNA为模板进行LAMP扩增。采用琼脂糖凝胶电泳、沉淀观察结果或染色观察结果。
1.2.7 灵敏度实验
10倍稀释法稀释单增李斯特PCR产物,以定量的重组质粒为模板,进行LAMP扩增和PCR扩增。琼脂糖凝胶电泳观察结果。
1.2.8 重复性实验
在5个梯度水平进行10批次的重复实验,观察、记录实验结果并计算平均值、标准差、变异系数。
2 结果与分析
2.1 单增李斯特菌LAMP检测方法的建立
LAMP反应结束后,离心观察沉淀结果(图1A)。加入20×Pico Green染料,混匀,加入单增李斯特菌重组质粒、单增李斯特菌基因组DNA模板的反应管可观察到颜色变为绿色,而阴性对照则不显示绿色(图1 B)。琼脂糖凝胶电泳检测后,加入单增李斯特菌PCR产物、单增李斯特菌基因组DNA模板的反应产物有特异性的梯状条带出现,而阴性对照则无条带出现(图 1C)。


图1 单增李斯特菌(hly基因)LAMP相关图谱Fig.1 Quanlitative detection of Listeria monocytogenes
2.2 单增李斯特菌荧光定量LAMP检测方法的建立及标准曲线的制作
以单增李斯特菌阳性质粒为模板建立单增李斯特菌荧光定量LAMP检测方法,配制反应体系,在PCR仪上进行扩增反应,观察荧光扩增曲线。反应结束后,根据反应时间和反应体系中模板的拷贝数的对数值绘制标准曲线(图2)。结果显示,起始模板浓度的常用对数值与循环数(Ct)值之间呈良好的线性关系(R2=0.9994)。

图2 单增李斯特菌阳性质粒梯度稀释后的LAMP扩增曲线Fig.2 LAMP amplification curves of recombinant plasmid carrying the hly gene of Listeria monocytogenes after gradient dilution
2.3 特异性实验
用建立的LAMP方法分别对21株实验株进行扩增,采用琼脂糖凝胶电泳、沉淀法和染料染色法观察实验结果。验证单增李斯特菌LAMP检测方法的特异性。结果表明,仅以单增李斯特菌阳性质粒和单增李斯特菌基因组DNA为模板的反应管呈阳性,其他致病菌均为阴性,见表1和图3。
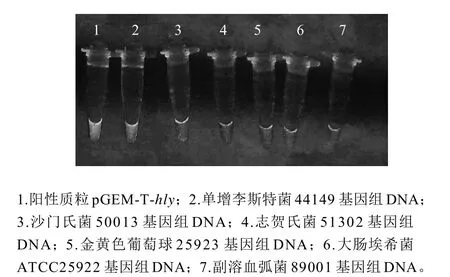
图3 单增李斯特菌菌及部分相关致病菌LAMP检测染色图Fig.3 Specificity test of the developed LAMP method
2.4 灵敏性实验
通过以10倍稀释法稀释PCR产物为模板进行LAMP检测和PCR扩增,采用实时荧光和琼脂糖凝胶电泳法观察实验结果。结果表明,所建立的单增李斯特菌LAMP检测方法的灵敏度是PCR方法的100倍,检测限达到1.72×101拷贝/反应(图4)。

图4 单增李斯特菌LAMP检测法与PCR法灵敏性实验对比结果Fig.4 Comparison on sensitivity between the developed LAMP method and PCR method
2.5 重复性实验
采用实时荧光LAMP法在5个浓度梯度水平进行10批次的重复实验,对反应荧光信号值达到一定值时所需的时间进行统计分析,变异系数均小于5%,实验的稳定性和重复性较好(表3)。

表3 单增李斯特菌5个梯度水平进行10批次的重复实验结果Table 3 Repeatability test of the developed LAMP method by 10 replicate determinations at 5 levels
3 讨 论
本实验以单增李斯特菌编码李斯特菌溶血素(LLO)hly基因为目的基因,根据LAMP反应的原理及引物设计的原则,经过优化实验确定单增李斯特菌LAMP检测反应体系和程序。结果表明,使用LAMP法检测单增李斯特菌的灵敏度非常高,1.72×101拷贝/反应模板量时即可检出,高于目前常用的PCR法100倍以上。在特异性和稳定性的实验中LAMP法也表现出较强的特异性,没有发现假阳性和假阴性结果。结合LAMP法检测的优点,表明单增李斯特菌LAMP检测方法具有在现场快速检测和基层医疗卫生机构大规模定性使用的潜力。本实验在定性LAMP的基础上,探讨了实时荧光定量LAMP检测方法。实时荧光定量LAMP的主要技术优点在于:动态实时监测,能直观地反映整个LAMP过程的动态变化;除加样时一次开盖外,全闭管操作,因而能有效地防止因扩增产物污染而导致的假阳性。以李斯特菌PCR产物为模板进行实时荧光LAMP反应,制作标准曲线,结果表明,初始拷贝数的对数值与反应时间的线性关系良好(R2=0.9994)。实时荧光定量LAMP技术的初步探讨为LAMP技术的应用提供了新的思路,为定量检测提供了一种新方法。
[1] 杭华. IMS2PCR快速检测单核细胞增生李斯特氏菌[J]. 大连轻工业学院学报, 2007, 26(3): 218-220.
[2] RYSER T, ELMER H M. Listeriosis and food satisfy[J]. Marcel Dekkeinc, 1991, 6(2): 214-218.
[3] MAYXAY M, PUKRITTAYAKAMEE S, NEWTON P N, et al. Mixedspecies malaria infections in humans[J]. Trends Parasitol, 2004, 20(5):233-240.
[4] NOTOMI T, OKAYAMA H, MASUBUCHI H T, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12):463-567.
[5] MORI Y, KITAO M, TOMITA N, et al. Real-time turbidimetry of LAMP reaction for quantifying template DNA[J]. Biochem Biophys Methods, 2004, 59(2): 145-157.
[6] NAGAMINE K, KUZUHARA Y, NOTOMI T. Isolation of singlestranded DNA from loop-mediated isothermal amplication products[J].Biochem Biophys Res Commun, 2002, 290(4): 1195-1198.
[7] 殷月兰. 李斯特菌溶血素基因的原核表达及其生物学特性[J]. 微生物学报, 2004, 44(6): 752-755.
Detection of Listeria monocytogenes in Foods Using Loop-mediated Isothermal Amplification
YI Hai-hua1,ZHU Chang-qing2,SONG Yang-wei1,SUN Hui-yu1,FANG Chao1,WANG Yun-fei1,XU Bo1,WU Ping-lan1,XU Zheng1,XU Ji-cheng3,ZHAO Jin-wei1,*
(1. Technology Center of Xuzhou Entry-exit Inspection and Quarantine Bureau, Xuzhou 221006, China;
2. Jiangsu Entry-exit Inspection and Quarantine Bureau, Nanjing 210000, China;
3. School of Public Health, Xuzhou Medical College, Xuzhou 221000, China)
Objective: To develop a rapid and simple method for qualifying Listeria monocytogenes in foods using 1oop-mediated isothermal amplification (LAMP), and to preliminarily develop a fluorescent quantitative method for the determination of this bacteria spices based on LAMP. Methods: According to the principle of LAMP, primers were designed for the development of measurement methods for Listeria monocytogenes. Meanwhile, the specificity, sensitivity and repeatability of the developed method were assessed, and the linear relationship between the logarithmized number of initial copies and reaction time was examined. Results: The detection of Listeria monocytogenes with designed LAMP primers could be finished in 0.5 h. The developed detection technique showed a sensitivity over 100-fold higher than PCR, and the limit of detection was 1.72 × 101copies per reaction. No cross-reactivity with other foodborne pathogens was observed. Avery intra-test coefficients of variation at five gradient levels of concentration were all smaller than 5%. There was an excellent linear relationship between reaction time and initial template concentration found, with a determination coefficient R2equaling 0.9994. Conclusion: This method is characterized by rapidity, high sensitivity and specificity, ease of operation, and low equipment requirements, with extensive application prospects.
Listeria monocytogenes;loop-mediated isothermal amplification (LAMP);rapid detection
R155.31
A
1002-6630(2011)04-0203-05
2010-03-29
国家质量监督检验检疫总局科研专项(2008IK159)
易海华(1977—),男,主管医师,本科,主要从事病原微生物诊断研究。E-mail:yihaihua88@126.com
*通信作者:赵金伟(1966—),男,研究员,博士,主要从事分析化学研究。E-mail:zhaojw@jsciq.gov.cn
