新霉素ELISA检测方法的建立
2011-10-27刘沙洲桑小雪欧阳华学雷绍荣白林含
刘沙洲,桑小雪,欧阳华学,雷绍荣,白林含,*
(1.四川大学生命科学学院,四川 成都 610065;2.成都市食品药品检测中心,四川 成都 610045;3.四川省农业科学院分析测试中心,四川 成都 610066)
新霉素ELISA检测方法的建立
刘沙洲1,2,桑小雪1,欧阳华学3,雷绍荣3,白林含1,*
(1.四川大学生命科学学院,四川 成都 610065;2.成都市食品药品检测中心,四川 成都 610045;3.四川省农业科学院分析测试中心,四川 成都 610066)
目的:比较直接和间接竞争酶联免疫法(enzyme linked immunosorbent assay,ELISA)的优缺点,建立新霉素残留ELISA检测方法。方法:利用自制的新霉素多克隆抗体,采用直接竞争和间接竞争ELISA方法检测新霉素残留,并比较两种方法的优缺点。结果:新霉素抗血清和庆大霉素的交叉反应率为2.04%,和卡那霉素的交叉反应率为0.02%,和氨苄青霉素、红霉素、四环素的交叉反应率均小于0.01%。初步测试新霉素间接竞争ELISA法的准确性和回收率。板内误差小于4%,板间误差小于11%,回收率为135.5%~191.3%。直接竞争和间接竞争ELISA方法的检测极限分别为28.58ng/mL和51.74ng/mL,达到了国家对新霉素规定的500μg/kg MRL检测限。结论:建立了直接竞争和间接ELISA吸附检测方法,条件优化更成功的间接竞争ELISA可用于开发新霉素检测试剂盒。
新霉素;多克隆抗体;竞争酶联免疫法(enzyme linked immunosorbent assay,ELISA);方法建立
从全球来看,在食用动物中限用、禁用抗生素饲料添加剂已经成为一种发展趋势。在1997年,联合国粮农组织(food and agriculture organization,FAO)就要求停止或禁止使用抗生素饲料添加剂,1998年12月又提议在1 0年内淘汰抗生素饲料添加剂。2 0 0 4年,WHO、FAO和世界动物卫生组织(office international des epizooties,OIE)联合召开了一次专题讨论会,讨论了非人用抗生素的使用和抗生素的耐药性问题。发达国家和有关国际组织都对抗生素在动物饲料中使用进行了越来越严格的限制。特别是不准将人用抗生素用于动物,在食用动物中禁用、限用抗生素饲料添加剂已经成为世界共识[1-2],是大势所趋。
然而我国长期存在滥用、不合理使用抗生素饲料添加剂的情况,动物性食品中抗生素残留的问题十分严重,不仅给消费者带来健康上的损害,而且阻碍了我国动物产品的出口。近几年,我国不断加强对在食用动物中使用抗生素现象的监督管理,以最大限度地减少对食品安全和人类健康的威胁。除了制订、修订法律法规、建立健全监督检验体系、开展残留监控工作外,还不断对残留的限量作出规定。2002年,农业部重新修订发布兽药在动物性食品中的最高残留限量[3],使规定限量的兽药达到134种,主要是抗生素类药物,其中就包括新霉素。
酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)灵敏度高、特异性强、可用于大量样品的快速筛选、仪器化程度低、检测速度快、样品前处理相对简单、价格低和适于开发成携带方便的试剂盒等优点,是国内兽药检测现场监控、大量样本筛查的主要方法。用于抗生素残留检测的主要方法有直接竞争ELISA法和间接竞争ELISA法,本实验拟比较直接和间接ELISA法的优缺点,以建立新霉素残留ELISA检测方法。
1 材料与方法
1.1 材料、试剂与仪器
KLH-NEO抗血清、包被抗原BSA-NEO 自制[4];牛血清白蛋白、HRP-NEO、新霉素硫酸盐、庆大霉素硫酸盐、卡那霉素硫酸盐、氨苄青霉素、红霉素、四环素盐酸盐 上海华舜生物工程有限公司;辣根过氧化物酶标羊抗兔IgG 博士德生物工程有限公司。
0.1mol/L柠檬酸、0.2mol/L十二水磷酸氢二钠、邻苯二胺、过氧化氢、2mol/L硫酸、pH7.4磷酸缓冲盐水-0.05% Tween20(简称PBS-Tween 20)、pH9.6碳酸盐缓冲液、磷酸盐缓冲液(PBS)。
3550型酶标测定仪 美国Bio-RAD公司;酶标板成都博瑞克生物技术有限公司。
1.2 方法
1.2.1 直接竞争ELISA反应条件的建立
1.2.1.1 最佳包被抗血清用量与最佳HRP-NEO配比
采用方阵测定法,包被不同质量浓度的抗血清和阴性血清,直接测定HRP-NEO,以OD45nm接近于1.0为最佳反应条件。
1.2.1.2 最佳反应时间
设定抗血清和HRP-NEO的反应时间为20、40、60、80、100、120min,选择适当的反应时间。
1.2.1.3 采用直接竞争ELISA法建立新霉素标准曲线
用系列已知质量浓度的新霉素和酶标新霉素HRPNEO进行直接竞争ELISA反应,然后以B/B0(B0为0ng/mL孔的显色值,B为其他质量浓度孔的显色值)为纵坐标,新霉素质量浓度的常用对数为横坐标作图,得到标准曲线。根据待测样品的B/B0值,可由标准曲线推算出待测样品中新霉素的质量浓度。
1.2.2 间接竞争ELISA反应条件的优化
1.2.2.1 酶标抗体工作用量的选择
包被一抗直接测二抗,以OD450nm值接近于1.0时的酶标二抗稀释度为最适工作用量。
1.2.2.2 最佳包被抗原用量与最佳反应血清用量
采用方阵测定法,加入BSA-NEO作为包被抗原,再加入KLH-NEO抗血清和阴性血清,按ELISA操作程序进行,最后测定OD450nm值,以OD450nm值接近于1.0为最佳反应条件。
1.2.2.3 最佳反应时间
设定抗血清和BSA-NEO的反应时间为20、40、60、80、100min,选择适当的反应时间。
1.2.2.4 采用间接竞争ELISA法建立新霉素标准曲线
用系列已知质量浓度的新霉素和抗血清进行间接竞争ELISA反应,然后以B/B0(B0为0ng/mL孔的显色值,B为其他质量浓度孔的显色值)为纵坐标,新霉素质量浓度常用对数为横坐标作图,得到标准曲线。根据待测样品的B/B0值,可由标准曲线推算出待测样品中新霉素的质量浓度。
1.2.3 交叉反应的测定[5]
采用间接竞争ELISA法测定庆大霉素、卡那霉素、氨苄青霉素、四环素、红霉素和KLH-NEO抗血清的结合反应。新霉素的I50与这些抗生素的I50的百分比为交叉反应率,交叉反应率的高低决定了它们对新霉素检测干扰程度的大小。
1.2.4 方法准确性的测定
人工添加新霉素到PBS空白液中,使其在PBS中的终质量浓度为60、250ng/mL。
以板内误差及板间误差来表示该方法的精确度。板内测定为同一酶标板上同一样本若干孔的平均值,板间测定为不同酶标板上几次测定结果的平均值,本实验中板内误差和板间误差均取3次测定的平均值为准。
1.2.5 回收率的测定
回收率测定实验主要检验检测方法的可靠性。将新霉素质量浓度为60、250ng/mL的PBS溶液各取0.1mL进行间接竞争ELISA。同时以没有加入新霉素的PBS作为正对照。测定时每个样品质量浓度设定3个重复,并重复3次实验。然后进行间接竞争ELISA测定OD450nm,计算抑制率,代入标准回归方程,计算NEO的含量,并根据下式计算回收率:

2 结果与分析
2.1 直接竞争ELISA法
2.1.1 反应条件的建立
2.1.1.1 最佳包被抗血清用量与最佳HRP-NEO配比

表1 最佳包被抗血清用量与最佳HRP-NEO配比Table 1 Determination of optimal coating antiserum concentration and HRP/NEO ratio
由表1可知,在抗血清用量为1:1000、HRP-NEO配比为1:500时,OD450nm最大,初步确定最佳包被抗血清用量1:1000、最佳HRP-NEO配比1:500。作为对照的阴性血清几乎没有显色。
2.1.1.2 最佳反应时间
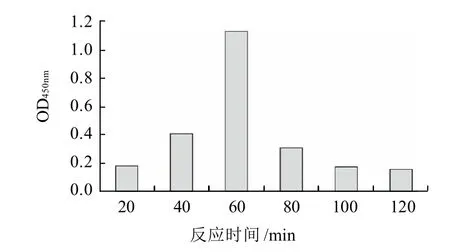
图1 直接竞争ELISA法最佳反应时间Fig.1 Determination of optimal reaction time of dc-ELISA
由图1可知,反应时间60min时,显色效果最好,因此确定直接竞争ELISA法的显色时间为60min。
2.1.2 新霉素标准曲线的建立
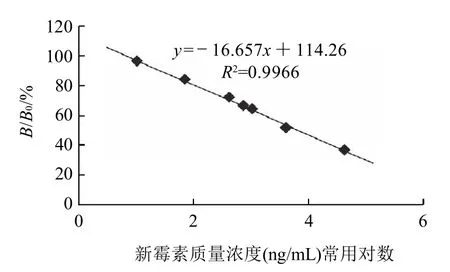
图2 新霉素标准曲线(直接竞争ELISA法)Fig.2 Standard curve for neomycin determination by dc-ELISA
如图2所示,B/B0达到90%时的新霉素质量浓度为该实验的最低检测极限,根据回归方程,计算出该直接竞争ELISA检测方法的检测限是28.58ng/mL,达到了国家对新霉素规定的500μg/kg MRL检测限。
2.2 间接竞争ELISA法
2.2.1 反应条件的确立
2.2.1.1 酶标二抗工作用量

表2 酶标二抗用量的确定Table 2 Determination of optimal enzyme labeled secondary antibody concentration
由表2可知,二抗稀释倍数为2000的时候,OD450nm值最接近1.0。所以,确定二抗的最佳用量为1:2000。
2.2.1.2 最佳包被抗原质量浓度与最佳反应血清用量
由表3可知,抗血清1:2000稀释、抗原1:400稀释时,OD450nm值接近1.0,且相近数据差别不大。所以,确定KLH-NEO抗血清1:2000稀释、BSA-NEO抗原1:400稀释。作为对照的阴性血清几乎没有显色。
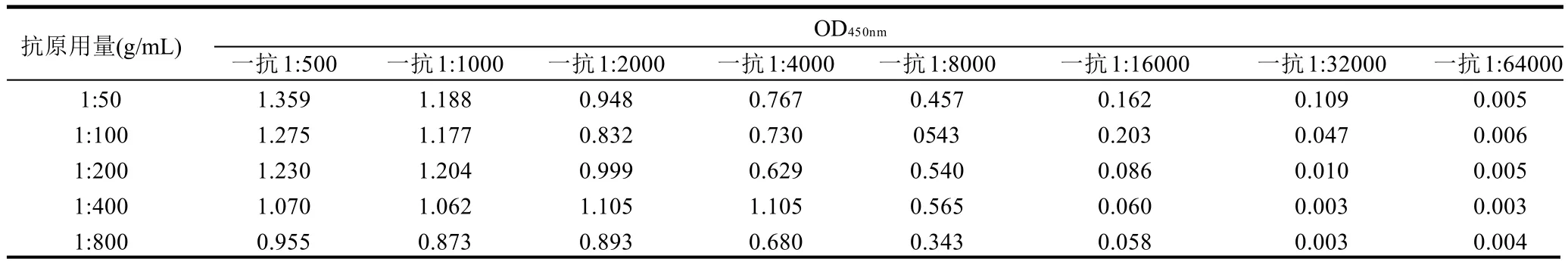
表3 包被抗原用量和血清用量的确定Table 3 Determination of optimal coating antigen and serum concentrations
2.2.1.3 最佳反应时间

图3 间接竞争ELISA法最佳反应时间Fig.3 Determination of optimal reaction time of idc-ELISA
由图3可知,反应时间为60min时,显色效果最好。
2.2.2 新霉素标准曲线的建立

图4 新霉素标准曲线(间接竞争ELISA法)Fig.4 Standard curve for neomycin determination by idc-ELISA
如图4所示,根据回归方程,计算出标准曲线中I50为174.58μg/mL。间接竞争ELISA检测方法的检测极限是51.74ng/mL,达到了国家标准对新霉素规定的500 μg/kg MRL检测限。
2.2.3 新霉素抗体和其他抗生素的交叉反应率

表4 新霉素抗体和其他抗生素交叉反应率实验结果Table 4 Cross-reaction rates of prepared anti-neomycin antibodies with other antibiotics
新霉素的I50与其他抗生素的I50的百分比为交叉反应率,交叉反应率的高低决定了它们对新霉素检测的干扰程度大小。本实验选取了5种抗生素来进行交叉反应率的测定。其中,庆大霉素、卡那霉素属于氨基糖苷类抗生素,和新霉素属同一大类;由表4可知,新霉素抗体和庆大霉素及卡那霉素存在一定的交叉反应,与青霉素、四环素、红霉素几乎没有交叉反应(<0.01%),这说明抗体的特异性好。新霉素抗体与庆大霉素、卡那霉素存在交叉反应是因为庆大霉素、卡那霉素和新霉素同属氨基糖苷类抗生素,存在结构上的相似性[6]。而青霉素属内酰胺类抗生素;四环素属四环素类抗生素;红霉素属大环内酯类抗生素[7]。
2.2.4 方法准确性的考察
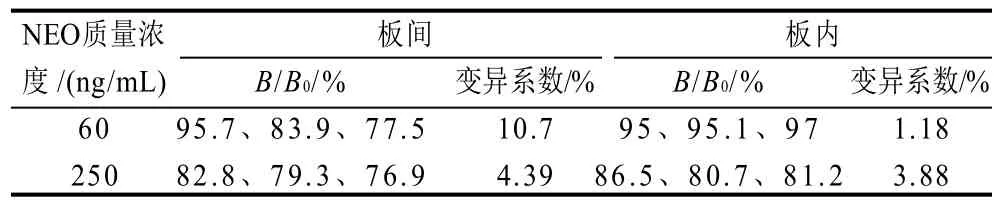
表5 变异系数实验结果Table 5 Coefficients of variation for inter-plate and intra-plate precision of idc-ELISA
如表5所示,NEO添加质量浓度为60ng/mL时,3次重复测定的板内变异系数为1.18%,板间变异系数为10.7%;NEO添加质量浓度为250ng/mL时,3次重复测定的板内变异系数为3.88%,板间变异系数为4.39%;说明该方法的稳定性较好。
2.2.5 回收率

表6 回收率考察实验结果Table 6 Results of spike recovery test of idc-ELISA
如表6所示,NEO添加质量浓度为60ng/mL时的回收率不及添加质量浓度为250ng/mL时的回收率理想,可能因为60ng/mL已接近于该方法的检测限51.29ng/mL,导致误差较大。
3 讨 论
本实验采用直接竞争和间接竞争ELISA初步建立了新霉素残留的酶联免疫测定方法。 两种方法检测极限都达到了国家对新霉素规定的500μg/kg MRL检测限。在本实验进行的3次实验中,间接竞争ELISA法的稳定性明显的强于直接竞争ELISA法,这可能与本实验室制备的新霉素多克隆抗体质量有关。抗体是酶联免疫测定中最关键的成分,提高检测方法的稳定性、灵敏性,关键在于提高抗体的质量,要解决这个问题,首先可以从制备新霉素单克隆抗体入手[8-12]。相对于多克隆抗体,单克隆抗体具有更高的特异性、纯度、均质性和重复性。
建立一个成熟的酶联免疫测定方法,需要进行稳定性实验,用大量的实验数据考察方法的交叉反应率、板内误差、板间误差和回收率。在此基础上还需要增加检测基质的种类[13],进行样品添加实验,如在牛奶[14]、动物组织[15]中人工添加新霉素后再测定回收率。总体来说,要得到一个成熟稳定的检测体系,在抗体、基质等方面还有许多的工作要做。
[1] 张彦明, 佘锐萍. 动物性食品卫生学[M]. 3版. 北京: 中国农业出版社, 2002: 73-86.
[2] 赵红梅, 金升藻. 滥用抗生素对人畜的危害及对策研究[J]. 国外医药: 抗生素分册, 2003, 24(4): 164-167.
[3] 农业部第235号公告. 动物性食品中兽药最高残留限量[S]. 2002.
[4] 刘沙洲, 黄非, 王丽丽, 等. 新霉素酶联免疫检测方法的研究: 新霉素抗体的制备[J]. 食品科技, 2007(3): 208-211.
[5] 石德时, 王桂枝, 毕丁仁, 等. 氯霉素抗体的制备[J]. 华中农业大学学报, 2001, 20(5): 463-465.
[6] LOOMANS E E, Van WILTENBURG J, KOETS M, et al. Neomin as an immunogen for the development of a generic ELISA detecting gentamicin, kanamycin, and neomycin in milk[J]. Journal of agricultural and food chemistry, 2003, 51(3): 587-593.
[7] STOLKER A A, BRINKMAN U A. Analytical strategies for residue analysis of veterinary drugs and growth-promoting agents in food-producing animals: a review[J]. Journal of Chromatography A, 2005, 1067(1/2): 15-33.
[8] 葛红霞. 单克隆抗体技术及其应用[J]. 畜牧兽医科技信息, 2007(3):9-10.
[9] 谭雅丽, 石德时, 王桂枝, 等. 抗氯霉素单克隆抗体的制备及鉴定[J].中国预防兽医学报, 2000(增刊1): 63-65.
[10] 魏书林, 曹振, 沈建忠, 等. 抗氯霉素单克隆抗体的制备和鉴定[J].中国兽医杂志, 2004, 40(8): 62-64.
[11] 王选年, 杨艳艳, 李青梅, 等. 盐酸克伦特罗单克隆抗体的制备及其特性[J]. 河南农业科学, 2002(6): 30-33.
[12] 蔡勤仁, 曾振灵, 杨桂香. 恩诺沙星单克隆抗体的制备及鉴定[J]. 中国农业科学, 2004, 37(7): 1060-1064.
[13] 许艇, 秦治翔, 王文珺, 等. 甲萘威ELISA方法的建立及初步应用[J]. 应用与环境生物学报, 2004, 10(5): 569-572.
[14] 李利东, 宓晓黎, 袁建兴, 等. 酶联免疫检测试剂盒应用于牛奶中四环素残留的测定[J]. 乳业科学与技术, 2004(2): 52-54.
[15] 关嵘. 应用酶联免疫技术检测动物源性食品中氯霉素残留的研究[J].检验检疫科学, 2002, 12(4): 5-10.
Development of Enzyme-linked Immunosorbent Assay for Neomycin
LIU Sha-zhou1,2,SANG Xiao-xue1,OUYANG Hua-xue3,LEI Shao-rong3,BAI Lin-han1,*
(1. School of Life Sciences, Sichuan University, Chengdu 610065, China;2. Food and Drug Testing Center, Chengdu 610045,China;3. Analysis and Testing Center, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China)
In this study, we describe the advantages and disadvantages of direct competitive enzyme-linked immunosorbent assay (dc-ELISA) and indirect competitive ELISA (idc-ELISA) and ELISA methods for the detection of neomycin. Antineomycin polyclonal antibodies were prepared and used to detect neomycin by dc-ELISA and idc-ELISA. The cross-reaction rates of prepared anti-neomycin polyclonal antibodies with gentamincin and kanamycin were 2.04% and 0.02%, respectively,and with ampicillin, erythromycin and tetracycline all less than 0.01%. The accuracy and recovery of idc-ELISA were tested with an intra-plate error of less than 4%, an inter-plate error of less than 11% and a recovery between 135.5% and 191.3%. The detection limits of dc-ELISA and idc-ELISA were 28.58 ng/mL and 51.74 ng/mL, respectively, both of which were below the national maximum residue limit (MRL) of 500μg/kg. Therefore, a dc-ELISA method and an idc-ELISA method to detect neomycin have successfully established. Further, the idc-ELISA method where the working conditions were better optimized can be used for the development of neomycin test kit.
neomycin;polyclonal antibodies;competitive enzyme-linked immunosorbent assay (ELISA);method establishment
S854
A
1002-6630(2011)14-0227-05
2010-04-26
四川省公益性研究计划项目(2008NG004)
刘沙洲(1983—),女,硕士,主要从事微生物学与生物检测研究。E-mail:liushazhou566@sina.com
*通信作者:白林含(1970—),女,教授,博士,主要从事微生物分子生物学研究。E-mail:bailinhan@scu.edu.cn
