球等鞭金藻多糖的微波萃取工艺
2011-10-27郭赣林徐深圳李文浩孙颖颖王长海
郭赣林,徐深圳,李文浩,孙颖颖,*,王长海
(1.淮海工学院 江苏省海洋生物技术重点实验室,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港222005;3.南京农业大学资源与环境科学学院,江苏 南京 210095)
球等鞭金藻多糖的微波萃取工艺
郭赣林1,2,徐深圳1,李文浩1,孙颖颖1,2,*,王长海3
(1.淮海工学院 江苏省海洋生物技术重点实验室,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港222005;3.南京农业大学资源与环境科学学院,江苏 南京 210095)
采用微波法,通过单因素试验研究pH值、微波功率、萃取温度和萃取时间对球等鞭金藻多糖提取的影响。在此基础上,通过正交试验进一步优化多糖的微波提取工艺。最后,比较微波提取法和热水浸提法制备的球等鞭金藻多糖样品的红外光谱,并测定样品中蛋白质和多糖含量。单因素试验结果表明,pH值、微波功率、萃取温度和萃取时间均能显著影响球等鞭金藻多糖的提取。正交试验结果表明,微波法提取球等鞭金藻多糖的最佳工艺为pH9、微波功率600W、萃取温度90℃、萃取时间20min。微波提取法和热水浸提法制备的多糖产率分别为96.8mg/g和47.7mg/g。其中,前者蛋白质和多糖含量分别为1.08%和43.6%,后者中蛋白质和多糖含量依次为1.18%和22.1%。微波法与热水浸提法制备的多糖具有相似的红外光谱,表明微波提取法并不会破坏多糖结构。综上所述,在球等鞭金藻多糖提取过程中,微波法明显优于热水浸提法。
球等鞭金藻;多糖;微波提取法;热水浸提法;红外光谱
海洋微藻多糖是海洋微藻的生物活性物质之一,海洋微藻的生长条件和环境特点决定了其具有一些有别于陆生植物多糖的结构和功能。因此,加快海洋微藻多糖的开发可以弥补陆地植物多糖及海藻多糖药用特性的不足。然而,相对于陆地植物和海藻而言,海洋微藻多糖的报道较少,且主要集中在螺旋藻(Spirulinasp.)[1-4]、紫球藻(Porphyridium cruentum)[5-7]、小球藻(Chlorellasp.)[8-10]和盐藻(Dunaliella salina)[11]等微藻的抗肿瘤、抗病毒、抗辐射和提高免疫力等活性研究方面,而较少报道海洋微藻多糖的提取工艺[7,12-14]。
微波辅助提取(microwave assisted extraction,MAE)是利用微波能的加热效应来加速溶剂对固体样品中目标化合物提取的新技术。研究显示,这种方法与传统热水浸提方法相比具有节能、提取效率高等优点。刘四光等[15]采用MA E法进行了自养小球藻(Chlor ella autotrophica)多糖的提取研究,发现在一定实验条件下,与传统热水浸提法相比微波提取法并不会破坏自养小球藻多糖结构,且在多糖产率上要优于热水浸提法。在微波辅助提取海水小球藻多糖研究中,邓永智发现时间和温度对多糖的提取率有较大的影响[16]。
球等鞭金藻(Isochrysis galbana)是水产养殖业常用的饵料微藻[5]。通过前期工作,笔者发现此微藻细胞内含有较高含量的多糖[17];采用热水浸提法(hot water immersed,HWI)获得了其多糖的适合提取工艺:pH8、温度70℃、时间180min、液料比15:1(mL/g)[18]。为寻求快速、节能、高效的提取工艺,在上述实验基础上,本实验采用MAE法提取多糖,通过一系列单因素和正交试验,分析pH值、微波功率、温度以及时间等因素对多糖提取的影响,同时,比较MAE法和HWI法提取的多糖的红外光谱图,以确保在不影响多糖化学结构的前提下获得适合于球等鞭金藻多糖的微波提取工艺。
1 材料与方法
1.1 材料与仪器
球等鞭金藻由中国海洋大学提供,置于40L光照平板生物反应器中通气培养,通气量2.0L/min,温度(23±2)℃,光照强度3000 lx,接种密度40×104/mL,f/2培养基[19]。培养10d后,5000×g离心15min,收集藻细胞,采用冷冻干燥法制备成藻粉。
LXJ-IIB型低速大容量多管离心机 上海安亭科学仪器厂;LG-5型真空冷冻干燥机 上海市离心机械研究所;UV-1800型紫外/可见分光光度计 北京瑞丽分析仪器公司;XH-100型微波合成萃取仪 北京祥鹄科技公司。
1.2 单因素试验
准确称取0.4g球等鞭金藻粉,以蒸馏水为提取溶剂,设定液料比15:1(mL/g)为,分别改变pH值、微波功率、温度和时间等因素,分析它们对球等鞭金藻多糖提取的影响,每个设定3个重复。按照上述试验验设计提取后,过滤,上清液采用3% TCA除蛋白(4℃静置4 h)。随后,经3倍体积乙醇沉淀,静置过夜后,于5000×g离心10min,沉淀用无水乙醇洗涤,称量后获得粗多糖的质量。
1.2.1 pH值对球等鞭金藻多糖提取的影响
设定温度70℃、时间30min、微波功率600W,pH值分别为6、7、8、9、1 0、1 1。
1.2.2 微波功率对球等鞭金藻多糖提取的影响
设定pH8、温度70℃、时间30min,微波功率依次为300、400、500、600、700、800W。
1.2.3 萃取温度对球等鞭金藻多糖提取的影响
设定pH8、时间30min、微波功率600W,温度分别为40、5 0、6 0、7 0、80、9 0℃。
1.2.4 萃取时间对球等鞭金藻多糖提取的影响
设定pH8、温度70℃、微波功率600W,时间依次为5、10、20、30、40、50min。
1.3 正交试验
在单因素试验基础上,采用L9(34)正交试验进一步分析pH值、微波功率、温度和时间对球等鞭金藻多糖提取的影响,优化多糖的微波提取工艺。最后,用蒽酮比色法[20]测定粗多糖中总糖含量,通过计算获得粗多糖样品中蛋白质和多糖含量。
1.4 红外光谱测定
采用热水浸提法制备球等鞭金藻多糖样品,工艺条件为pH8、温度70℃、时间180min、液料比15:1。同时,采用球等鞭金藻多糖的优化微波提取工艺制备多糖样品。采用红外光谱仪,样品以KBr压片,在4000~600cm-1区间扫描。
1.5 粗多糖的提取率和产率

1.6 数据处理
试验数据采用SPSS 11.5软件包进行独立样本检验统计分析,以P<0.05为显著性差异。
2 结果与分析
2.1 单因素试验
2.1.1 pH值对球等鞭金藻多糖提取的影响
从图1可以看出,碱性pH值更利于球等鞭金藻多糖的提取。pH值从6增加到10过程中,多糖提取率随pH值的增大而增加。在70℃、时间30min,微波功率600W条件下,于pH10时多糖提取率达到最大值,其数值显著(P<0.05)高于pH6时的提取率,为pH6时提取率的4.2倍。当pH值继续增大为11时,多糖提取率开始显著(P<0.05)下降,但仍高于pH6时的提取率。
上述结果表明,pH10条件下多糖提取率高于pH6~9条件下多糖提取率。这可能是因为微藻多糖中有一部分酸性多糖,它们会随着提取液碱性的增强而更易被溶出;并且,多糖与蛋白质等物质之间可能会以非共价键形态结合在一起,在碱性条件下,蛋白质等易被溶解,从而将多糖释放出来[7,12,14]。然而,pH值也不能过高,这是因为在热碱环境下有一部分多糖可能被降解,从而导致多糖提取率的下降。在自养小球藻多糖微波提取法研究中,刘四光等[15]认为pH值对自养小球藻多糖提取率的影响主要是由于粗多糖上具有的官能团而造成的,也即粗多糖具有的-O-SO3H、-NH2、-CHO和-OH等官能团可能受质子官能团的影响从而影响粗多糖在不同pH值提取溶液中的亲水性。
2.1.2 微波功率对球等鞭金藻多糖提取的影响

图2 微波功率对球等鞭金藻多糖提取率的影响Fig.2 Effect of microwave power on extraction rate of polysaccharides from I. galbana
图2表明,在微波功率300~600W范围内,多糖提取率随微波功率的增加而明显增大(P<0.05),在600W时,多糖提取率最大,其值为300W多糖提取率的3倍。当微波功率增至800W时,多糖提取率有所下降,但仍然显著高于微波功率为300W时的多糖提取率(P<0.05)。微波功率300~500W条件下多糖提取率较低的原因可能是由于在功率较低的情况下升温速度较慢,或温度未能达到设定值从而导致多糖提取率较低。而当微波功率高于700W时,较高的功率可能导致多糖降解从而多糖提取率下降。
2.1.3 萃取温度对球等鞭金藻多糖提取的影响

图3 萃取温度对球等鞭金藻多糖提取率的影响Fig.3 Effect of extraction temperature on extraction rate of polysaccharides from I. Galbana
由图3可见,在试验设定的温度范围内,多糖提取率随萃取温度的升高而显著(P<0.05)增大,在90℃时多糖提取率达到最大值,提取率为32%,其值为40℃时提取率的2.3倍。这表明,高温条件更利于多糖的提取。
刘四光等[15]采用微波法提取自养小球藻多糖,发现在70~90℃温度范围内多糖提取率随温度升高增加的幅度变小,故将自养小球藻多糖的提取温度选定为70℃。本试验发现球等鞭金藻多糖提取率随温度升高而明显(P<0.05)增大,90℃时提取率为70℃时提取率的1.3倍,因此,将微波法提取球等鞭金藻多糖的温度选定为90℃。这可能是由于微藻种类不同,从而微藻多糖的微波提取温度不同。在热水浸提法提取多糖研究中,孙颖颖等[18]发现球等鞭金藻多糖的适宜提取温度为70℃,当温度超过70℃时多糖提取率开始下降。王长海[9]、郑维发等[20]认为高温条件下微藻多糖容易降解。本试验中球等鞭金藻多糖的适宜提取温度(为90℃)高于70℃,然而,多糖提取率并未下降,这主要是由多糖的提取方法不同而造成。前者研究采用热水浸提法、时间4h、pH10,长时间处于碱性高温条件下,多糖出现明显降解趋势;本试验采用微波提取法、时间30min、pH8,90℃时多糖还未出现降解或明显降解现象,故此多糖提取率仍然较高。由于提取温度直接影响多糖结构,过高温度将会破坏多糖的结构,因此本试验并未将温度设定过高。
2.1.4 萃取时间对球等鞭金藻多糖提取的影响
时间在5~30min范围内,多糖提取率随萃取时间延长而明显(P<0.05)增大,在30min提取率最大。当萃取时间继续延长时,多糖提取率开始下降,但仍然显著高于5~20min范围内的多糖提取率(图4)。结果表明,在微波浸提法中,延长提取时间,有利于球等鞭金藻多糖的充分溶出,从而在一定时间范围内多糖提取率随时间的增加而增大。然而,萃取时间过长可能会引起多糖降解,致使多糖提取率有所下降[7,14]。
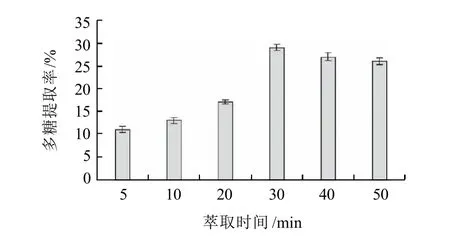
图4 萃取时间对球等鞭金藻多糖萃取率的影响Fig.4 Effect of extraction time on extraction rate of polysaccharides from I. galbana
2.2 正交试验
在单因素试验基础上,采用L9(34)正交试验设计,优化球等鞭金藻多糖的微波提取工艺,试验设计和结果分析见表1、2。

表1 多糖萃取正交试验设计及结果Table 1 Orthogonal array design and corresponding results

表2 正交试验结果方差分析表Table 2 Variance analysis for orthogonal array experimental results
通过直观分析和方差分析可知,pH值、微波功率、萃取温度和萃取时间对多糖提取率的影响顺序为pH值(微波功率)>萃取温度>萃取时间。同时,获得多糖提取的最佳条件为pH9、微波功率600W、萃取温度90℃和萃取时间20min,但正交表中未见此试验组合,因此,采用追加实验进行验证。结果表明,多糖适宜的微波萃取工艺为pH9、微波功率600W、萃取温度90℃和萃取时间20min。
2.3 球等鞭金藻多糖样品的测定
采用热水浸提法和微波提取法制备多糖样品,并测定样品中蛋白质和多糖含量。结果表明,前者制备的粗多糖产率为47.7mg/g,样品中蛋白质和多糖含量分别为1.18%和22.1%;后者制备的粗多糖产率为96.8mg/g,样品中蛋白质和多糖含量依次为1.08%和43.6%。

图5 微波提取法(a)与传统热水浸提法(b)所得粗多糖的红外光谱的比较Fig.5 IR spectra of crude polysaccharides extracted by microwaveassisted (a) and hot-water immersion methods (b)
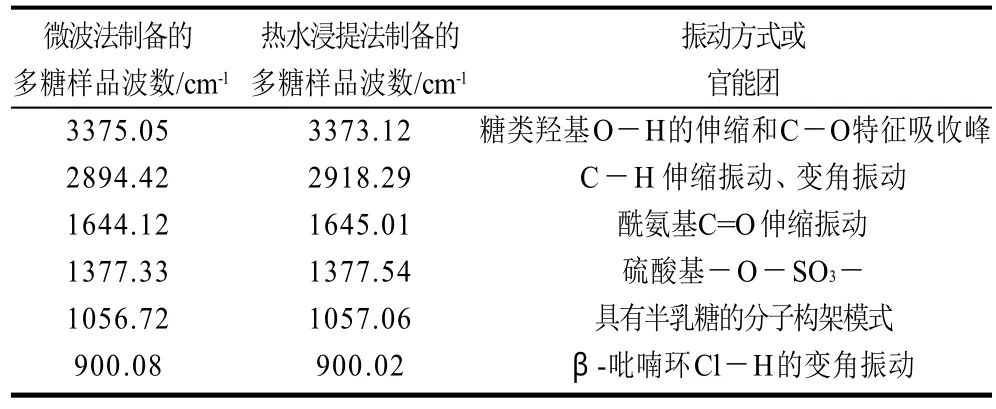
表3 微波提取法与传统热水浸提法制备的粗多糖的红外光谱对比Table 3 IR spectral data of crude polysaccharides extracted by microwave-assisted and hot-water immersion methods
从图5和表3可看出,两种提取方法所得粗多糖的红外光谱具有比较相似的特征。其中,在3700~3100cm-1和1075~1010cm-1两处为糖类羟基O-H和C-O的特征吸收峰;在3000~2800cm-1和1550~1200cm-1的吸收峰为C-H的伸缩振动和变角振动;1700~1500cm-1附近的吸收峰为酰氨基C=O的伸缩振动,表明两种多糖中均含有酰氨取代基。另外,在1377cm-1附近有较强的吸收峰,表明两种粗多糖都含有硫酸取代基;在1057cm-1附近吸收峰表明,所得多糖是一种以半乳糖为构架的分子模式[21]。在糖类的环振动吸收区930~700cm-1,两种糖在900.08cm-1和900.16cm-1附近的吸收峰是β-吡喃环Cl-H的变角振动。由此可见,微波提取法在一定的条件下不会对所得多糖化学结构产生影响。
3 结 论
单因素试验结果表明,pH值、微波功率、温度和时间等因素均能显著影响球等鞭金藻多糖的提取。在此基础上,通过正交试验进一步确定最佳工艺条件为pH 9、微波功率600 W、萃取温度90℃、萃取时间20min,采用此提取工艺制备的粗多糖样品的蛋白质和多糖含量分别为1.08%和43.6%。热水浸提法制备的粗多糖样品中蛋白质和多糖含量依次为1.18%和22.1%。并且,微波法和热水浸提法制备的粗多糖产率分别为96.8mg/g和47.7mg/g。两种提取方法所得多糖在结构上比较相似,含有酰氨基和硫酸基等官能团,两者多糖糖链中存在β-吡喃环结构,且都含有以半乳糖为构架的分子模式。这表明微波提取法在一定的条件下不会对所得多糖化学结构产生影响。综上所述,在球等鞭金藻多糖提取过程中,微波法明显优于热水浸提法。
[1] HAYSAHI K, HAYSAHI T, KOJIMA I. A natural sulfated polysaccharide,calium spirulan, isolation fromSpirulina platensis:in vitroandin vivoevaluation of anti-herps simp lex virus and anti-human immunodeficiency virus activities[J]. AIDS Res Hum Retr, 1996, 12(15): 1463-1471.
[2] HAYSAHI T, HAYSAHI K. CalciumSpirulina, an inhibitor of enveloped virus replication, from a blue-green algaSpirulina[J]. Natural Product, 1996, 59(1): 83-87.
[3] TANG Mei, GUO Baojiang. Advanced development of scientific research onSpirulina: Effects ofSpirulinaon the virus, cancer and immune system[J]. 华南师范大学学报: 自然科学版, 1998(1): 26-32.
[4] 吴洁, 张成武, 刘义峰, 等. 极大螺旋藻胞外多糖EPⅡ的分离、纯化及免疫学研究[J]. 药物生物技术, 1999, 6(2): 99-102.
[5] 陈峰, 姜悦. 微藻生物技术[M]. 北京: 中国轻工业出版社, 1999: 240-272.
[6] 丁新, 李玲风. 关于盐藻多糖的研究[J]. 海湖盐与化工, 2000, 24(6):4-6.
[7] 徐锡莲, 童微星, 雷引林, 等. 盐藻胞外多糖分离纯化方法研究[J].食品与生物技术学报, 2007, 26(4): 28-33.
[8] MINKOVA K, ICHAILOV Y, TONCHEVA P T, et al. Antiviral activity ofPorphyridium cruentumpolysaccharide[J]. Pharmazie, 1996, 51(3):194-199.
[9] 王长海, 温少红, 鞠宝. 紫球藻多糖的提取和测定[J]. 中国海洋药物,1999, 18(1): 22-25.
[10] 顾宁琰, 刘宇峰. 紫球藻胞外多糖抗辐射的生物学活性研究[J]. 海洋科学, 2002, 26(12): 53-56.
[11] 李亚清, 杨海波, 刘艳, 等. 小球藻多糖的分离纯化和组成分析[J].大连水产学院学报, 2006, 21(3): 294-296.
[12] 张新宇, 王雷, 李光友, 等. 绿色巴夫藻硒多糖的提取、分离与纯化[J]. 海洋与湖沼, 2000, 31(6): 643-646.
[13] 刘艳, 杨海波, 赵莲华, 等. 扁藻多糖的分离分析及其生物活性的初步研究[J]. 生物技术, 2007, 17(2): 53-56.
[14] 戴军, 尹鸿萍, 汤坚. 杜氏盐藻多糖提取工艺的优化[J]. 食品与发酵工业, 2007, 3(3): 123-127.
[15] 刘四光, 李文权, 邓永智. 海洋微藻多糖微波提取法研究[J]. 海洋通报, 2007, 26(4): 105-110.
[16] 邓永智, 李文权, 袁东星. 海水小球藻中多糖的提取及其单糖组成的气相色谱-质谱分析[J]. 分析化学, 2006, 34(12): 1697-1701.
[17] 浦寅芳, 孙颖颖, 严军威, 等. 不同环境因子对球等鞭金藻胞内和胞外多糖合成的影响[J]. 淮海工学院学报, 2008, 17(4): 61-64.
[18] 孙颖颖, 雷琪瑶, 刘筱潇, 等. 球等鞭金藻胞内和胞外多糖的提取工艺[J]. 食品科学, 2010, 31(6): 55-59.
[19] GUILLARD R R L, RYTHER J H. Studies of marine planktonic diatom.Ⅰ.Cyclotella nanaH. andDetonula confervacea(Cleve) Gran[J]. Can J M, 1962, 17(8): 309-314.
[20] 郑维发, 陈才法, 鲍康德, 等. 新月菱形藻胞外多糖的成分及其硫酸酯的制备[J]. 中草药, 2005, 36(12): 1790-1793.
[21] MELO M R S, FEITOSA J P A, FREITAS A L P, et al. Isolation and characterization of soluble sulfated polysaccharide from the red seaweedGracilaria cornea[J]. Carbohydrate Polymers, 2002, 49(4): 491-498.
Optimization of Microwave-assisted Extraction of Polysaccharides fromIsochrysis galbana
GUO Gan-lin1,2,XU Shen-zhen1,LI Wen-hao1,SUN Ying-ying1,2,*,WANG Chang-hai3
(1. Jiangsu Key Laboratory of Marine Biotechnology, Huaihai Institute of Technology, Lianyungang 222005, China;2. Jiangsu Marine Resources Develepment Research Insititute, Lianyungang 222005, China;3. College of Resources and Environmental Science, Nanjing Agricultural University, Nanjing 210095, China)
One-factor-at-a-time method and orthogonal array design were employed to optimize four process conditions for microwave-assisted extraction of polysaccharides fromIsochrysis galbanasuch as pH, microwave power, temperature and extraction time. One-factor-at-a-time experiments showed that each of the four conditions had a marked effect on polysaccharide extraction, and their optimal levels were identified by orthogonal array design to be: pH 9, microwave power of 600 W, extraction temperature of 90 ℃ and extraction time of 20 min. Under these conditions, the extraction rate of crude polysaccharides was 96.8 mg/g compared with 47.7 mg/g for hot water extraction, and the contents of protein and polysaccharides were respectively 1.08% and 43.6% in the crude polysaccharide sample obtained compared with 1.18% and 22.1% for hot water extraction. The crude polysaccharides obtained by both extraction methods revealed similar IR spectra, demonstrating that microwave did not destroy the chemical structures of polysaccharides. In summary, microwave-assisted extraction is greatly superior to hot water extraction.
Isochrysis galbana;polysaccharide;microwave-assisted extraction;hot water immersion extraction;IR spectrum
Q946.3
A
1002-6630(2011)14-0113-05
2010-09-17
江苏省海洋资源开发研究院开放课题(JSIMR09D08)
郭赣林(1977—),女,讲师,博士,研究方向为海洋生态学。E-mail:guoganlin@163.com
*通信作者:孙颖颖(1978—),女,讲师,博士,研究方向为海洋生化工程。E-mail:syy-999@163.com
