益生酪酸菌的固态培养
2011-10-27魏伟群唐楚颖
魏伟群,沈 娟,唐楚颖,陆 豫,余 勃,*
(1.南昌大学环境与化学工程学院,江西 南昌 330031;2.江苏省农产品质量检验测试中心,江苏 南京 210036;3.南昌大学中德联合研究院,南昌市生物化工重点实验室,江西 南昌 330047)
益生酪酸菌的固态培养
魏伟群1,沈 娟2,唐楚颖1,陆 豫3,余 勃3,*
(1.南昌大学环境与化学工程学院,江西 南昌 330031;2.江苏省农产品质量检验测试中心,江苏 南京 210036;3.南昌大学中德联合研究院,南昌市生物化工重点实验室,江西 南昌 330047)
以活菌数为考察指标,研究酪酸菌在3种不同固态基质(豆粕、麸皮、玉米粉)中的生长情况。结果显示:豆粕作为基质时酪酸菌生长最佳,最高活菌数可达47×106CFU/g,麸皮次之,达39×106CFU/g,玉米粉最差,仅为34×106CFU/g。在此基础上,采用响应面法对酪酸菌固态发酵的培养基及发酵工艺进行优化。首先通过Plackett-Burman试验对酪酸菌培养基成分进行筛选,从10个因素中筛选到了4个主要影响因素,即硫酸铵、麦芽糖、硫酸镁和含水量。然后采用Box-Behnken试验设计得出硫酸铵、麦芽糖、硫酸镁的添加量分别为1.5%、0.8%、0.02%,含水量为55%时培养效果最佳,酪酸菌活菌数最高可达到约76×106CFU/g。同样采用Box-Behnken试验设计对影响酪酸菌固体发酵的工艺条件进行优化,当发酵时间为24h、温度30℃、接种量14mL/100g时,酪酸菌培养效果最佳,活菌数达到约11×107CFU/g。
酪酸菌;固态发酵;响应面法
益生菌(probiotics)是指改善宿主微生态平衡而发挥有益作用,达到提高宿主健康水平和健康状态的活菌制剂及其代谢产物[1]。动物和人体内有益的微生物主要有:乳酸菌、芽孢杆菌、酵母菌等[2]。其中,作为益生菌的一种,酪酸菌在临床和保健方面的显著功效使其成为益生菌研究中的热点之一。
酪酸菌又名丁酸梭菌(Clostridium butyricum),是一种厌氧的革兰氏阳性芽孢杆菌,广泛存在于人和动物体的肠道中,能有效抑制肠道致病菌的繁殖[3],调整肠道微生态平衡,同时也减少氨类、胺类等有害物质的产生。此外酪酸菌还具有增强免疫、预防肿瘤发生、产生人体必需维生素等重要功能[4-6],其在临床、保健、和营养食品方面的应用都已非常广泛。
虽然目前对酪酸菌在作用机制、培养条件和应用等方面的研究已非常广泛,但常规培养用的几乎都是液体培养法[7]。而与液态培养相比较,固态培养具有成本低、设备投资少、操作简便等优点[8-10]。而在本实验中,液体培养其生长量总是很低,由于肠道菌所生存的环境本身为固态或半固态环境,固态环境和液态环境下培养的微生物有许多生物学特性是不同的,因此更有必要对酪酸菌的固态培养进行研究。
鉴于上述原因,本实验拟利用价格低廉的农副产品为原料,研究酪酸菌固态培养的工艺条件。首先对固体培养基进行筛选和优化,在此基础上,对培养条件进行研究,采用响应面分析的方法对工艺进行优化,旨在找出酪酸菌固态培养最佳的工艺参数,建立一种酪酸菌的固态培养方法[11-15]。这种方法的建立,将更加有利于酪酸菌的大规模培养、保藏和运输,还能显著降低酪酸菌制剂的制备成本,为酪酸菌的固态发酵培养和大规模工业化生产提供参考。
1 材料与方法
1.1 菌种与培养基
菌种:酪酸菌(Clostridium butylicum,CICC 20036),购于中国工业微生物菌种保藏中心。
酪酸菌液体种子培养基:各物质按质量分数计为胰蛋白胨2%、牛肉膏1%、酵母膏0.6%、葡萄糖0.4%、磷酸二氢钾0.1%、硫酸镁0.04%、氯化钙0.02%。固体发酵培养基:固体基质豆粕60%,含水量40%,各生长限制因素按试验设计溶解在水里添加到固体培养基中。
1.2 方法
1.2.1 酪酸菌的固体发酵培养
从酪酸菌斜面中挑取一环接种于种子培养液中,静置培养48h后接种到含固体培养基的三角瓶中培养,培养温度35℃,培养时间24h。按体积分数5%接种到固体发酵培养基中,35℃静置培养。以上操作均在无菌操作条件下进行。
1.2.2 活菌数测定
固体发酵培养基中活菌数测定:取发酵好的固体培养基5g,加入装有100mL无菌水的锥形瓶内,150r/min洗脱30min,洗脱后过滤制备得菌悬液,取30mL离心得菌体细胞,再加入无菌水振荡均匀最后定容到10mL,于620nm波长处测OD值,换算成活菌数[16]。本实验条件下最终活菌数计算公式为:y=135.54×106x-9.91×106,其中,y为平均每克豆粕上测定活菌数/(CFU/g),x为测得OD值。
1.3 试验设计
1.3.1 酪酸菌固态培养的生长限制因素筛选试验设计
为考察酪酸菌生长限制因素对酪酸菌固体培养的影响,采用Plackett-Burman试验设计对众多因素进行研究,选取的各因素(变量)见表1。本阶段试验设计、数据分析及模型建立皆由JMP软件(version 4.0.5,SAS Institute Inc.)辅助完成。

表1 培养基Plackett-Burman试验设计因素水平及编码Table 1 Factors, levels and their codes in Plackett-Burman design for optimizing fermentation medium
1.3.2 酪酸菌固态发酵培养基优化试验设计
基于第一阶段试验结果,该阶段采用Box-Behnken试验设计法,对酪酸菌固态培养的重要生长限制因素进行研究和探索,以获得最佳培养基组成。实验辅助软件为Design Expert (version 6.0.5, Stat-Ease Inc., Minneapolis, M N.USA)。同时通过这一软件对回归方程的解析以及响应曲面的分析获得最佳变量水平,试验设计见表2。

表2 培养基Box-Behnken试验设计因素水平及编码Table 2 Factors, levels and their codes in Box-Behnken design for optimizing fermentation medium
1.3.3 发酵条件优化试验设计
根据单因素试验得到的结果,结合相关的文献报道,采用Box-Behnken试验对影响酪酸菌固态发酵的几个重要因素(发酵时间、温度、接种量)进行研究和探索,旨在得到最佳工艺参数,实验辅助软件为Design Expert (version 6.0.5, Stat-Ease Inc., Minneapolis, M N . U S A)。各个因素和水平见表3。
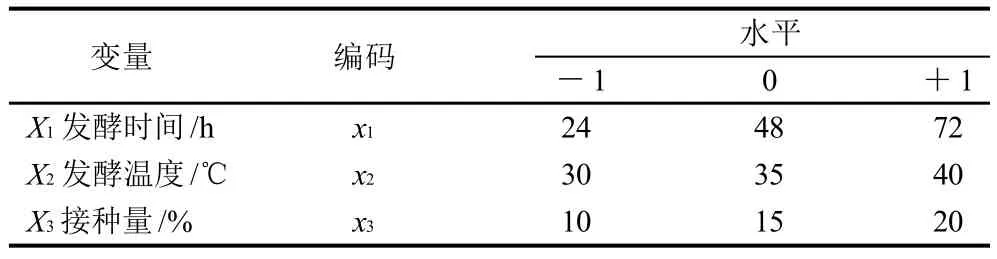
表3 发酵条件Box-Behnken试验因素水平设计及编码Table 3 Factors, levels and their codes in Box-Behnken design for optimizing fermentation conditions
2 结果与分析
2.1 酪酸菌固态培养的生长限制因素Plackett-Burman筛选试验
利用JMP软件对Plackett-Burman试验结果(表4)进行方差分析,得出各因素的t值和可信度水平。选择可信度大于95%以上的因素作为重要因素。

表4 培养基Plackett-Burman试验设计结果及其预测值Table 4 Actual and predicted values of viable cell number in Plackett-Burman design for optimizing fermentation medium
从t检验结果可知,硫酸铵对酪酸菌生长影响最显著(P=0.0099),麦芽糖(P=0.0138),葡萄糖(P=0.0170),硫酸镁(P=0.0395),硫酸亚铁(P=0.0148)和含水量(P=0.0402)在95%的概率水平上差异显著,而其他因素则在95%的概率水平上差异均不显著。硫酸铵、葡萄糖、麦芽糖、硫酸镁和含水量都是正影响,硫酸亚铁是负影响。
酪酸菌是异养型微生物,它们需要糖类、蛋白质、矿物元素等。培养基的组成和配比是否恰当直接影响酪酸菌的生长繁殖。
在培养基组成中,发酵基质豆粕能提供充足的氮源,但由于其大分子质量不能迅速被酪酸菌利用,而无机氮源硫酸铵作为一种速效蛋白能很好的被酪酸菌利用,保证酪酸菌前期的生长,在碳源选择上,葡萄糖和蔗糖也都能被酪酸菌利用,蔗糖的影响效果要更显著,无机盐镁离子和起始含水量对酪酸菌的生长也起着重要作用。本着节约成本的考虑,因此,在下一步优化实验中,将重点考察硫酸铵、麦芽糖、硫酸镁的浓度和含水量范围。
2.2 酪酸菌固态发酵培养基的响应面优化
在对Plackett-Burman试验结果分析的基础上,采用Box-Behnken试验设计对酪酸菌固态培养基中的重要生长限制因素进行了29组试验,结果见表5。

表5 培养基Box-Behnken试验结果Table 5 Actual and predicted values of viable cell number in Box-Behnken design for optimizing fermentation medium
通过Design Expert软件对表5实验数据进行多元回归拟合,获得酪酸菌活菌数(y)对自变量(x1硫酸铵、x2麦芽糖、x3硫酸镁和x4含水量)的二次多项回归方程:

该方程的方差分析表明该模型极显著(P<0.0001),失拟项不显著(P=0.7079>0.1)。预测值与实测值之间具有高度的相关性(R2=0.9610),该模型校正系数(R2Adj= 0.9220)表明模型与实际情况拟合较好。
经过上述优化后,得到酪酸菌固态培养最佳培养基组成为:硫酸铵1.5%、麦芽糖0.8%、硫酸镁0.02%、含水量55%,为验证模型(1)的准确性,采用优化后的培养基进行3批培养发酵验证实验,得到结果分别为76.7×106、75.49×106、75.68×106CFU/g,平均值为75.96×106CFU/g,与预测值75.99×106CFU/g相差0.4%,再次证明了实验值与预测值之间的高度相关性,也说明此预测模型在本实验的研究范围之内是有效的、合理的。同优化前的预实验的发酵工艺相比,酪酸菌活菌数提高了391.33%,说明采用Box-Behnken法确实达到了优化的效果。
2.3 酪酸菌固态发酵条件的响应面优化
采用Box-Behnken试验设计对影响酪酸菌生长的工艺条件关键因素进行了17组试验,结果见表6。

表6 发酵条件Box-Behnken试验设计与结果Table 6 Actual and predicted values of viable cell number in Box-Behnken design for optimizing fermentation conditions
通过Design Expert软件对表6实验数据进行多元回归拟合,获得酪酸菌固态培养活菌数(y)对自变量(x1发酵时间、x2发酵温度、x3接种量)的二次多项回归方程:
y=8.09-0.22x1-0.14x2-0.19x3+1.45x12+0.74x22-0.84x32+0.10x1x2+0.17x2x3(2)
该方程的方差分析表明,该二次多项式模型极显著(P<0.0001),失拟项不显著(P=0.6953>0.1),预测值与实测值之间具有高度的相关性(R2=0.9831)。其校正决定系数(R2Adj=0.9614)表明此模型拟合较好。
经过上述优化后得出酪酸菌固态培养的最佳条件为发酵时间24h、温度30℃、接种量14mL/100g时,酪酸菌活菌数达到最大值10.78×107CFU/g。为了验证这一模型预测的可靠性,对此优化条件进行验证,3批此条件下发酵培养的酪酸菌活菌数分别为:10.79×107、10.68×107、10.96×107CFU/g,平均值为10.81×107CFU/g。实测值与预测值相差1%,再次证明了实验值与预测值之间的高度相关性,也说明此预测模型在本实验的研究范围之内是有效的、合理的。
3 结 论
在微生物发酵优化研究中,响应曲面法已被广泛应用,并被证明是一种良好的优化方法[17]。本研究通过响应曲面法对影响酪酸菌固态发酵培养的培养基组成和工艺条件进行了研究,得出了其最佳培养基为:以豆粕为基质,硫酸铵、麦芽糖、硫酸镁的添加量分别为1.5%、0.8%、0.02%,含水量范围55%;最佳发酵条件为:时间24h、温度30℃、接种量14mL/100g。在此条件下,酪酸菌的生长效果最好,活菌数可达10.81×107CFU/g。该研究思路和优化方法将为酪酸菌的固态发酵培养和大规模工业生产提供有益参考。
[1]张耀相, 李慧敏, 刘园园. 谈几种常用益生菌的功能及机理[J]. 中国动物保健, 2010(9): 45-46; 48.
[2]靳涌涛, 曲河, 陈继军, 等. 我国益生菌的研究及在动物中的应用现状[J]. 畜牧兽医科技信息, 2008(1): 8-9.
[3]谢树贵, 戴青, 赵述淼, 等. 丁酸梭菌对动物致病菌的拮抗作用研究[J]. 湖北农业科学, 2007, 46(3): 424-427.
[4]TAKAHASHI M, TAGUCHI H, YAMAGUCHI H, et al. The effect of probiotic treatment with Clostridium butyricum on enterohemorrhagic Escherichia coli O157:H7 infection in mice[J]. FEMS Immunology and Medical Microbiology, 2004, 41(3): 219-226.
[5]POPOFF M R, JOLIVET-REYNAUD C, CARLIER J P. Cytotoxic activity of Clostridium butyricum supernatants induced by butyrate[J]. FEMS Microbiology Letters, 1987, 43(1): 95-100.
[6]冉雪松, 王振华, 潘康成. 丁酸梭状芽孢杆菌的研究进展[J]. 安徽农学通报, 2007, 13(4): 37-39.
[7]施曼玲, 戴赟, 章玲. 丁酸梭菌培养条件的研究[J]. 杭州师范学院学报: 自然科学版, 2001, 18(4): 38-40.
[8]蔡晶, 王影. 固态发酵豆粕在饲料中的研究应用[J]. 中国新技术产品, 2009(19): 137.
[9]YAMANE Y I, YOSHII M, MIKAMI S, et al. A solid-state culture system using a cellulose carrier containing defined medium as a useful tool for investigating characteristics of koji culture[J]. Journal of Bioscience and Bioengineering, 2000, 89(1): 33-39.
[10]JOHN R P, MADHAVAN-NAMPOOTHIRI K, PANDEY A. Solidstate fermentation for L-lactic acid production from agro wastes using Lactobacillus delbrueckii[J]. Process Biochemistry, 2006, 41(4): 759-763.
[11]刘建峰, 葛向阳, 梁运祥. 响应面法优化豆粕固态发酵工艺的研究[J]. 中国生物工程杂志, 2007, 27(6): 87-91.
[12]王雪奇, 黄俊, 周德庆. 两歧双歧杆菌固态培养的研究[J]. 复旦学报:自然科学版, 2000, 39(3): 323-326.
[13]王天云, 王福源, 毛泽善. 嗜酸乳杆菌固态发酵的初步研究[J]. 生命科学研究, 2002, 6(2): 156-159.
[14]周剑忠, 董明盛, 江汉湖. 嗜热链球菌固态培养的研究[J]. 中国酿造, 2004(4): 13-15.
[15]姚晓红, 汤江武, 吴逸飞, 等. 酵母蛋白饲料固体发酵培养基的筛选研究[J]. 浙江农业科学, 2007(2): 215-218.
[16]吴丽云. 固态发酵生产芽孢杆菌活菌计数方法的改进[J]. 饲料研究, 2005(11): 57-60.
[17]LIN B T, JEAN M D, CHOU J H. Using response surface methodology for optimizing deposited partially stabilized zirconia in plasma spraying [J]. Applied Surface Science, 2007, 253(6): 3254-3262.
Solid-state Cultivation of Clostridium butyricum
WEI Wei-qun1,SHEN Juan2,TANG Chu-ying1,LU Yu3,YU Bo3,*
(1. College of Environmental and Chemical Engineering, Nanchang University, Nanchang 330031, China;
2. Jiangsu Center for Inspection and Testing for Quality of Agricultural Products, Nanjing 210036, China;
3. Institute of Sino-German Joint Research, Nanchang Key Laboratory of Biochemical Engineering, Nanchang University, Nanchang 330047, China)
Response surface methodology (RSM) was used to explore medium composition and solid-state fermentation conditions for Clostridium butyricum. The amount of viable cells was used as the evaluation index. Four factors including (NH4)2SO4, MgSO4, maltose and water content as the major affecting factors of medium composition were screened from 10 factors by Plackett-Burman design. The results showed that the maximum number of viable cells of Clostridium butyricum could reach up to 76× 106CFU/g when the medium was composed of 1.5% (NH4)2SO4, 0.02% MgSO4, 0.8% maltose and 55% water content. Similarly, the fermentation conditions of Clostridium butyricum were optimized by Box-Behnken design combined with RSM. Fermentation time of 24 h, fermentation temperature of 30 ℃ and inoculation amount of 14 mL/100 g were optimum. Under these conditions, the maximum number of viable cells could reach up to 11×107CFU/g.
Clostridium butyricum;solid-state fermentation;response surface methodology
Q939.97
A
1002-6630(2011)07-0251-04
2010-09-20
魏伟群(1984—),男,硕士研究生,研究方向为生物化工。E-mail:qunweiwei@163.com
*通信作者:余勃(1978—),男,副教授,博士,研究方向为微生物发酵。E-mail:yubo131@yahoo.com.cn
