地衣芽孢杆菌产Levan果聚糖发酵条件的优化
2011-10-27卢丽丽
陆 娟,肖 敏*,卢丽丽
(1.山东大学微生物技术国家重点实验室,国家糖工程技术研究中心,山东 济南 250100;2.阜阳师范学院生命科学学院,安徽 阜阳 236041)
地衣芽孢杆菌产Levan果聚糖发酵条件的优化
陆 娟1,2,肖 敏1,*,卢丽丽1
(1.山东大学微生物技术国家重点实验室,国家糖工程技术研究中心,山东 济南 250100;2.阜阳师范学院生命科学学院,安徽 阜阳 236041)
通过单因素试验(培养基用水、碳源、氮源、培养温度和培养基初始pH值)和正交试验对地衣芽孢杆菌(Bacillus licheniformis)8-37-0-1发酵产生Levan果聚糖的培养基组成及培养条件进行优化,采用苯酚-硫酸法测定多糖含量。结果表明:以蔗糖100g/L、牛肉膏1.0g/L、酵母粉0.6g/L、K2HPO4 3.0g/L、KH2PO4 3.0g/L、NaCl 1.0g/L、MgSO4·7H2O 0.2g/L、FeSO4·7H2O 0.001g/L,自来水配制,培养基初始pH5.0,30℃培养8-37-0-1菌株24h,Levan果聚糖产量达到最高值41.7g/L,约是未优化时的5.0倍。
Bacillus licheniformis8-37-0-1;Levan;发酵条件;优化
Levan果聚糖是一类分子中含有大量β-(2,6)糖苷键和少量β-(2,1)果糖苷键的多糖,与分子中主要含有β-(2,1)果糖苷键的菊粉类果聚糖显著不同[1]。Levan果聚糖的分子质量通常在几万到一两百万之间,在食品工业方面,它可作为功能性食品的重要组成部分[2]、低聚果糖生产的原材料以及乳化剂和成膜剂等[3]。在医药方面,Levan果聚糖具有抗肿瘤、免疫调控、抗感染等作用,还可以作为血浆的替代品[3-5]。除此以外,由于具有与透明质酸一样的保湿效果及对人体纤维原细胞和角化细胞相似的增殖作用,Levan果聚糖还可作为化妆品添加剂使用[6]。Levan果聚糖广泛的应用潜力使其生产得到了人们的关注。
L e v a n果聚糖可来源于植物或微生物,小麦(Triticum aestivum)[7]、黑麦草(ryegrass)和鸭茅(cocksfoot)[8]等植物可以产生低分子质量的Levan果聚糖,高分子质量的Levan果聚糖主要由微生物发酵产生。Levan果聚糖的产生菌多为细菌,早在1902年,Smith从桃金娘科的植物属(Eucalyptus stuartina)的含糖分泌物中就发现了可以产Levan果聚糖的微生物,随后发现木醋杆菌(Acetobacter xylinum)[9]、枯草芽孢杆菌(Bacillus subtilis)[10]、产果聚糖微杆菌(Microbacterium laevaniformans)[11]、多黏芽孢杆菌(Bacillus polymyxa)[12]、运动发酵单胞菌(Zymomonas mobilis)[3,13-14]、旧金山乳杆菌(Lactobacillus sanfranciscensis)[15-16]和肠膜状明串珠菌(Leuconostoc mesenteroides)[4,17-18]等细菌都可以产生Levan果聚糖,其产量约在14.4~36g/L之间。目前,国内外尚未见利用地衣芽孢杆菌(Bacillus licheniformis)发酵产生Levan多糖的报道。本研究对地衣芽孢杆菌8-37-0-1产生Levan果聚糖的发酵条件进行优化,以期能大幅度提高该菌株Levan果聚糖的产量。
1 材料与方法
1.1 菌种
地衣芽孢杆菌(Bacillus licheniformis)8-37-0-1为本实验室筛选获得,前期工作中已鉴定该菌产生的多糖为Levan 果聚糖[19]。
1.2 培养基与培养条件
发酵培养基(g/L):牛肉膏1.0、(NH4)2SO40.5、K2HPO42.5、KH2PO42.5、NaCl 1.0、蔗糖30、MgSO4·7H2O 0.2、FeSO4·7H2O 0.001,水 1000mL,pH7.0。115℃灭菌 30min。
菌种经发酵培养基180r/min、30℃摇床培养16h活化后,按体积分数4%的接种量扩大培养60h。1.3 仪器与设备
LC-10A高效液相色谱(配置RID-10A示差检测器)日本岛津公司;Aminex HPX-42C糖分析柱 (300mm×7.8mm) 美国Bio-Rad公司。
1.4 方法
1.4.1 多糖的测定
取发酵液于12000r/min、4℃离心10min,取上清液,加入3倍体积的冷异丙醇,4℃静置过夜,离心弃上清液,沉淀加入少量蒸馏水溶解后定容于100mL容量瓶中,苯酚-硫酸法测Levan果聚糖[20],以葡萄糖为标准绘制标准曲线。
1.4.2 蔗糖及单糖测定
采用高压液相色谱法(HPLC)法测定蔗糖及单糖的含量。发酵上清液稀释成5g/100mL溶液,用0.2μm滤膜过滤后进样,进样量为10μL。流动相为超纯水,流速为0.4mL/min,柱温70℃。分析软件为Class-VP 6.0。
1.4.3 菌体生物量测定
取发酵液适量,采用分光光度法测定OD600nm值。
1.4.4 单因素试验
依次改变发酵培养基水质、碳源、氮源以及培养温度、培养基初始pH值,接种8-37-0-1菌株进行发酵产糖培养,测定生物量和Levan果聚糖产量。
1.4.5 正交试验
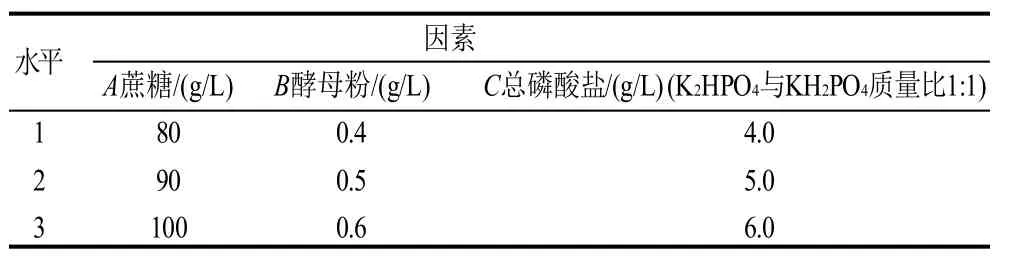
表1 正交试验因素水平设计表Table 1 Factors and their levels in orthogonal array design
选取蔗糖、酵母粉和磷酸盐3个因素,采用4因素3水平的正交表(L9(34))设计试验,优化条件的因素水平见表1。
2 结果与分析
2.1 自来水和蒸馏水对8-37-0-1菌株Levan果聚糖产量的影响
分别用蒸馏水和自来水配制发酵培养基进行发酵产多糖实验。结果表明:用自来水配制的发酵培养基Levan果聚糖产量为9.02g/L,稍高于蒸馏水配制的发酵培养基的产量8.40g/L,所以在后面的实验中都用自来水配制发酵培养基。
2.2 培养基组分及发酵条件对8-37-0-1菌株Levan果聚糖产量的影响
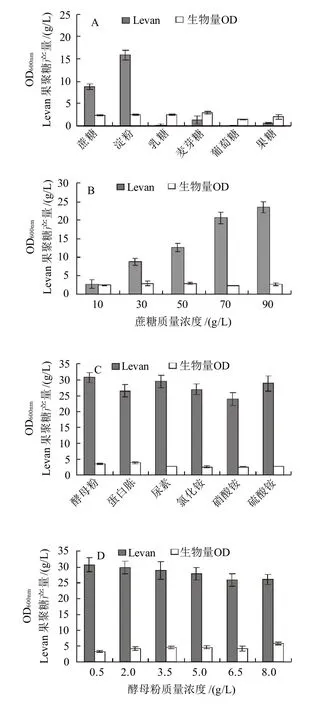

图1 培养基组分和发酵条件对Levan果聚糖产量和生物量的影响Fig.1 Single factor investigation of the effects of medium and fermentation conditions on levan production and Bacillus licheniformis 8-37-0-1 biomass
2.2.1 碳源对8-37-0-1菌株Levan果聚糖产量的影响
分别以30g/L的蔗糖、淀粉、乳糖、麦芽糖、葡萄糖、果糖为唯一碳源配制发酵培养基,接种进行发酵产糖培养。从图1A可以看出,以淀粉为碳源的培养基中多糖最多,蔗糖培养基多糖量次之,为8.86g/L。但考虑到淀粉及其不完全分解产物会影响发酵液中Levan果聚糖产量的测定,并且将会影响Levan果聚糖的后提取,故选用蔗糖为碳源进一步开展研究。
2.2.2 蔗糖质量浓度对8-37-0-1菌株Levan果聚糖产量的影响
分别接种含有不同质量浓度蔗糖(10、30、50、70、90g/L)的发酵培养基进行发酵产糖培养,图1B结果显示,当蔗糖质量浓度在10~90g/L范围内时Levan果聚糖产量随着蔗糖质量浓度的增大而增大,在蔗糖质量浓度90g/L时Levan果聚糖产量达到23.45g/L。
2.2.3 氮源对8-37-0-1菌株Levan果聚糖产量的影响
发酵培养基中,蔗糖为90g/L,牛肉膏含量不变,硫酸铵用同样质量浓度(0.5g/L)的酵母粉、蛋白胨、尿素、氯化铵、硝酸铵替换配制发酵培养基,进行发酵产糖培养,图1C结果表明,同样比例的有机氮替换硫酸铵比无机氮替换更有利于菌体生长,其中酵母粉替换的培养基,Levan果聚糖产量达到最高,为30.78g/L。
2.2.4 酵母粉质量浓度对8-37-0-1菌株Levan果聚糖产量的影响
进一步接种用不同质量浓度酵母粉(0.5、2.0、3.5、5.0、6.5、8.0g/L)替换0.5g/L硫酸铵、90g/L蔗糖的发酵培养基进行发酵产糖培养。图1D结果显示:随着酵母粉质量浓度的增加,菌体生物量不断增加,但多糖产量却在减少,故选用酵母粉质量浓度为0.5g/L,此时Levan果聚糖产量为30.54g/L。
2.2.5 培养温度对8-37-0-1菌株Levan果聚糖产量的影响
以上的实验均是在30℃条件下进行的。为了进一步研究培养温度对产多糖量的影响,接种发酵培养基(90g/L蔗糖、0.5g/L酵母粉替换0.5g/L硫酸铵)后,分别在20、25、30、37℃条件下进行发酵产糖培养。图1E结果表明,20℃菌体生物量较低,25~37℃菌体生物量变化不大,30℃多糖产量最高(30.92g/L)。
2.2.6 培养基初始pH值对8-37-0-1菌株Levan果聚糖产量的影响
分别接种初始pH值分别为4、5、6、7、8、9的发酵培养基(90g/L蔗糖、0.5g/L酵母粉替换0.5g/L硫酸铵)进行发酵产糖培养,结果见图1F。随着pH值的升高,菌体生物量不断升高,但并不利于多糖的产生,pH5.0时Levan果聚糖产量达到最高,为31.29g/L。
2.3 正交试验
蔗糖和酵母粉对Levan果聚糖产量的影响较大(图1),而磷酸盐在菌体的生长和多糖的生物合成中起着非常重要的作用[21],故选取蔗糖、酵母粉和磷酸盐3个因素进行设计正交试验,培养基的其他组分同发酵培养基,pH5.0、30℃培养60h。正交试验结果见表2。

表2 正交试验方案及结果Table 2 Orthogonal array design layout and experimental results
从表2可知,对Levan果聚糖产量培养基组分的影响因子依次排序为A>C>B,即蔗糖>总磷酸盐>酵母粉。正交设计助手Ⅱ v3.1分析得出的方差分析结果显示:蔗糖和总磷酸盐的质量浓度对Levan果聚糖产量的影响起最主要作用,酵母粉质量浓度在此试验范围内的影响最小(表3)。综合考虑各因素对多糖产量的影响,得出最优的组合为A3C3B3,即蔗糖100g/L、总磷酸盐6.0g/L(磷酸氢二钾、磷酸二氢钾各为3.0g/L)、酵母粉0.6g/L。选用最优组合,培养基的其他组分同发酵培养基,pH5.0、30℃培养60h,多糖产量为42.41g/L,显著高于正交试验的其他组合。
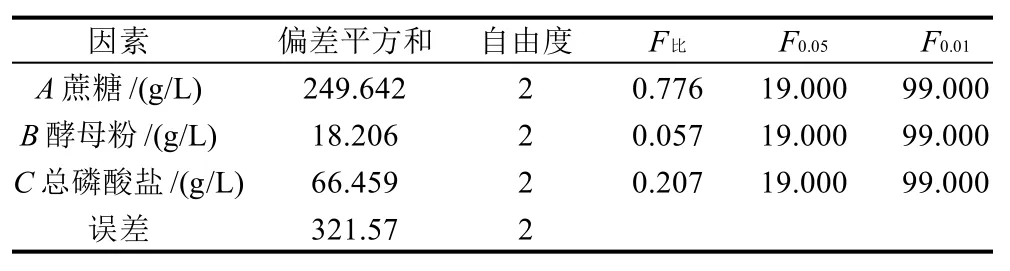
表3 正交试验的方差分析Table 3 Variance analysis for the results from orthogonal array design
2.4 8-37-0-1菌株发酵产糖时间曲线
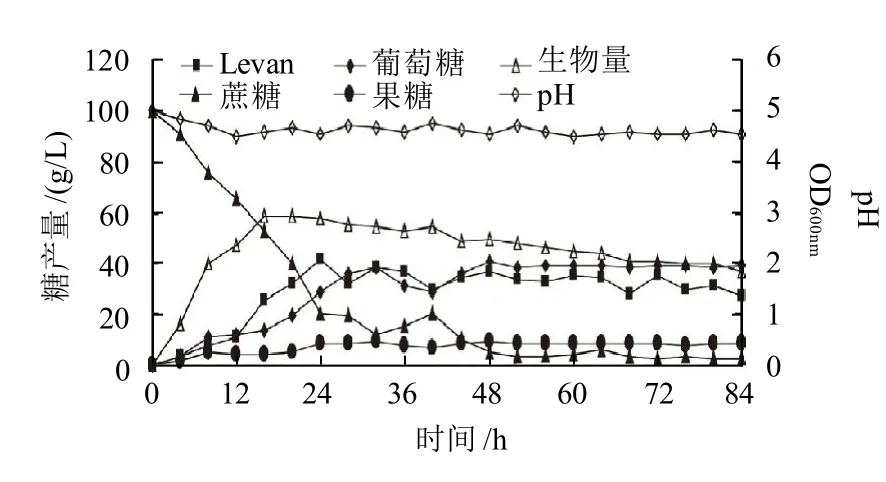
图2 8-37-0-1菌株Levan果聚糖的发酵时间曲线Fig.2 Time course of growth and levan fermentation from Bacillus licheniformis 8-37-0-1
在优化后的发酵培养基及培养条件下测定地衣芽孢杆菌8-37-0-1发酵产生Levan果聚糖的发酵时间曲线,即蔗糖100g/L、磷酸氢二钾3.0g/L、磷酸二氢钾3.0g/L、酵母粉0.6g/L替换硫酸铵,其他成分同发酵培养基,pH5.0,30℃培养。分别在不同的时间取样,测定发酵液中Levan果聚糖、蔗糖、葡萄糖和果糖的含量,以及菌体生物量、pH值的变化情况,结果见图2。在0~24h内蔗糖消耗速度最快,培养至52h时蔗糖几乎全部消耗;而Levan果聚糖含量在24h时达到最高,为41.7g/L,随后呈缓慢下降趋势;在48h时葡萄糖和果糖量都达到最高值,并且葡萄糖显著高于果糖,48h后约是果糖的4倍多,随后都进入稳定期;菌体在16h时就进入了稳定期,28h进入衰亡期;在整个发酵过程中pH值变化不大,波动于4.5~4.7之间。
3 讨 论
本实验对一株产Levan果聚糖的芽孢杆菌B. licheniformis8-37-0-1的发酵条件进行了优化。结果表明:用自来水配制的培养基比用蒸馏水配制的培养基产糖多,这与斯达油脂酵母U9018产胞外多糖[22]的发酵条件一致,可能是自来水中含有一定的各种离子促进Levan果聚糖的合成。在以非多糖为碳源发酵产生Levan果聚糖的实验中蔗糖是最优的碳源,这与运动发酵单胞菌、木醋杆菌等发酵产生Levan果聚糖的情况一致[3,9]。酵母粉质量浓度的优化结果表明,酵母粉质量浓度的增加有利于菌体生长,但不利于Levan果聚糖的产生。蔗糖质量浓度的优化和酵母粉质量浓度的优化结果都证明了高碳氮比例有利于胞外多糖的产生[21],本研究得到的碳氮比例是125:2。微生物不同其Levan产量也不尽相同。多黏芽孢杆菌NRRL-18475接种150g/L蔗糖培养基,30℃、170r/min摇床培养10d,Levan产量为36g/L[12]。运动发酵单胞菌ATCC 31821接种250g/L蔗糖发酵培养基,25℃培养24h,Levan产量为21.685g/L[3]。运动发酵单胞菌B4286变体ZML1和ZML2接种150g/L蔗糖发酵培养基,30℃培养24h,Levan产量分别为21.6、20.0g/L[13]。芽孢杆菌以12g/100mL蔗糖为碳源,其Levan果聚糖产量为28.2g/L[23]。而本研究中,地衣芽孢杆菌8-37-0-1接种100g/L蔗糖、3.0g/L磷酸氢二钾、3.0g/L磷酸二氢钾、0.6g/L酵母粉的发酵培养基,30℃培养24h时,Levan果聚糖产量高达41.7g/L,大约是优化前的5.0倍,显著高于其他菌株的Levan产量。本研究通过发酵条件的优化显著提高了地衣芽孢杆菌8-37-0-1的Levan果聚糖产量,为该菌株的工业开发提供参考。
[1] MONSAN P, BOZONNET S, ALBENNE C, et al. Homopolysaccharides from lactic acid bacteria[J]. International Dairy Journal, 2001, 11(9):675-685.
[2] BEKERS M, LAUKEVICS J, UPITE D, et al. Fructooligosaccharide and levan producing activity ofZymomonas mobilisextracellular levansucrase M[J]. Process Biochemistry, 2002, 38(5): 701-706.
[3] de OLIVEIRA M R, da SILVA R S S F, BUZATO J B, et al. Study of levan production byZymomonas mobilisusing regional low-cost carbohydrate sources[J]. Biochemical Engineering Journal, 2007, 37(2): 177-183.
[4] KANG H K, SEO M Y, SEO E S, et al. Cloning and expression of levansucrase fromLeuconostoc mesenteroidesB-512 FMC inEscherichia coli[J]. Biochim Biophys Acta, 2005, 1727(1): 5-15.
[5] RAIRAKHWADA D, PAL A K, BHATHENA Z P, et al. Dietary microbial levan enhances cellular non-specific immunity and survival of common carp (Cyprinus carpio) juveniles[J]. Fish & Shellfish Immunology,2007, 22(5): 477-486.
[6] KIM K H, CHUNQ C B, KIM Y H, et al. Cosmeceutical properties of levan produced byZymomonas mobilis[J]. International Journal of Cosmetic Science, 2005, 56(6): 395-406.
[7] PRAZNIK W, SPIES T, HOFINGER A. Fructooligosaccharides from the stem ofTriticum aestivum[J]. Carbohydrate Research, 1992, 235(1/2): 231-238.
[8] FEINGOLD D S, GEHATIA M. The structure and property of levan, a polymer ofD-fructose produced by cultures and cell-free extracts ofAerobacter levanicum[J]. Journal of Polymer Science, 1957, 23(104):783-790.
[9] TAJIMA K, UENISHI N, FUJIWARA M, et al. The production of a new water-soluble polysaccharide byAcetobacter xylinumNCI 1005 and its structural analysis by NMR spectroscopy[J]. Carbohydrate Research,1998, 305(1): 117-122.
[10] MENG Guoyu, FTTERER K. Donor substrate recognition in the raffinose-bound E342A mutant of fructosyltransferaseBacillus subtilislevansucrase[J]. BMC Structural Biology, 2008, 8: 16. doi:10.1186/1472-6807-8-16. doi: 10. 1186/1472-6807-8-16.
[11] BAE I Y, OH I K, LEE S, et al. Rheological characterization of levan polysaccharides fromMicrobacterium laevaniformans[J]. International Journal of Biological Macromolecules, 2008, 42(1): 10-13.
[12] HAN Y W, WATSON M A. Production of microbial levan from sucrose,sugarcane juice and beet molasses[J]. Journal of Industrial Microbiology,1992, 9(3/4): 257-260
[13] KRISHNAN ANANTHALAKSHMY V, GUNASEKARAN P. Isolation and characterization of mutants from levan-producingZymomonas mobilis[J]. Journal of Bioscience Bioengineering, 1999, 87(2): 214-217.
[14] CHIANG C J, WANG J Y, CHEN P T, et al. Enhanced levan production using chitin-binding domain fused levansucrase immobilized on chitin beads[J]. Applied Microbiology and Biotechnology, 2009, 82(3):445-451.
[15] TIEKING M, EHRMANN M A, VOGEL R F, et al. Molecular and functional characterization of a levansucrase from sourdough isolateLactobacillus sanfranciscensisTMW 1.392[J]. Applied Microbiology and Biotechnology, 2005, 66(3): 655-663.
[16] KADITZKY S, SEITTER M, HERTEL C, et al. Performance ofLactobacillus sanfranciscensisTMW 1.392 and its levansucrase deletion mutant in wheat dough and comparison of their impact on bread quality[J]. Europe Food Research Technology, 2008, 227(2): 433-442.
[17] OLVERA C, CENTENO-LEIJA S, LOPEZ-MUNGUIA A. Structural and functional features of fructansucrases present inLeuconostoc mesenteroidesATCC 8293[J]. Antonie Van Leeuwenhoek, 2007, 92(1):11-20.
[18] MORALES-ARRIETA S, RODRIGUEZ M E, SEGOVIA L. Identification and functional characterization oflevS, a gene encoding for a levansucrase fromLeuconostoc mesenteroidesNRRL B-512 F[J]. Gene,2006, 376(1): 59-67.
[19] LIU Chunhui, LU Juan, LU Lili, et al. Isolation, structural characterization and immunological activity of an exopolysaccharide produced byBacillus licheniformis8-37-0-1[J]. Bioresource Technology, 2010, 101(14): 5528-5533.
[20] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956, 28(3): 350-356.
[21] IAN W, SUTHERLAND. Microbial polysaccharides from Gram-negative bacteria[J]. International Dairy Journal, 2001, 11(9): 663-674.
[22] 刘月英, 薛雄志, 郑忠辉. 斯达油脂酵母U9018产胞外多糖的适宜条件[J]. 微生物学通报, 1996, 23(5): 268-271.
[23] ELISASHIVILI V I. Levan synthesis by aBacillussp. culture[J]. Prikl Biokhim Microbiology, 1984, 20(1): 101-106.
Optimization of Fermentation Conditions for Production of Levan byBacillus licheniformis8-37-0-1
LU Juan1,2,XIAO Min1,*,LU Li-li1
(1. State Key Laboratory of Microbial Technology and National Glycoengineering Research Center, Shandong University,Jinan 250100, China;2. School of Life Sciences, Fuyang Teachers College, Fuyang 236041, China)
The medium and fermentation conditions for levan production byBacillus licheniformis8-37-0-1 were optimized by single factor and orthogonal array experiments. After culture at 30 ℃ for 24 h in a medium prepared with tap water consisting of sucrose 100 g/L, yeast extract 0.6 g/L, beef extract 1.0 g/L, KH2PO4 3.0 g/L, K2HPO4 3.0 g/L, NaCl 1.0 g/L, MgSO4·7H2O 0.2 g/L and FeSO4·7H2O 0.001 g/L, a maximum levan production of 41.7 g/L was achieved, which was 5.0 times higher than before optimization.
Bacillus licheniformis8-37-0-1;levan;fermentation condition;optimization
TQ920.1
A
1002-6630(2011)07-0183-05
2010-07-11
国家自然科学基金项目(31070064);山东大学自主创新基金项目(2009DX002)
陆娟(1979—),女,硕士,主要从事微生物多糖研究。E-mail:lujuan918@sohu.com
*通信作者:肖敏(1962—),女,教授,博士,主要从事微生物技术研究。E-mail:minxiao@sdu.edu.cn
