莲房原花青素的稳定性及热降解动力学研究
2011-10-27汪志慧孙智达谢笔钧
汪志慧,孙智达*,谢笔钧
(华中农业大学食品科学技术学院,湖北 武汉 430070)
莲房原花青素的稳定性及热降解动力学研究
汪志慧,孙智达*,谢笔钧
(华中农业大学食品科学技术学院,湖北 武汉 430070)
对莲房原花青素(LSPC)的稳定性和热降解动力学进行研究。结果表明:LSPC在低温、避光和弱酸条件下能表现出良好的稳定性;NaCl、蔗糖、葡萄糖等食品原料和防腐剂对LSPC的稳定性影响不明显;H2O2对莲房原花青素破坏作用较大,NaHSO3和VC对其有保护作用;Fe3+、Fe2+、Pb2+和Al3+对LSPC有明显的破坏作用,其他金属离子影响不大;4种不同灭菌方式对LSPC的稳定性有不同程度影响,其中巴氏灭菌的影响较小,高压蒸汽灭菌的影响最大。LSPC的热降解符合动力学一级反应,其反应活化能Ea为43.10kJ/mol,反应常数k0为1.51×105,获得LSPC降解的预测模型。经验证,模型与实测值拟合较好,表明该模型是合理的。
莲房;原花青素;稳定性;降解动力学
莲房是莲科植物莲(Nelumbo nuciferaGaertn.)的成熟花托,又名莲蓬壳(lotus seed pod,LS),具有消瘀、止血、去湿的功效[1]。现已研究发现莲房中含有的主要生理活性物质为原花青素[2-3],原花青素作为黄酮类化合物的一种,具有增强免疫力、保护心血管、预防高血压、抗肿瘤、抗辐射、抗突变及美容等作用[4-7],是至今为止发现的最有效的自由基清除剂之一[8],具有优越的抗氧化活性。
最近几年有人对莲房中原花青素的提取纯化[9]以及莲房中原花青素的清除自由基能力[10]进行了研究,关于其稳定性却未见报道。本实验研究光、热、p H值、金属离子、氧化剂、还原剂、糖、食盐、防腐剂等因素对莲房原花青素的影响,并通过研究莲房原花青素的热稳定性,推导其热降解动力学方程,建立莲房原花青素在加热过程中的热降解动力学模型,为莲房原花青素在食品中的有效应用提供参考。
1 材料与方法
1.1 材料与试剂
莲房采自武汉市汤逊湖,品种为武植2号。
葡萄籽原花青素标准品(纯度为95%) 天津市尖峰天然产物研究开发有限公司;AB-8大孔吸附树脂 南开大学化工厂;正丁醇、盐酸、甲醇、乙醇、柠檬酸、磷酸氢二钠、V C、氯化锌、氯化铜、氯化镁、氯化铝、醋酸铅、氯化亚铁、氯化铁、苯甲酸钠、山梨酸钾、30%过氧化氢、亚硫酸氢钠等均为分析纯试剂。
1.2 仪器与设备
FuheHH-4数显恒温水浴锅 金坛市富华仪器有限公司;RE-111型旋转蒸发仪 瑞士Buchi公司;SH2-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;UV-9100紫外-可见分光光度计 北京瑞利公司;电子天平 德国Sartorius公司。
1.3 方法
1.3.1 莲房原花青素的制备
新鲜莲房经粉碎后,称取2000g(鲜质量),按照1:10(m/V)的料液比加入体积分数为70%的乙醇,在55℃浸提120min,抽滤得滤液,滤液在50℃条件下用旋转蒸发器减压回收乙醇,然后将浓缩液过AB-8大孔树脂,用10倍量蒸馏水洗去不被吸附的杂质,再用50%的乙醇洗脱,收集洗脱液,50℃减压浓缩,真空冷冻干燥,得莲房原花青素精制物粉末。
1.3.2 原花青素含量的测定及保存率的计算
以葡萄籽原花青素为标准品,分别配制质量浓度为0.01、0.05、0.1、 0.15、 0.2、0.25mg/mL的标准溶液,采用盐酸-正丁醇法[11],作标准曲线并计算回归方程为Y=3.574X+0.1141(R2=0.9993)。
用上述方法分别测定莲房原花青素处理前和经各种处理后的质量浓度,按公式(1)计算莲房原花青素的保存率。

式中:ρ0为处理前原花青素质量浓度/(mg/mL);ρ1为处理后原花青素质量浓度/(mg/mL)。
1.3.3 莲房原花青素的稳定性实验
1.3.3.1 温度对莲房原花青素稳定性的影响[12-15]
称取100mg莲房原花青素精制物粉末,定容至100mL,配制质量浓度为1.0mg/mL的原花青素溶液,并分装于4个带帽试管中,每支试管15mL。将4支试管分别置于40、60、80、100℃的水浴锅中,每隔1.0h吸取1.0mL,测定原花青素含量的变化,平行测定3次取平均值,计算保存率,并进行热降解动力学研究,计算相应的热降解动力学参数(半衰期、活化能和反应速率常数)。
1.3.3.2 光对莲房原花青素稳定性的影响
用莲房原花青素精制物粉末配制质量浓度为1.0mg/mL的原花青素溶液100mL,分装于3个透光性良好的带帽试管中,每个试管中的原花青素溶液体积均为25mL。将3支试管分为3组,第1组置于室外,进行阳光直射;第2组置于室内,避免阳光直射;第3组置于暗室,避免与光接触。每隔1d取样,测定3组试管中的原花青素含量,平行测定3次,取平均值。
1.3.3.3 pH值对莲房原花青素稳定性的影响
配制pH值分别为2.0、3.0、4.0、5.0、6.0、7.2、8.0、9.0、10.0的溶液,称取等量的莲房原花青素精制物粉末,分别加入到各pH值的溶液中,配成质量浓度为1.0mg/mL的原花青素溶液,放置于40℃的恒温水浴锅中,每隔1.0h测定一次原花青素含量的变化,每个实验重复3次,取平均值。
1.3.3.4 糖和食盐对莲房原花青素稳定性的影响
配制质量分数为1%、5%、10%、20%的蔗糖、葡萄糖溶液和1%、2%、4%、6%的食盐溶液,称取等量的莲房原花青素精制物粉末,分别加入到不同质量分数的糖和食盐溶液中,配成质量浓度为1.0mg/mL的原花青素溶液,在40℃的水浴锅中保温1h后测定原花青素的含量,以蒸馏水定容的原花青素溶液作对照,每个实验重复3次,取平均值。
1.3.3.5 氧化剂和还原剂对莲房原花青素稳定性的影响
配制体积分数为0.05%、0.1%、0.15%、0.2%的H2O2溶液和质量分数为0.1%、0.3%、0.5%、0.7%的VC、NaHSO3溶液,称取等量的莲房原花青素精制物粉末,分别加入到H2O2、NaHSO3和VC溶液中,配成质量浓度为0.7mg/mL的原花青素溶液,在40℃的水浴锅中保温2h后测定原花青素的含量,以蒸馏水定容的原花青素溶液作对照,每个实验重复3次,取平均值。
1.3.3.6 防腐剂对莲房原花青素稳定性的影响
配制质量浓度为0.01、0.05、0.25、0.5g/L的山梨酸钾和苯甲酸钠溶液,称取等量的莲房原花青素精制物粉末,分别加入到不同质量浓度的山梨酸钾和苯甲酸钠溶液中,配成质量浓度为0.7mg/mL的原花青素溶液,在40℃的水浴锅中保温1h后测定原花青素的含量,以蒸馏水定容的原花青素溶液作对照,每个实验重复3次,取平均值。
1.3.3.7 金属离子对莲房原花青素稳定性的影响
配制质量浓度为0.005、0.01、0.05、0.1mg/mL的K+、Ca2+、Na+、Mg2+、Cu2+、Fe2+、Fe3+、Zn2+、Al3+、Pb2+溶液,称取等量的莲房原花青素精制物粉末,分别加入到不同质量浓度的金属离子溶液中,配成质量浓度为1.0mg/mL的原花青素溶液,在40℃的水浴锅中保温1h后测定原花青素的含量,以蒸馏水定容的原花青素溶液作对照,每个实验重复3次,取平均值。
1.3.3.8 不同灭菌方式对莲房原花青素稳定性的影响
本实验模拟了一种软饮料体系[16],以此研究不同灭菌方式对莲房原花青素稳定性的影响。软饮料体系的配制:称取8.0g葡萄糖、0.1g酒石酸、0.1g柠檬酸,用蒸馏水配制糖酸比为40:1的软饮料溶液100mL,并按0.025mg/mL的质量浓度加入原花青素精制物粉末。分装于4支带帽试管中,每支20mL,分别进行63℃、30min巴氏灭菌;100℃、10min煮沸灭菌;2450MHz、500W、5min微波灭菌;121℃、0.1MPa、15min 高压蒸汽灭菌。灭菌完毕后测定4支试管中的原花青素含量,平行测定3次,取平均值,并与未经灭菌处理的软饮料溶液中的原花青素含量进行对比。
1.3.4 莲房原花青素的热降解动力学[17-19]
1.3.4.1 动力学方程级数的确定
食品中绝大多数组成成分在贮藏加工过程中都会受到各种因素的影响而降解,这些成分发生降解反应的动力学模型基本上符合零级或一级动力学反应模型,因此莲房原花青素的热降解可用以下模型描述。
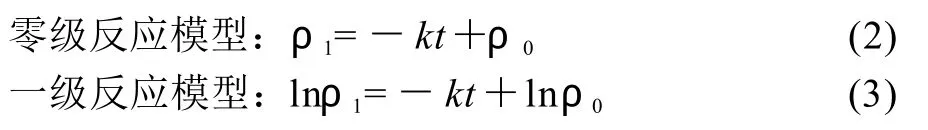
式中:ρ0为原花青素初始质量浓度/(mg/mL);ρ1为原花青素在t时刻的质量浓度/(mg/mL);t为反应时间/h;k为速率常数。
1.3.4.2 反应半衰期tl/2的计算
当原花青素消耗掉1/2,即ρ1=ρ0/2时,所需要的反应时间称为反应的半衰期tl/2。由零级反应模型得,零级反应的半衰期表示式为:

由一级反应模型得,一级反应的半衰期表示式为:

式中:ρ0为原花青素初始质量浓度/(mg/mL);k为速率常数。
1.3.4.3 反应的速率常数k及反应活化能Ea的计算
莲房原花青素热降解反应的速率常数k及活化能Ea根据Arrhenius方程进行计算[20-22],阿仑乌斯(Arrhenius)证明,化学反应的速率常数k与反应温度T之间的关系为:

当方程两边同时取对数时,得:

式中:k为速率常数;R为气体常数,8.314J/(mol·K);k0为方程常数,对于指定的反应,k0和反应浓度及温度无关;T为绝对温度/K。
由此可求出速率常数k及反应活化能Ea(kJ/mol)。
2 结果与分析
2.1 光对莲房原花青素稳定性的影响
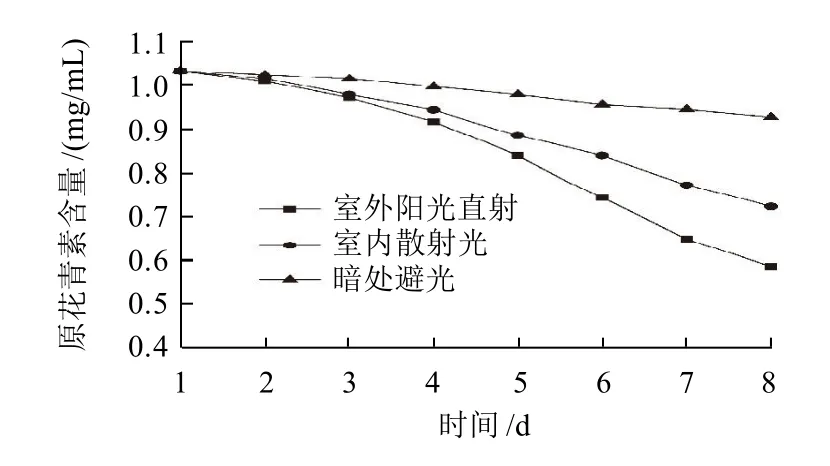
图1 光对莲房原花青素稳定性的影响Fig.1 Effect of light on stability of LSPCs
由图1可知,在不同的光照处理条件下,随着光照时间的延长,原花青素的含量均出现一定程度的降低,从第3天开始降低明显,且降低程度按照暗处避光、室内散射光、室外阳光直射的顺序依次增大。同时还发现室内散射光和室外阳光直射条件下的原花青素溶液的颜色随着实验时间的延长而逐渐变红,且后者变红更加明显。分别计算3组试管第8天的原花青素的保存率,发现暗处避光条件下的原花青素含量下降较小,第8天的保存率为89.73%;室内散射光条件下,原花青素含量有明显下降,第8天的保存率为79.86%;室外阳光直射条件下,原花青素含量有显著下降,第8天的保存率仅为56.68%;由此可见,光照对原花青素的稳定性影响较大,应将其避光保存。
2.2 温度对莲房原花青素稳定性的影响

图2 温度对莲房原花青素稳定性的影响Fig.2 Effect of temperature on stability of LSPCs
由图2可知,温度对原花青素的稳定性影响较大,随着加热时间的延长,各温度条件下的原花青素的含量均有不同程度的降低。在低温条件下溶液中的原花青素较为稳定,热降解速度较慢,随着温度的升高,原花青素的稳定性逐渐下降。在40℃条件下,8h后保存率为93.01%,60℃条件下,8h后保存率为85.61%。当温度超过60℃时,降解速度加快,在80℃条件下,8h后保存率为63.65%,在100℃条件下,8h后保存率仅为45.12%,由此可知,低温有利于原花青素的保存。因此,在实际应用中,含有原花青素的产品应在较低的温度下储存。
2.3 pH值对莲房原花青素稳定性的影响
图3 pH值对莲房原花青素稳定性的影响Fig.3 Effect of pH on stability of LSPC
由图3可知,pH2.0~6.0时,随时间的延长,溶液中原花青素含量变化不大,且pH4.0时原花青素含量最高,说明原花青素溶液在pH2.0~6.0的范围内比较稳定。当溶液pH值超过7.2时,溶液的吸光度迅速减小并且溶液颜色变黄,说明花青素在碱性条件下不稳定,这是因为碱性条件下原花青素发生了降解,已经生成了其他物质。因此,原花青素在使用和加工时应在弱酸性介质中进行。
2.4 糖和食盐对莲房原花青素稳定性的影响

表1 糖和食盐对莲房原花青素稳定性的影响Table 1 Effects of sugars and NaCl on stability of LSPCs
由表1可知,在不同添加量的糖和食盐溶液中,随着时间的延长,莲房原花青素的保存率有不同程度的波动,但波动的幅度均很小,这说明莲房原花青素在糖和食盐溶液中有较好的稳定性。
2.5 氧化剂和还原剂对莲房原花青素稳定性的影响
由图4可以看出,不同添加量的氧化剂对莲房原花青素稳定性均有较大的影响,随着氧化剂添加量的增加,莲房原花青素的含量下降得越多,颜色也越来越浅。当氧化剂添加量为0.2%时,莲房原花青素的保存率仅为20.53%。这说明莲房原花青素在含有氧化剂的环境中稳定性非常差,因此,莲房原花青素使用和加工过程中应该避免氧化剂的存在。

图4 氧化剂对莲房原花青素稳定性的影响Fig.4 Effect of oxidant on stability of LSPCs

图5 还原剂对莲房原花青素稳定性的影响Fig.5 Effect of reductant on stability of LSPCs
由图5可以看出,不同添加量的还原剂对莲房原花青素稳定性均有一定的保护作用,随着还原剂添加量的增加,莲房原花青素的含量下降得越少。当V C和NaHSO3的添加量为0.7%时,莲房原花青素的保存率分别为99.72%、99.59%。这说明还原剂可以增强莲房原花青素的稳定性,因此,莲房原花青素使用和加工过程中应该添加适当的还原剂。
2.6 防腐剂对莲房原花青素稳定性的影响
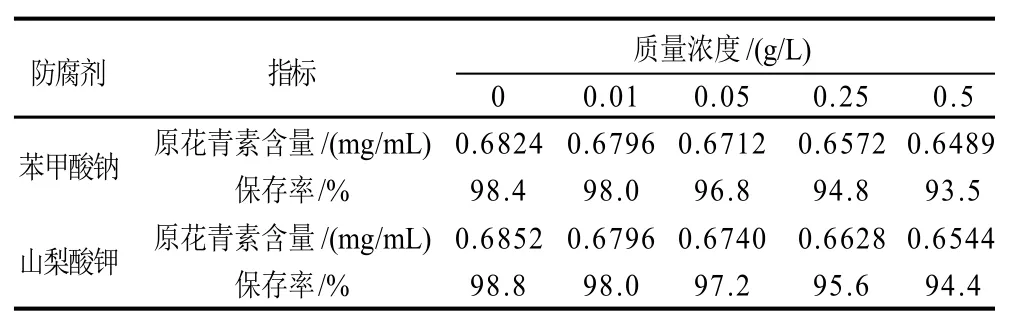
表2 防腐剂对莲房原花青素稳定性的影响Table 2 Effect of preservatives on stability of LSPCs
由表2可知,随着苯甲酸钠和山梨酸钾质量浓度的增加,原花青素的含量和保存率均呈略微下降趋势。与对照比较,当防腐剂的添加量≤0.5g/L时,添加苯甲酸钠和山梨酸钾的原花青素溶液中原花青素的保存率分别能达到93.54%和94.35%以上。由此可知,本实验质量浓度范围内(≤0.5g/L),防腐剂对原花青素的保存率无显著影响。因此,将苯甲酸钠和山梨酸钾与原花青素共同使用并不影响原花青素的稳定性。
2.7 金属离子对莲房原花青素稳定性的影响

图6 金属离子对莲房原花青素稳定性的影响Fig.6 Effect of metal ions on stability of LSPCs
由图 6 可知,K+、Ca2+、Na+、Mg2+、Zn2+、Cu2+这6种离子对原花青素的稳定性影响较小,Fe2+、Fe3+、Al3+、Pb2+对原花青素的稳定性影响较大。Fe2+加入后原花青素溶液由红色变为兰黑色,且产生絮状沉淀;Fe3+加入后原花青素溶液红色变成兰黑色,但没有沉淀生成,添加0.1mg/mL Fe3+的后原花青素的保存率仅为13.40%;Al3+加入后原花青素溶液颜色变黄,同时也有少许絮状沉淀产生;Pb2+加入后原花青素溶液由红色变为黑色,且产生絮状沉淀;说明这4种离子对原花青素有明显的破坏作用,但具体原因有待进一步研究。因此,在原花青素的加工和使用时尽量避免与F e2+、Fe3+、Al3+、Pb2+共存。
2.8 不同灭菌方式对莲房原花青素稳定性的影响
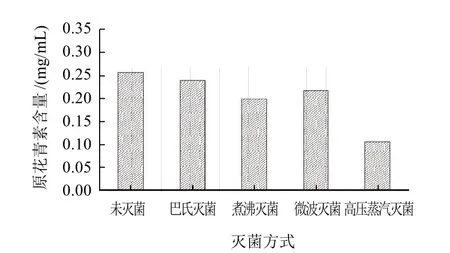
图7 不同灭菌方式对莲房原花青素稳定性的影响Fig.7 Effect of different sterilization processes on stability of LSPCs
由图7可知,经不同灭菌方式处理后,原花青素的含量均出现不同程度的降低,其中高压蒸汽灭菌对原花青素的影响最大,其保存率仅为53.32%,且发现经高压蒸汽灭菌后的原花青素溶液的红色明显加深;巴氏灭菌对原花青素的影响最小,其保存率为95.24%,微波灭菌和煮沸灭菌的保存率分别为87.79%、82.47%。由此可知,实际应用中对含有原花青素的饮料或口服液等产品进行杀菌时,应首选巴氏灭菌,应尽量避免高温、高压杀菌处理。
2.9 莲房原花青素热降解动力学
2.9.1 反应级数(n)确定
为了排除因传热引起的误差,分别以60、80、100℃条件下原花青素水浴后1h的质量浓度为起始值,以原花青素质量浓度保存率对数的负值-ln(ρt/ρ0)(ρ0为开始加热时莲房原花青素的质量浓度,ρt为经过时间t后莲房原花青素的质量浓度)对加热时间t作图,如图8所示。分别进行线性回归,得回归方程和决定系数,可知- ln(ρt/ρ0)和t成明显线性关系,60、80、100℃条件下决定系数R2分别为0.9931、0.9925和0.9943。由公式lnρ1=-kt+lnρ0可知其反应级数为1,即莲房原花青素的热降解符合一级反应模型。
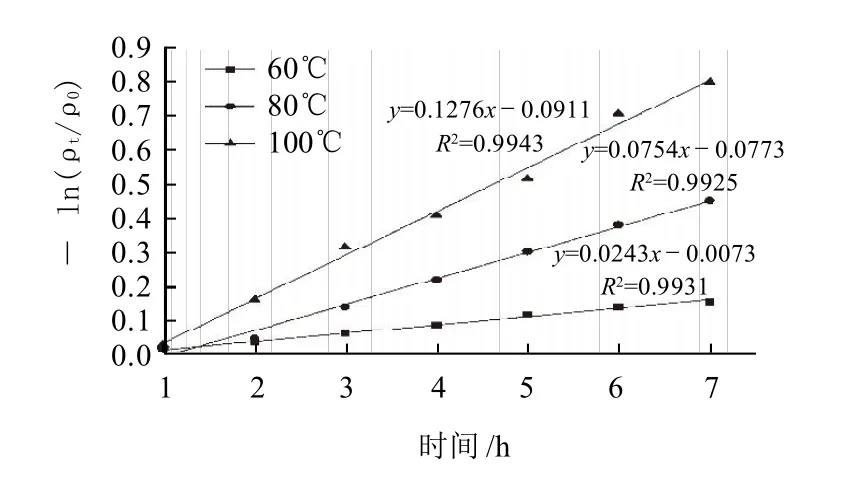
图8 热处理过程中加热时间对-ln(ρt/ρ0)的影响Fig.8 Effects of heating time on - ln(ρt/ρ0) in heat treatment process
2.9.2 莲房原花青素热降解动力学参数的确定
由公式lnρ1=-kt+lnρ0及图8可知,原花青素质量浓度保存率对数的负值-ln(ρt/ρ0) 对加热时间t作图所得直线的斜率即为该温度时的热降解反应常数k。根据不同温度时的k值,以lnk对1/T作线性回归,由公式k=k0exp(-Ea/RT)可得,直线的斜率为-Ea/R,截距为lnk0,由直线的斜率和截距即可求出活化能Ea和方程常数k0,具体参数如表3所示。

表3 莲房原花青素热降解动力学参数Table 3 Kinetics parameters of thermal degradation of LSPCs
2.9.3 莲房原花青素热处理过程中含量变化的预测模型
根据莲房原花青素在加热过程中含量的变化,由公式 lnρ1= -kt+lnρ0、k=k0exp(-Ea/RT)可得:

将活化能Ea=43.10kJ/mol、反应常数k0=1.51×105、R=8.314J/(mol·K)带入式(8)可得:

式(9)即为莲房原花青素热降解的预测模型。
2.9.4 动力学模型的验证
应用动力学模型分别预测在4℃和25℃条件下莲房原花青素的半衰期,分别为25.45、9.17d。将质量浓度为1.0mg/mL的莲房原花青素溶液在以上温度条件下保存,在第25天和第9天测定其原花青素含量,分别为0.55、0.52mg/mL,接近初始值的一半,表明动力学降解方程和实际观测结果符合较好,即所得动力学模型有效。
3 结 论
莲房原花青素生产出来以后,它的稳定性将直接影响它的利用、运输、保存等各个环节,从而影响到它的使用范围和开发前景。稳定性实验结果表明:高温、光照和碱性环境对莲房原花青素溶液均有较强降解作用,且降解作用随温度的升高,光照强度的增加,碱度增加而增强。通过对莲房原花青素热稳定性的研究得出,其热降解符合动力学一级反应,其反应活化能Ea为43.10kJ/mol,反应常数k0为1.51×105。食品中常用的食品添加剂,如葡萄糖、果糖、食盐、防腐剂等对莲房原花青素的稳定性影响较小,不同质量分数的葡萄糖、果糖和食盐对莲房原花青素均无明显影响,苯甲酸钠和山梨酸钾对莲房原花青素的稳定性影响也不是很大,并且苯甲酸钠和山梨酸钾作为防腐剂运用于食品的剂量很小,所以对莲房原花青素的稳定性影响可以忽略。氧化剂、还原剂对莲房原花青素的稳定性均有较大影响,氧化剂对莲房原花青素有较强的破坏作用,并且随着氧化剂的添加量加大,破坏作用加强,而还原剂对莲房原花青素有一定的保护作用,随着还原剂添加量的增加,保护作用加强。不同金属离子对莲房原花青素的影响不同,Fe3+、Fe2+、Pb2+和Al3+对其有明显的破坏作用,其他金属离子对其影响不大。不同的灭菌方式对莲房原花青素的影响程度不同,高压蒸汽灭菌对原花青素的影响最大,巴氏灭菌对原花青素的影响最小。因此,在莲房原花青素的利用、运输和保存过程中应避免高温、光照、碱性环境以及氧化剂,并且还应避免与铁、铝等器皿的接触,同时还应尽量除去环境中的铅离子,在灭菌方式上应采用巴氏灭菌。
[1] 凌智群. 莲花原花青素及其生物药理活性研究[D]. 武汉: 华中农业大学, 2001.
[2] 凌智群, 谢笔均. 莲花原花青素对氧化自由基和脂质过氧化的作用[J]. 营养学报, 2002, 24(2): 121-125.
[3] 段玉清, 周密, 张海晖, 等. 莲房原花青素对黑色素瘤B16细胞的抑制作用[J]. 中国药学杂志, 2009, 44(2): 103-106.
[4] DEL BAS J M, FERNANDEZ-LARREA J, BLAY M, et a1. Grape seed procyanidins improve atherosclerotic risk index and induce liver CYP7A1 and SHP expression in healthy rats[J]. FASEB J, 2005, 19(3): 479-481.
[5] HUYNH T H, TEEL R W. Selective induction of apoptosis in human mammary cancer cells (MCF-7) by pycnogenol[J]. Anticancer Res, 2000,20(4): 2417-2420.
[6] BLAZSO G. Antiinflammatory activities of procyanidin-containing extract fromPinus pinasterAit. after oral and cutaneous application[J].Pharmazie, 1997, 52(5): 380-382.
[7] BAGCHI D, BAGCHI M, STOHS S J. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention[J]. Toxicology, 2000, 148(2): 187-197.
[8] 高军涛, 侯京武, 李美芬. 葡萄籽中多酚类物质对氧自由基清除作用的ESR研究[J]. 波谱学杂志, 1999, 16(5): 409- 415.
[9] 段玉清, 张海晖, 周密, 等. 大孔吸附树脂对莲房原花青素吸附纯化性能的研究[J]. 离子交换与吸附, 2009, 25(2): 114-120.
[10] 邓乾春, 陈春艳, 田斌强, 等. 化学发光法研究莲房原花青素的体外抗氧化活性和对DNA损伤的保护作用[J]. 天然产物研究与开发,2007, 19(4): 563-567.
[11] 李华, 肖付才, 袁春龙, 等. 铁盐催化比色法测定葡萄籽超微粉中的原花青素[J]. 食品研究与开发, 2007, 28(9): 114-117.
[12] 刘晶晶, 段玲玲, 王雪锋, 等. 鸭血糯色素稳定性的研究[J]. 食品科学, 2010, 31(7): 123-126.
[13] 朱芸, 刘金荣, 成玉怀, 等. 新疆西伯利亚白刺果红色素稳定性的研究[J]. 食品科学, 2008, 29(3): 113-115.
[14] 王晓梅, 徐为民, 曹士锋, 等. 红心萝卜花色苷稳定性的研究[J]. 食品科学, 2008, 29(7): 98-100.
[15] 郭松年, 董周永, 孙海燕, 等. 石榴汁花色苷热稳定性及其降解动力学研究[J]. 农业工程学报, 2008, 24(3): 256-269.
[16] 李莉蓉, 张名位, 刘邻渭, 等. 三种黑色粮油作物种皮花色苷提取物抗氧化能力的稳定性比较[J]. 中国农业科学, 2007, 40(9): 2045-2052.
[17] 王梦泽, 薛少平, 王佳, 等. 草莓浑浊汁维生素C降解动力学模型[J].农业工程学报, 2010, 26(6): 353-357.
[18] 辛修锋, 余小林, 胡卓炎, 等. 杨梅澄清汁及浓缩汁中花色苷热降解动力学的研究[J]. 农业工程学报, 2007, 23(9): 251-255.
[19] 樊金玲, 朱文学, 巩卫东, 等. 蔗糖含量对牡丹花色苷热稳定性和降解动力学的影响[J]. 食品科学, 2010, 31(3): 74-78.
[20] 高愿军, 郝莉花, 张鑫, 等. 猕猴桃汁维生素降解动力学的研究[J].农业工程学报, 2006, 22(5): 157-160.
[21] MASKAN M. Production of pomegranate(PunicagranatumL.)juice concentrate by various heating methods: colour degradation and kinetics[J].Journal of Food Engineering, 2006, 72: 218-224.
[22] GOULA A M, ADAMOPOULOS K G, CHATZITAKIS P C, et al.Prediction of lycopene degradation during a drying processof tomato pulp[J]. Journal of Food Engineering, 2006, 74(1): 37-46.
Stability and Thermal Degradation Kinetics of Procyanidins from Lotus Seed Pods
WANG Zhi-hui,SUN Zhi-da*,XIE Bi-jun
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Lotus seed pod procyanidins (LSPCs) were extracted with 70% aqueous ethanol solution and purified by AB-8 macroporous resin adsorption, and their stability and thermal degradation kinetics were investigated. LSPCs were found to be very stable under low temperature, light-avoiding and weakly acidic conditions. NaCl, sucrose and glucose and the preservatives sodium benzoate and potassium sorbate had no obvious effect on LSPCs. H2O2 exhibited a great destructive effect on LSPCs,while NaHSO3 and VC had protective effect. LSPCs could be damaged by Fe3+, Fe2+, Pb2+and Al3+, and other tested metal ions had a small effect. Four different sterilization methods were found to affect the stability of LSPCs to different extents, of which pasteurization had the least effect and high pressure steam sterilization had the largest effect. The thermal degradation of LSPCs complied with the first-order reaction kinetic process, and the activation energyEa, and reaction constantk0 were 43.10 kJ/mol and 1.51×105, respectively. Moreover, a prediction model for the degradation of LSPCs was established. In validation experiments, the experimental results were observed to be in good consistency with the predicted ones, indicating that the prediction model is reasonable.
lotus seed pod;procyanidins;stability;degradation kinetics
TS202.3
A
1002-6630(2011)07-0077-06
2010-09-08
国家“863”计划项目(2007AA100401)
汪志慧(1984—),女,硕士研究生,研究方向为天然产物化学。E-mail:wangzhihui100@yahoo.cn
*通信作者:孙智达(1963—),男,教授,博士,研究方向为天然产物化学。E-mail:sunzhida@mail.hzau.edu.cn
