糖类对羊血超氧化物歧化酶活性的影响
2011-10-27杨学山杨孝朴付文力
杨学山,杨孝朴,付文力
(甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
糖类对羊血超氧化物歧化酶活性的影响
杨学山,杨孝朴,付文力
(甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
目的:研究糖类对羊血超氧化物歧化酶(SOD)活性影响关系。方法:以离子交换层析法制备的羊血SOD为原料,加入不同浓度的麦芽糖、蔗糖、乳糖、海藻糖、D-葡萄糖、D-果糖、D-木糖和D-甘露糖,25℃分别保温4、24、48、72h和96h后,利用邻苯三酚自氧化法测定SOD酶活力,并计算相对酶活力。结果:海藻糖对羊血SOD有明显的激活和保护作用,高浓度的麦芽糖和低浓度的乳糖有一定稳定作用,其余糖类对SOD活性影响不大。结论:不同糖类在不同浓度下对羊血SOD活性影响不同。
超氧化物歧化酶;糖类;酶活力
超氧化物歧化酶(superoxide dismutase,SOD EC1, 15,1,1)是一种含有金属离子的蛋白酶,广泛存在于动植物及微生物体内,催化超氧阴离子(superoxideanions,)转化为H2O2和O2,对维持机体动态平衡起重要作用[1]。SOD能防御氧毒性、增强机体抗辐射能力、预防衰老,在一些疾病如肿瘤、炎症及自身免疫疾病等的治疗中有良好的疗效[2]。SOD已应用于化妆品、食品、医药等领域,其开发与应用前景不可估量。
目前我国主要以牛血和猪血液为原料分离提取SOD,但对羊血SOD研究较少。同时天然SOD具有半衰期短、在水溶液中易失活等缺点,导致保存条件要求高,在一定程度上限制了其应用[3]。因此研究不同浓度糖类在不同时间内对羊血SOD活性影响关系,探讨其作用规律,有助于选择合适的稳定剂,使其在不同产品应用中能更合理的与原辅料配伍,提高和保证产品的有效性,为羊血SOD产品开发提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
新鲜羊血采自兰州小西湖屠宰场。
牛血清白蛋白 上海试剂厂;DEAE-Sephadex A-50 Pharmacia公司;柠檬酸钠、KH2PO4、K2HPO4、邻苯三酚等均为分析纯;麦芽糖、葡萄糖、蔗糖、乳糖、甘露糖、木糖、果糖和海藻糖等均为食品级。
1.2 仪器与设备
SL-1001电子天平 上海民桥精密科学仪器有限公司;TGL-166台式离心机 上海安亭科学仪器厂;HH-6数显恒温水浴锅 国华电器有限公司;PHS-828 pH计 成都全速科技有限公司;808型紫外-可见分光光度计 日本日立公司。
1.3 方法
1.3.1 羊血SOD分离纯化
1.3.1.1 工艺流程
新鲜羊血→预处理→收集红血球→细胞破碎→热变性→层析→透析→浓缩→活性测定→成品
1.3.1.2 操作要点
羊血预处理:将收集的新鲜羊血去除毛等杂质,加入10.0g/L柠檬酸三钠抗凝。
收集红血球:取新鲜羊血,以5000r/min离心15min,收集红血球沉淀;将红血球加0.9g/100mL NaCl溶液,5000r/min离心10min,重复3次,得洁净红血球。
细胞破碎:取洁净红血球100mL,加等量去离子水搅拌溶血。
热变性处理:将细胞裂解液中加入质量浓度为2g/100mL CuSO4和3g/100mL ZnSO4溶液,置60℃热处理15min,5000r/min离心15min,除去热变性蛋白,收集上清液。
DEAE-Sephadex A-50柱层析:将透析液小心加到已用磷酸盐缓冲液平衡好的DEAE-Sephadex A-50柱,以流速0.5mL/min进行梯度洗脱。
透析、浓缩:将洗脱液置于透析袋中,在去离子水中动态透析6~8h,并将透析液浓缩至11mL。
蛋白质浓度和酶活力测定:以牛血清白蛋白作标准曲线,采用考马斯亮蓝染色结合法测定蛋白质浓度[4];以邻苯三酚自氧化法测定酶活力[5-6]。
1.3.2 不同糖类处理SOD
在酶活力最适温度及底物浓度条件下,分别向4.0mL酶液中加入1.0mL的麦芽糖、蔗糖、乳糖、海藻糖、葡萄糖、果糖、木糖和甘露糖溶液,各糖类浓度梯度分别为0.1、0.2、0.3、0.4、0.5mol/L,另取1.0mL去离子水加入等体积酶液,混匀,25℃保温4、24、48、72、96h。将不同浓度糖类处理,25℃保温不同时间后测定的SOD酶活力换算成相对酶活力(以不加糖类时起始酶活力为100%计)。以双蒸水为对照,以上操作平行处理3次。
1.3.3 不同糖类处理后SOD酶活力的测定
采用邻苯三酚自氧化法测定SOD酶活力[4-5],并以无糖类反应系统为对照,计算糖类存在下的相对酶活力。
2 结果与分析
2.1 羊血SOD分离纯化结果
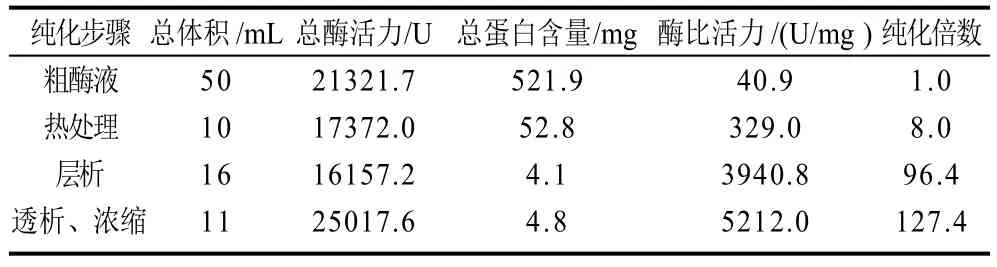
表1 羊血SOD的分离纯化Table 1 Purification steps of SOD from sheep blood
羊血SOD在DEAE-Sephadex A-50离子交换层析过程中酶活力和比活力变化如表1所示,经层析后酶比活力达到5212.0U/mg,高于高巍等[7]用DEAE-32纯化羊血SOD的结果(3871.4U/mg)。SDS-PAGE纯度检测结果如图1所示,纯化酶经SDS-PAGE染色后显示一条带,表明其达到电泳纯。

图1 羊血SOD的SDS-PAGE图谱Fig.1 Polyacrylamide gel electrophoresis of SOD from sheep blood
2.2 不同糖类处理对SOD酶活力影响
2.2.1 麦芽糖对SOD酶活力的影响
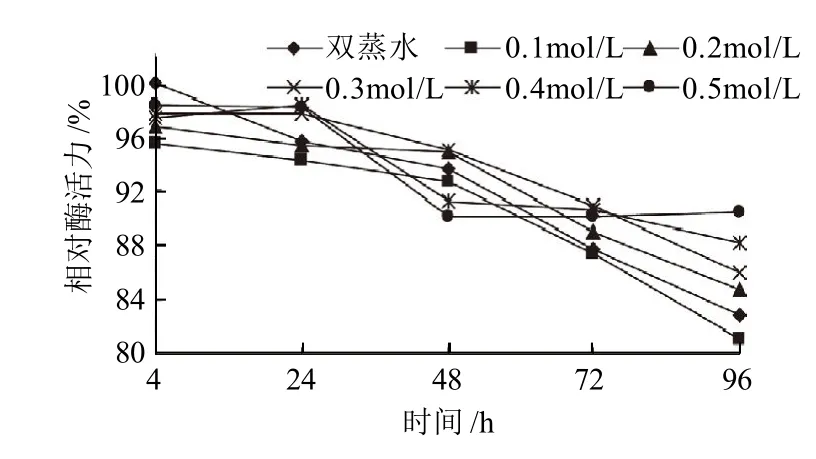
图2 不同浓度麦芽糖对SOD酶活力的影响Fig.2 Effect of maltose on the activity of SOD
由图2可知,在酶液中加入不同浓度的麦芽糖,保温不同时间后,SOD酶活力有一定变化。其中麦芽糖浓度为0.1~0.2mol/L时,变化不明显,说明低浓度麦芽糖对SOD无保护作用。麦芽糖浓度为0.3~0.5mol/L,保温24h后,保护作用较强;保温48h后,保护作用下降;保温72h后,相对酶活力高于对照组,说明高浓度麦芽糖在作用较长时间后,对SOD活性有一定保护作用。
2.2.2 蔗糖对SOD酶活力的影响
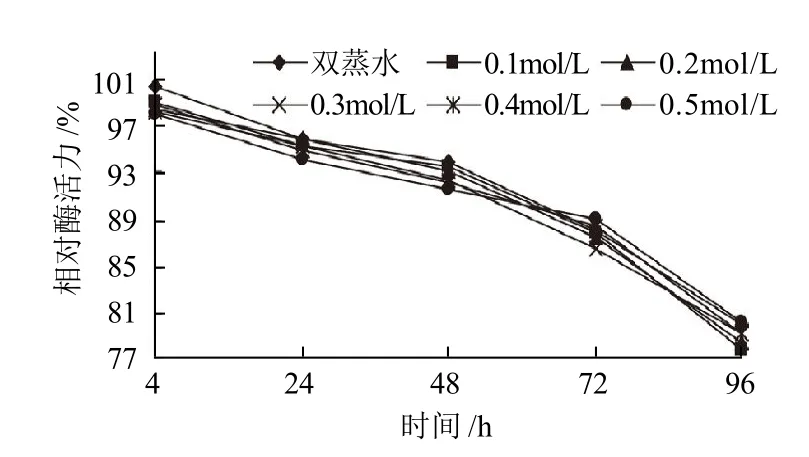
图3 不同浓度蔗糖对SOD酶活力的影响Fig.3 Effect of sucrose on the activity of SOD
由图3可知,在酶液中加入不同浓度的蔗糖,保温4~96h后,与对照相比,相对酶活力无明显变化。说明蔗糖对SOD稳定性几乎无影响。
2.2.3 乳糖对SOD酶活力的影响
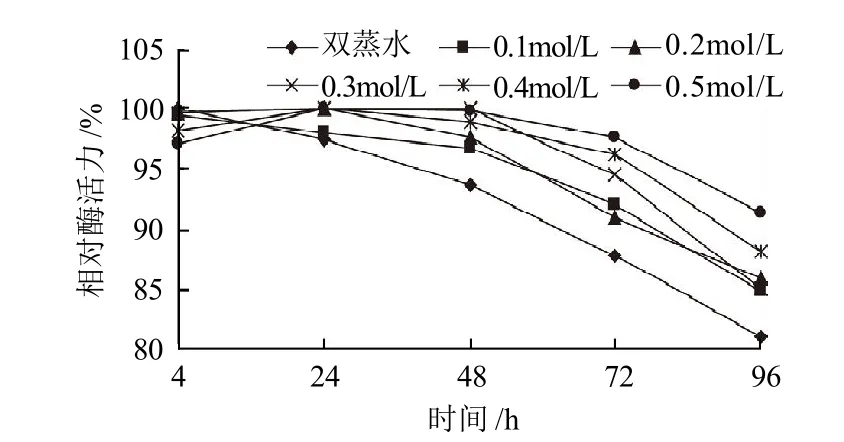
图4 不同浓度乳糖对SOD酶活力的影响Fig.4 Effect of lactose on the activity of SOD
由图4可知,在酶液中加入不同浓度的乳糖,保温不同时间后,相对酶活力均高于对照,说明乳糖对SOD有一定的稳定作用。总体来看,高浓度乳糖优于低浓度乳糖。
2.2.4 海藻糖对SOD酶活力的影响

图5 不同浓度海藻糖对SOD酶活力的影响Fig.5 Effect of trehalose on the activity of SOD
由图5可知,在酶液中加入不同浓度的海藻糖,保温不同时间后,相对酶活力均大于100%,最大值为137.8%,最小值为103.1%,表明其对SOD有较强的激活和稳定作用。96h后,加入0.3mol/L海藻糖的SOD相对酶活力高于其他浓度,达到122.7%,效果最理想。
2.2.5 D-葡萄糖对SOD酶活力的影响

图6 不同浓度D-葡萄糖对SOD酶活力的影响Fig.6 Effect of D-glucose on the activity of SOD
由图6可知,在酶液中加入不同浓度的D-葡萄糖,保温4~96h后,与对照相比,相对酶活力无明显变化。说明D-葡萄糖对SOD稳定性几乎无影响。
2.2.6 D-果糖对SOD酶活力的影响
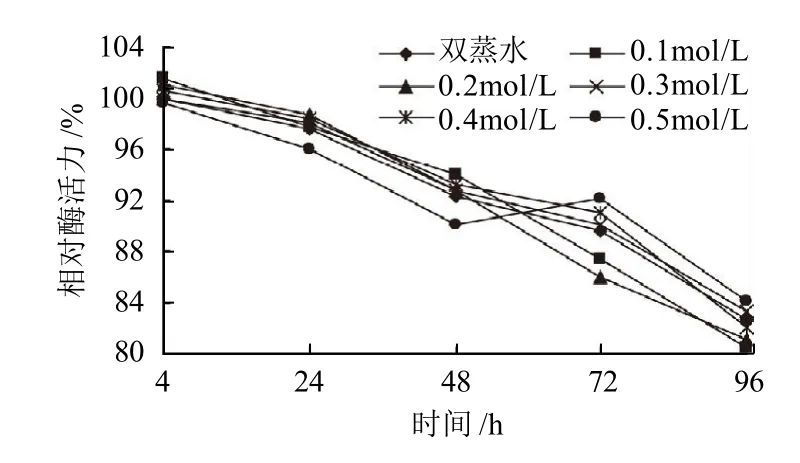
图7 不同浓度D-果糖对SOD酶活力的影响Fig.7 Effect of D-fructose on the activity of SOD
由图7可知,在酶液中加入不同浓度的D-果糖,保温4~96h后,与对照相比,相对酶活力无明显变化。说明D-果糖对SOD稳定性几乎无影响。
2.2.7 D-木糖对SOD酶活力的影响
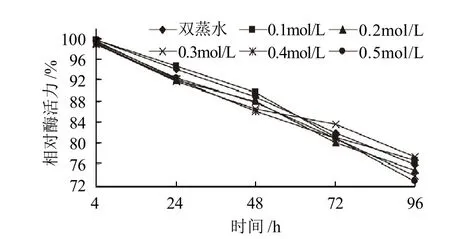
图8 D-木糖对SOD酶活力的影响Fig.8 Effect of D-xylose on the activity of SOD
由图8可知,在酶液中加入不同浓度的D-木糖,保温4~96h后,与对照相比,相对酶活力无明显变化。说明D-木糖对SOD稳定性几乎无影响。
2.2.8 D-甘露糖对SOD酶活力的影响

图9 不同浓度D-甘露糖对SOD酶活力的影响Fig.9 Effect of D-mannose on the activity of SOD
由图9可知,在酶液中加入不同浓度的D-甘露糖,保温4~96h后,与对照相比,相对酶活力无明显变化。说明D-甘露糖对SOD稳定性几乎无影响。
3 结 论
本实验以离子交换层析法分离纯化的羊血SOD为原料,研究了不同浓度的常见双糖和单糖在体外对SOD活性的影响。结果表明,不同浓度的海藻糖对SOD均有较强的保护作用,其中浓度在0.3mol/L时效果最佳,因此可用0.3mol/L的海藻糖作为SOD保存时的稳定剂,使SOD保存效果更好。究其原因,一方面,海藻糖分子结构中含有许多羟基,是一种多元醇化合物,水合能力很强,可能会使溶液中自由能向有利的方向改变[7-8]。另一方面,海藻糖的多羟基结构使它既能通过氢键与酶蛋白表面分子相连,又能通过氢键有效地与外部水相连,因而能使酶蛋白结构稳定,酶活力得到保护[9-11]。
糖对蛋白质的保护作用大小有时依赖于其浓度[12],通常在某个浓度范围内,保护效果随着浓度的升高而增加[13]。本实验中,0.5mol/L乳糖对SOD的保护效果整体优于0.1mol/L乳糖。当某些糖达到某一浓度,作用一定时间后,保护作用达到最大值,而此后再增加浓度和保存时间,保护效果不再增加,有时反而降低[14-16]。本实验中,麦芽糖浓度为0.3~0.5mol/L,保温24h后,保护作用较强;保温48h后,保护作用下降;保温72h后,相对酶活力高于对照组,说明高浓度麦芽糖在作用较长时间后,对SOD活性有一定保护作用。
另外5种糖类对SOD活力虽无稳定作用,但也无明显抑制作用,说明羊血SOD可以与糖类配伍使用,即以SOD为有效成分的食品、保健食品中可使用糖类作为矫味剂。
[1]MAIRKOVSKY M, ZIV V, NEVO N. Cu/Zn superoxide dismutase plays important role in immune response[J]. Mmunol, 2003, 25(6): 2993-3001.
[2]黎瑞珍, 杨庆建, 陈贻锐. SOD活性的测定及其应用研究[J]. 琼州大学学报, 2004, 11(5): 34-36.
[3]TIE Caijiang, ZHANG Hong, ZHANG Borui. The comparation of the stability of molecular modified and unmodified superoxide dismutase[J]. Microbiol Commun, 1999, 26(2): 96-98.
[4]徐桂花, 于颖. 羊血中超氧化物歧化酶(SOD)活性的测定[J]. 肉类工业, 2009, 32(10): 32-33.
[5]谢卫华. 邻苯三酚自氧化法测定超氧化物歧化酶[J]. 医药工业, 1988, 19(5): 217-219.
[6]LIN Cunting, LEE T L, DUAN Kejia, et al. Molecular cloning, characterization, and expression of a cDNA coding copper/zinc superoxide dismutase from black porgy[J]. Journal of Agricultural and Food Chemistry, 2008, 48(8): 4-7.
[7]高巍, 孙庆林. 羊血铜锌超氧化物歧化酶(Cu-ZnSOD)的分离纯化[J].生物技术, 2010, 20(1): 86-89.
[8]KEITHLEY E M, CANTO C, ZHENG Qinyi, et al. Cu/Zn superoxide dismutase and age-related hearing loss[J]. Hear Res, 2005, 20(9): 76-85.
[9]区炳庆, 卢卫红. 几种糖与氨基酸对鸭血红细胞SOD的保护作用[J].佛山科学技术学院学报: 自然科学版, 2009, 27(1): 20-23.
[10]葛宇, 袁勤生. 海藻糖对生物活性物质的保护作用机理研究进展[J].药物生物技术, 2002, 9(5): 297-300.
[11]SOLA M, MEYER J R. Stabilization against thermal inactivation promoted by sugars on enzyme structure and function: Why istrehalose more effective than other sugars[J]. Arch Biochem Biophys, 1998, 60(1): 10-14.
[12]ARAKAWA T, TIMASHEFF S N. Mechamismof protein salting out by divalent cations: balance between hydration and salt binding[J]. Biochemistry, 1984, 23(11): 5912-5917.
[13]薛艳林, 薛春放, 白春生, 等. 糖类对苜蓿叶蛋白中SOD的冻干保护作用[J]. 草地学报, 2008, 16(5): 518-521.
[14]孙东坡, 胡一桥. 蛋白质冷冻干燥制品中的保护剂及其保护机制[J].药学进展, 2003, 27(4): 201-205.
[15]张玉华, 凌沛学, 籍保平, 等. 糖类在生物活性物质冷冻干燥中的保护作用及其作用机制[J]. 中国生化药物杂志, 2007, 27(4): 247-249.
[16]WRIGHE W W, BAEZ J C, VANDERKOOI J M. Mixed trehalose/ sucrose glasses used for protein incorporation as studied by infrared and optical spectroscopy[J]. Anal Biochem, 2002, 30(7): 167-172.
Effect of Carbohydrates on Activities of Superoxide Dismutase Extracted from Sheep Blood
YANG Xue-shan,YANG Xiao-pu,FU Wen-li (College of Life Science and Technology, Gansu Agricultural University, Lanzhou 730070, China)
The activity of sheep blood superoxide dismutase (SOD) purified by DEAE Sephadex A-50 column chromatography was determined by pyrogallo autoxidation method after 4, 24, 48, 72 h and 96 h of 25 ℃ incubation in the respective presence of maltose, sucrose, lactose, fucose, glucose, D-fructose, D-trehalose, D-xylose and D-mannose under varying concentration conditions, and the corresponding relative enzyme activities were calculated. Trehalose had a remarkable activating and protecting effect on sheep SOD. High concentrations of maltose and low concentrations of lactose were conducive to stabilizing the enzyme, and other sugars tested had unobvious effect on the enzyme. Therefore, different kinds and amounts of sugar have different effects on sheep SOD.
superoxide dismutase;carbohydrate;enzyme activity
Q814
A
1002-6630(2011)07-0100-04
2010-07-27
甘肃省农业生物技术研究与应用开发项目(GNSW-2010-03)
杨学山(1977—),男,讲师,硕士,主要从事生物化学与生物制品研究。E-mail:yangxs@gsau.edu.cn
