微小毛霉发酵制取凝乳酶的培养基优化研究
2011-10-25张丽红朴姍善杨贞耐
张丽红,王 昕,朴姍善,郑 丽,杨贞耐,*
(1.吉林大学生物与农业工程学院,吉林长春130024;2.中国农业科技东北创新中心农产品加工研究中心,吉林长春130033)
微小毛霉发酵制取凝乳酶的培养基优化研究
张丽红1,2,王 昕1,朴姍善1,郑 丽1,2,杨贞耐1,2,*
(1.吉林大学生物与农业工程学院,吉林长春130024;2.中国农业科技东北创新中心农产品加工研究中心,吉林长春130033)
利用响应面分析法优化微小毛霉的发酵培养基,提高微小毛霉凝乳酶的凝乳活力。在单因素实验的基础上,用Design-Expert软件对实验数据进行多元回归分析,建立了3种因素与凝乳酶活力之间的函数关系,得出在基础发酵培养基中加入的氯化钙、乳清粉和葡萄糖的最佳浓度分别为0.58%、0.64%和1.13%,此时,微小毛霉凝乳酶的凝乳活力的理论值为1150.81SU/mL,验证平均值为1109.7SU/mL,与预测值基本一致。
凝乳酶,微小毛霉,发酵培养基,优化
凝乳酶是天冬氨酸蛋白酶的一种[1],通过剪切Phe105-Met106连接的к-酪蛋白使牛奶凝集,并为排除乳清提供条件[2-3],同时对干酪的质构形成及干酪特有风味的形成有非常重要的作用。目前,干酪生产中应用的酶主要来源于动物凝乳酶、植物凝乳酶和微生物凝乳酶。动物凝乳酶以其凝乳活力与蛋白水解能力的高比值而成为制作奶酪的首选酶[4],但随着世界范围内干酪产量的巨增,全球每年约需屠宰5000万头小牛,这导致世界范围内凝乳酶供应缺乏[5]。微生物具有生长周期短、产量大、受气候、地域、时间限制小且用其生产凝乳酶成本较低、酶提取方便、经济效益高[6]等特点,因此,为缓和凝乳酶供不应求的现状,在微生物中寻找合适的凝乳酶替代酶成为当前研究的热点。常用产凝乳酶的微生物有微小毛霉、粟疫菌、米黑毛霉、易脆毛霉、少根根霉、卷枝毛霉、东京根霉、米曲霉和爪畦根霉等[7-10],应用最多的是根霉及微小毛霉。根霉产凝乳酶的凝乳活力约为 72~92SU/mL[9-10],活力较低,毛霉产凝乳酶的凝乳活力可达到 600~800SU/mL[11],其中微小毛霉凝乳酶的蛋白水解活力比皱胃酶强,其蛋白水解能力相对较弱,对牛乳的凝固力也强,此外它还具有安全、无毒、活力高的特点[12-13],因此,微小毛霉产生的凝乳酶被广泛应用。本实验利用响应面分析法对微小毛霉的发酵培养基进行了优化,提高了微小毛霉凝乳酶的凝乳活力,为筛选产凝乳酶的优良菌株提供理论依据。
1 材料与方法
1.1 实验材料
微小毛霉(Mucor pusillus)AS3.3345 购自中国普通微生物保藏管理中心。
1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯去皮,切成块后称取200g煮沸30min,然后用纱布过滤,再加葡萄糖和琼脂 20g,溶化后补足水至 1000mL,121℃灭菌30min。
基础发酵培养基:10g麸皮加10mL水装于250mL三角瓶中,115℃灭菌20min。
1.3 种子培养和发酵
从保藏菌种中挑取少量菌丝接种于PDA斜面培养基上,30℃培养3d,斜面上即长满孢子。向生长良好的斜面上加入10mL无菌水,洗下孢子,移入装有玻璃珠和无菌水的三角瓶中振荡,使菌体在玻璃珠的搅打下,充分打散,成为单孢子悬液,然后再用无菌脱脂棉进行过滤,调整孢子数为106个/mL,即为种子液。
吸取2mL种子液接种到发酵培养基中,30℃培养3d,然后加入40mL无菌水,捣碎培养物,室温过夜,用无菌纱布过滤,滤液于8000r/min冷冻离心,弃沉淀,测定上清液的凝乳酶活力。
1.4 凝乳活性的测定
取10g脱脂奶粉,用0.01mol/L的CaC12溶液配制成10%的供试乳溶液。此溶液配制后在室温放置40min后使用,当天使用有效。取5mL供试乳溶液,在35℃保温10min,加入0.5mL适当稀释的待检样品溶液(35℃保温),迅速混匀,并把试管倾斜45°以上,沿试管轴方向旋转,观察到管壁上开始出现凝集小颗粒为终点,准确记录从酶加入到乳溶液凝固时间(凝乳时间一般控制在40~90s)。在上述条件下,40min凝结1mL脱脂乳的酶量定义为一个Soxhelt单位(SU)。
酶活力(SU)=(5/0.5)×D×2400/T
式中:D-酶液稀释倍数;T-凝乳时间。
1.5 单因素实验
本实验先对培养基中的碳源、氮源、磷源、钙源、酵母粉、镁离子进行单因素实验。实验表明,CaCl2、乳清粉和葡萄糖对微小毛霉产凝乳酶的影响最大,在基本发酵培养基的基础上添加葡萄糖时霉菌产酶的活性明显比添加果糖的高;添加0.8%的乳清粉作为霉菌的碳源有利于菌株产高效的凝乳酶。随着发酵培养基中CaCl2添加量的增加,其产生的凝乳酶活性也逐渐增加,当发酵培养基中CaCl2的添加量为0.5%时,其产生的凝乳酶活性最大,并且其蛋白水解活性也较低。
1.6 响应面法实验
根据单因素实验的结果,选取了CaCl2、乳清粉和葡萄糖这三个对微小毛霉产凝乳酶影响比较大的因素,采用响应面分析法对微小毛霉发酵培养基的组成进行优化。以凝乳酶活力为评价指标进行实验,实验因素与水平设计见表1。
2 结果与讨论
2.1 回归方程的建立与显著性分析
对CaCl2浓度(Z1)、乳清粉浓度(Z2)和葡萄糖浓度(Z3)作如下变换:X1=(Z1-0.5)/0.2,X2=(Z2-0.6)/0.2,X3=(Z3-1)/0.5。以 X1,X2,X3为自变量,以凝乳酶活力为响应值(Y),实验方案及结果见表2。
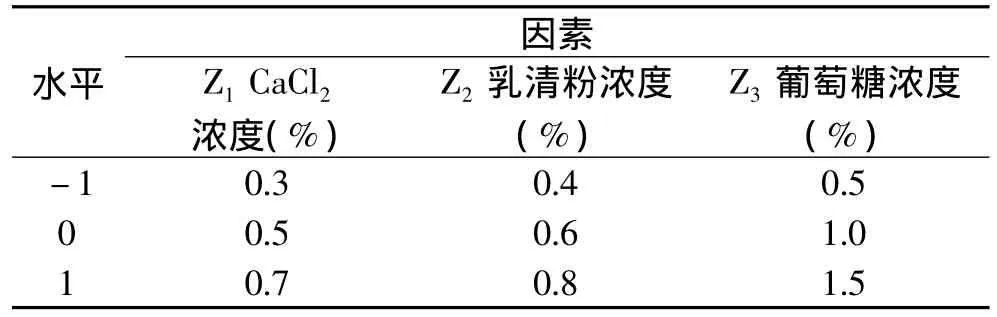
表1 响应面分析因素与水平

表2 响应面分析方案及实验结果
由表3可知,氯化钙浓度、乳清粉浓度和葡萄糖浓度这三个因素中,氯化钙浓度对凝乳酶活力影响最大,其次分别为葡萄糖浓度和乳清粉浓度。方程的相关系数为0.9516,说明响应值(凝乳酶活性)的变化有95.16%来源于所选变量,预测值与实测值之间具有高度相关性。校正相关系数为0.8896,说明该模型能够解释88.96%响应值的变化。回归方程很好地拟合了实验数据。由模型的P值为0.0008可以看出,模型应变量与全体自变量之间的线性关系是显著的。失拟项P值为0.4468,没有显著影响,说明数据中没有异常点。查F分布表,得F0.01(9,7)=6.72,失拟项F值为2.84小于F0.01(9,7),方程的 F值为15.33大于F0.01(9,7),从统计学意义上讲该回归方程具有高度显著性,证明回归方程真实、可靠,具有统计学意义。综上可以认为,该方程的拟合度和可信度均较高,可用于代替实验点对实验结果进行分析。
2.2 响应因子水平的优化
为进一步直观地说明氯化钙浓度、乳清粉浓度和葡萄糖浓度之间的交互作用和对凝乳酶活性的影响,利用Design Expert软件根据回归分析结果做出相应的曲面图(图1~图3)。由3组响应面图的平滑程度可以直观地看出,氯化钙的浓度对微小毛霉凝乳酶的活性影响最显著,表现为曲线较陡,葡萄糖次之,乳清粉对微小毛霉凝乳酶的活性影响最不显著,表现为曲线较平滑。且由响应面立体图可以看出,X1,X2和X3存在极值点,且最优工艺条件为X1=0.58,X2=0.64,X3=1.13,即微小毛霉产凝乳酶的最佳发酵培养基条件为:氯化钙浓度0.58%、乳清粉浓度0.64%、葡萄糖浓度1.13%,微小毛霉产凝乳酶的活性的理论值为1150.81SU/mL。
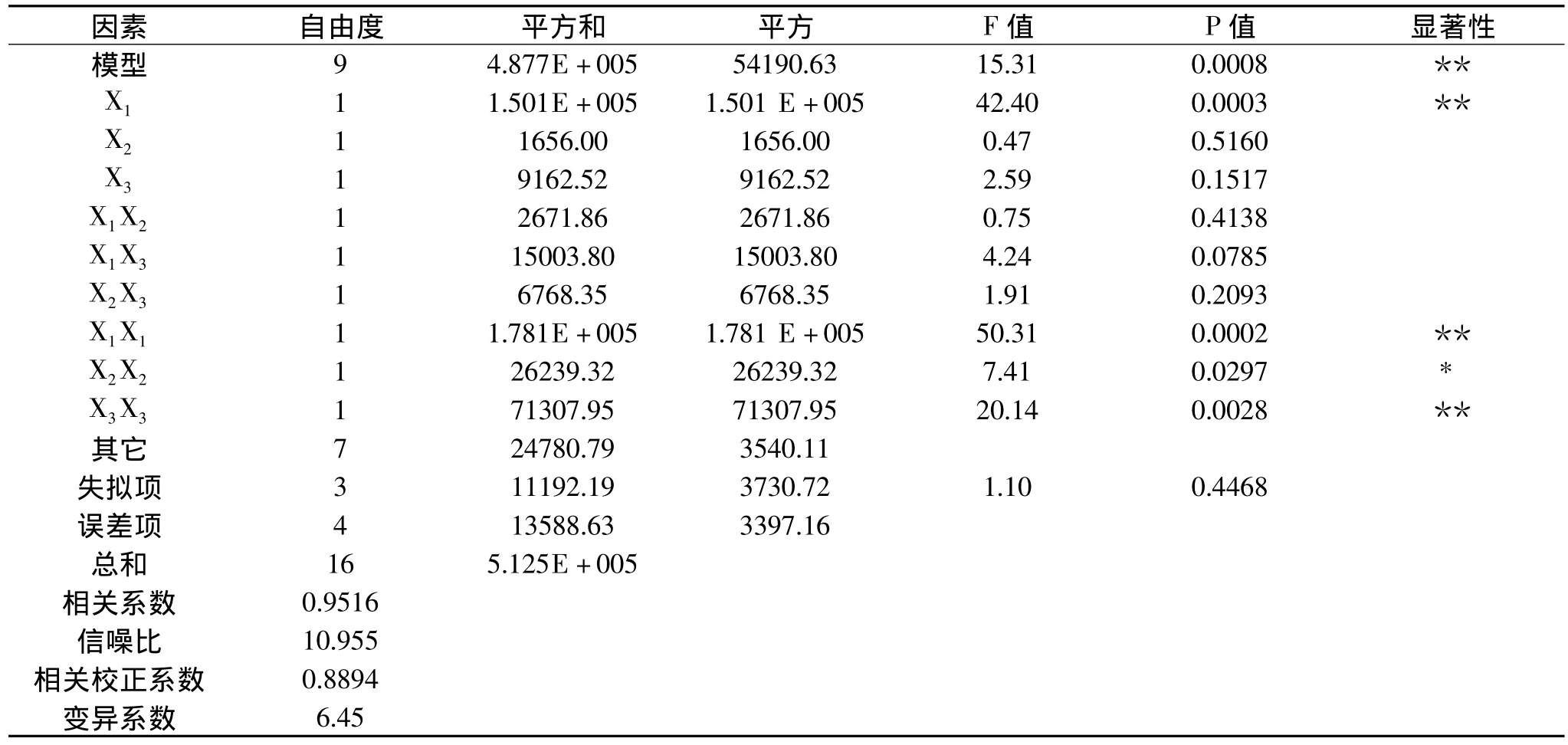
表3 回归方差分析表
2.3 模拟验证实验
为进一步确定计算结果,按最佳条件进行3次重复实验,最终的凝乳酶活力分别为 1142.76、1142.86、1043.48SU/mL,平均值为 1109.7SU/mL,与预测值(1150.81SU/mL)基本一致,说明该方程与实际情况拟合很好,充分验证了所建模型的正确性,说明响应面法适用于对微小毛霉产凝乳酶的发酵培养基进行回归分析和参数优化。并且优化后所测得的凝乳酶活力要比单因素实验所测得的凝乳酶活力值高,说明可以用此方法对微小毛霉的发酵培养基进行优化。
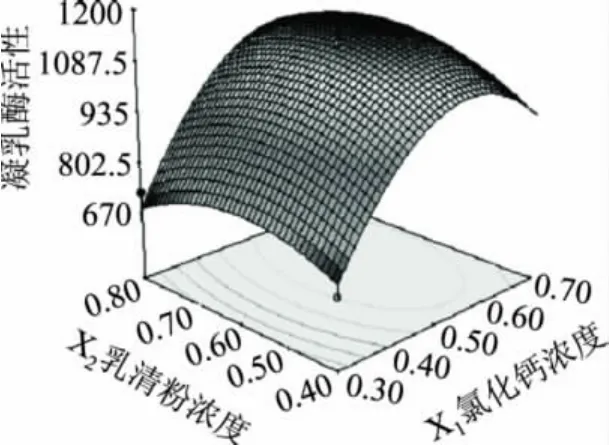
图1 Y=f(X1,X2)的响应面图

图2 Y=f(X2,X3)的响应面图
3 结论
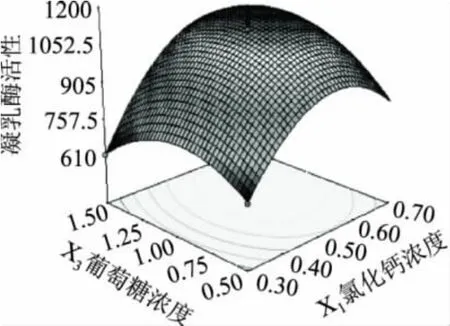
图3 Y=f(X1,X3)的响应面图
本实验通过对微小毛霉的发酵培养基进行了优化,提高了微小毛霉凝乳酶的凝乳活力。利用模型的响应面对影响凝乳酶活性的关键因子及其相互作用进行探讨,优化出微小毛霉产酶发酵培养基中CaCl2、乳清粉和葡萄糖的最佳浓度分别为0.58%、0.64%和1.13%,在该最佳培养条件下,微小毛霉产凝乳酶的活性的理论值为1150.81SU/mL,验证平均值为1109.7SU/mL,与预测值基本一致,证明此模型是合理可靠的,可用于实际预测,为科研工作者进一步筛选产凝乳酶的优良菌株提供依据。
[1]Supannee Chitpinityol,M James C.Crabb Chymosin and proteinases[J].Food Chemisry,1998,6199(4):395-418.
[2]钟继才.凝乳酶在干酪生产中的应用[J].中国乳品工业,2006,36(1):54-56.
[3]姜峰,张兰威.我国凝乳酶特性及其替品的研究现状[J].食品研究与开发,2003,24(6):3-6.
[4]周俊清,林亲录,赵谋明.微生物源凝乳酶的究进展[J].中国食品添加剂,2004(2):6-9.
[5]Grag A K,Johri B N.Rennet:current trends and futurere seareh[J].Food Reviews International,1994,10(3):313-355.
[6]钱世钧,张纯青,矫庆华,等.微小毛霉凝乳酶的纯化和性质[J].微生物学报,1989,29(4):272-277.
[7]张红梅.凝乳酶的研究进展综述[J].同济大学学报:医学版,2004,25(3).
[8]曾剑超.国内凝乳酶的研究应用及其替代品的研究发展[J].开发与研究,2008,25(1):13-16.
[9]韩玲玲,潘道东.根霉产凝乳酶的固态发酵条件的研究[J].食品科学,2010,31(9):156-160.
[10]叶为标.根霉产凝乳酶发酵条件的研究[J].食品研究与开发,2007,128(8):53-57.
[11]张娜,郭庆启,赵新淮.表面毛霉成熟干酪制备工艺优化
[J].食品工业科技,2010,31(1):210-212,216.
[12]李玉秋,王景会,李铁柱,等.重组微小毛霉凝乳酶的发酵条件及其酶学性质[J].食品科学,2010,31(19):225-230.
[13]Hideyuki K,Kazuo.Rapid and large scale lsolation of chymosin by pepstatin-aminohexy lagarose[J].Agric Bid Chem,1978,42(2):2227-2231.
Optimization of fermentation medium to producing chymosin by Mucor pusillus
ZHANG Li-hong1,2,WANG Xin1,PIAO Shan-shan1,ZHENG Li1,2,YANG Zhen-nai1,2,*
(1.School of Biological and Agricultural Engineering Jilin University,Changchun 130024,China;2.Northeast Agricultural Research Center of China,Jilin Academy of Agricultural Sciences,Changchun 130033,China)
Optimization of the medium for fermentation by Mucor pusillus to produce chymosin was carried out by response surface analysis to increase the activity of milk-clotting enzyme(MCE).Based on the single factor test,the polynomial regression analysis was performed on the experimental data by using Design-Expert software and the functional relationship between the three primary components and the MCE activity were built.The optimal values of the factors were obtained:CaCl2was 0.58%,whey powder was 0.64%,glucose was 1.13%.Under the optimized conditions,the theory value of Mucor pusillus MCE activity was 1150.81SU/mL,and the average value tested was 1109.7SU/mL which was similar to the theory value.
chymosin;Mucor pusillus;fermentation medium;optimization
TS201.3
A
1002-0306(2011)09-0214-04
2011-04-22 *通讯联系人
张丽红(1985-),女,硕士,研究方向:食品科学。
863现代农业探索导向项目(2006AA10Z306);农业部现代奶牛产业技术体系乳制品加工专项、科学前沿与交叉学科创新项目(200903276)。
