莲房原花青素的提取纯化技术研究
2011-10-24蒋益虹
崔 倩,蒋益虹,戴 蕾,林 颖
(浙江大学生物系统工程与食品科学学院,浙江杭州 310029)
莲房原花青素的提取纯化技术研究
崔 倩,蒋益虹*,戴 蕾,林 颖
(浙江大学生物系统工程与食品科学学院,浙江杭州 310029)
对莲房原花青素的提取纯化工艺条件进行了研究,得到较优提取工艺为:提取温度50℃,提取溶剂60%乙醇,料液比1∶30,提取时间30min。采用大孔吸附树脂D-101、DA-201、DM-301和聚酰胺树脂对原花青素进行纯化,结果表明,大孔树脂DA-201对莲房原花青素有较好的吸附和洗脱效果,以70%乙醇为洗脱剂,初步得到纯化的莲房原花青素,洗脱率为84.1%。
莲房,原花青素,提取,纯化
莲房为莲科药用植物莲(Nelumbo Nucifera Gaertn.)的成熟花托(又名莲蓬壳,Seedpod of the Lotus,简称LS)。莲花历史悠久,我国约有二百种不同种型的莲。莲在我国种植广泛,据报道,1999年种植面积就已经超过了40000hm2[1]。莲子和莲藕是人们喜爱的食品,而莲房经常都被当作废弃物大量丢弃。《本草纲目》中记载,荷花、莲子、莲衣、莲房、莲须、莲子心、荷叶、荷梗、藕节等均可药用。莲房体轻,质疏松,纵向破开多裂隙似海绵,棕色。莲房中含有蛋白质、脂肪、糖类、粗纤维、胡萝卜素、VB、尼克酸、VC及微量莲子碱等多种化学成分[2],为传统中药材,具有消淤、止血祛湿之功效。近年报道,莲房中富含原花青素——莲房原花青素(procyanidins of lotus seedpod,简称LSPC),是莲房的主要活性成分之一。现代生物活性研究表明,LSPC具有较强的清除自由基和抗脂质过氧化活性[1]、抗心肌缺血[3]、调节血脂[4]、抑制癌细胞生长[5]及防辐射[6]等多种生物活性和药理作用。然而,目前国内外对于莲房原花青素的研究多集中在活性功能方面。本研究旨在建立较完善的莲房原花青素的提取、纯化方法,为莲房资源的综合利用开发提供依据。
1 材料与方法
1.1 材料与仪器
莲房 将一定量新鲜(去籽)莲房清洁干净,撕片,65℃干燥至恒重,粉碎,过100目筛,于干燥避光处保存备用;儿茶素对照品 中国药品生物制品检定所;聚酰胺树脂 浙江省台州市路桥四甲生化塑料厂;大孔吸附树脂 DA-201、DM-301、D-101 天津市海光化工有限公司;无水乙醇、NaOH、冰乙酸等分析纯。
722型可见分光光度计 上海光谱仪器有限公司;循环水式多用真空泵 上海豫康科教仪器设备有限公司;HL-2恒流泵 上海精科实业有限公司;Z系列层析柱、BS-100A自动部分收集器 上海沪西分析仪器厂有限公司。
1.2 原花青素含量的测定(香草醛法)
1.2.1 标准曲线 精确称取儿茶素对照品约10mg,用蒸馏水溶解后,转移到10m L容量瓶中定容,摇匀,作为母液备用。分别精密吸取 0、0.5、1.0、1.5、2.0、2.5m L标准品母液,置于10m L容量瓶中,加蒸馏水至刻度,摇匀。用香草醛法(取1m L样品于10m L具塞玻璃管中,加入2.5m L浓度为30g/L的香草醛-甲醇溶液,再加入2.5m L浓度为30%的硫酸-甲醇溶液,摇匀,避光反应10m in,以去离子水为空白,在最大吸收波长500nm处测定吸光值),以浓度为纵坐标,吸光值为横坐标,得出回归方程。
所取标准液的浓度和吸光度值数据经回归处理,计算得回归方程为 y=2.2868x+0.023,R2=0.9998;其中x为儿茶素浓度,y为波长500nm处测定的吸光度值。结果表明儿茶素浓度在0.052~0.26mg/m L范围内与吸光度值线性关系良好。
1.2.2 原花青素含量测定 取1m L样品于10m L具塞玻璃管中,加入2.5m L浓度为30g/L的香草醛-甲醇溶液,再加入2.5m L浓度为30%的硫酸-甲醇溶液,摇匀,避光反应10m in,以去离子水为空白,在最大吸收波长500nm处测定吸光值[7]。
1.3 莲房原花青素的提取
准确称取莲房粉末2g,加入一定量一定浓度的乙醇溶液,于一定温度(水浴)提取一次,每5min振摇一下。提取一定时间后进行抽滤,滤液定容至100m L,取4m L再定容至50m L,取1m L测定原花青素含量。
1.4 莲房原花青素的柱层析纯化
1.4.1 树脂的筛选 选择4种树脂,树脂用95%乙醇浸泡24h,用蒸馏水洗至无酒精味;再用1%NaOH浸泡3~4h,滤掉上层碱液,以蒸馏水洗至中性;用4倍量10%醋酸浸泡3~4h,再用蒸馏水洗至中性并浸泡备用[8]。
准确称取处理好的树脂10g(抽滤去除树脂表面水分),置于200m L三角瓶中,加入40m L原花青素粗提液,置于气浴恒温振荡器,30℃、120r/min振荡24h。取上清液 2m L用蒸馏水定容至 50m L,在500nm处用香草醛法测定滤液的吸光值[9]得到静态吸附率。取吸附平衡的树脂,用蒸馏水冲洗树脂至滤液无色,置于三角瓶中加入100m L 90%乙醇洗脱树脂,于气浴恒温振荡器30℃、120 r/m in振荡24h,测定洗脱液的吸光度得到静态解吸率。通过对吸附量、吸附率和解吸率的比较选择一种合适的树脂。
1.4.2 静态吸附与解吸附
1.4.2.1 静态吸附动力学测定 称取已处理好的树脂10g,置于200m L三角瓶中,加入40m L原花青素粗提液,不时振荡,每隔30min取1m L溶液定容至10m L,用香草醛法在500nm测定吸光值,连续测定4h左右,观察树脂对原花青素的吸附量与时间的关系。
1.4.2.2 静态吸附等温线测定 称取6份已处理好的大孔树脂DA-201,各2.5g,分别置于100m L三角瓶中,加入10m L不同浓度的原花青素粗提液,摇床振荡(30℃、120r/min),1h后取 1m L溶液定容至10m L,用香草醛法在500nm处测定吸光值。
1.4.3 动态吸附与解吸附
1.4.3.1 层析柱的制备和上样 称取80g备用树脂DA-201,湿法装入内径25mm、高40cm的玻璃交换柱中,树脂层高度约为25cm。待层析柱中的蒸馏水流尽后,室温下以上样流速0.8m L/m in进样,进样浓度为2.33mg/m L的原花青素粗提液150m L。
1.4.3.2 层析柱的洗脱 室温下用相同的流速上蒸馏水,洗下树脂中水溶性的杂质。大约100m L蒸馏水可洗脱干净。待水洗流出液为无色后,用50%的乙醇溶液冲洗树脂吸附柱,洗脱液以0.8m L/m in的速度洗脱,采用部分收集器每5m in收集一管,按顺序记为1,2,3……36,再用可见光分光光度计于波长500nm处用香草醛法检测吸光值,观察洗脱出峰情况。
1.4.3.3 比较不同浓度乙醇的洗脱效果 按照上文所述的上样方法上样,吸附结束后,先用100m L的蒸馏水洗去水溶性杂质,再分别选用50%、70%、90%乙醇溶液作为洗脱剂,以0.8m L/m in的洗脱速度对吸附饱和的大孔树脂进行洗脱。收集洗脱流出液测定原花青素含量,计算洗脱率。
2 结果与分析
2.1 莲房原花青素提取工艺的研究
2.1.1 单因素实验 在其它条件相同的情况下,乙醇浓度、提取温度、时间和料液比对提取效果的影响结果见图1~图4。

图1 乙醇浓度对莲房原花青素提取率的影响

图2 温度对莲房原花青素提取率的影响
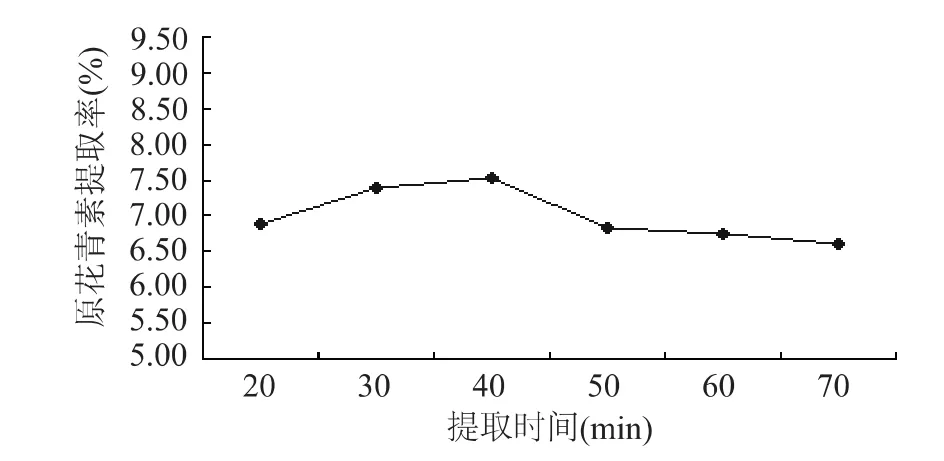
图3 提取时间对莲房原花青素提取率的影响
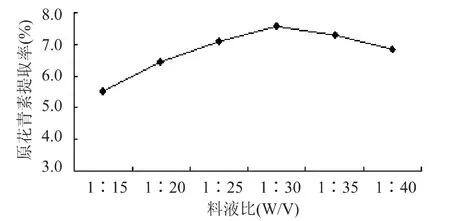
图4 料液比对莲房原花青素提取率的影响
由图1可见,乙醇浓度达到60%时,原花青素的提取率最高,再升高原花青素提取率已略有下降的趋势,分析产生这种现象的原因可能是随着乙醇浓度的增大,一些醇溶性杂质、亲脂性强的成分溶出量增加,这些成分与原花青素竞争同乙醇-水分子结合,从而导致提取率降低[10]。图2表明,随着温度的升高,原花青素的提取率有升高的趋势,但是在工业中温度的升高需要付出较大的成本,而且温度升高容易破坏一些活性成分,因而选择50~60℃比较合适。由图3可见,时间对提取率的影响不大,20m in基本已经达到提取完毕的效果,随着时间的延长,提取率反而有减少的现象,很可能是原花青素长时间加热被破坏。图4表明,料液比从1∶15到1∶30,提取率有显著的增长,而之后再增加溶剂体积,提取率开始下降,因此认为1∶30为合适的料液比。
2.1.2 正交实验 在单因素实验的基础上,应用正交实验四因素三水平设计,考察提取温度、乙醇浓度、料液比、提取时间对莲房中原花青素提取效果的影响,并分析得到较优的实验组合。因素水平安排如表1。

表1 因素水平表
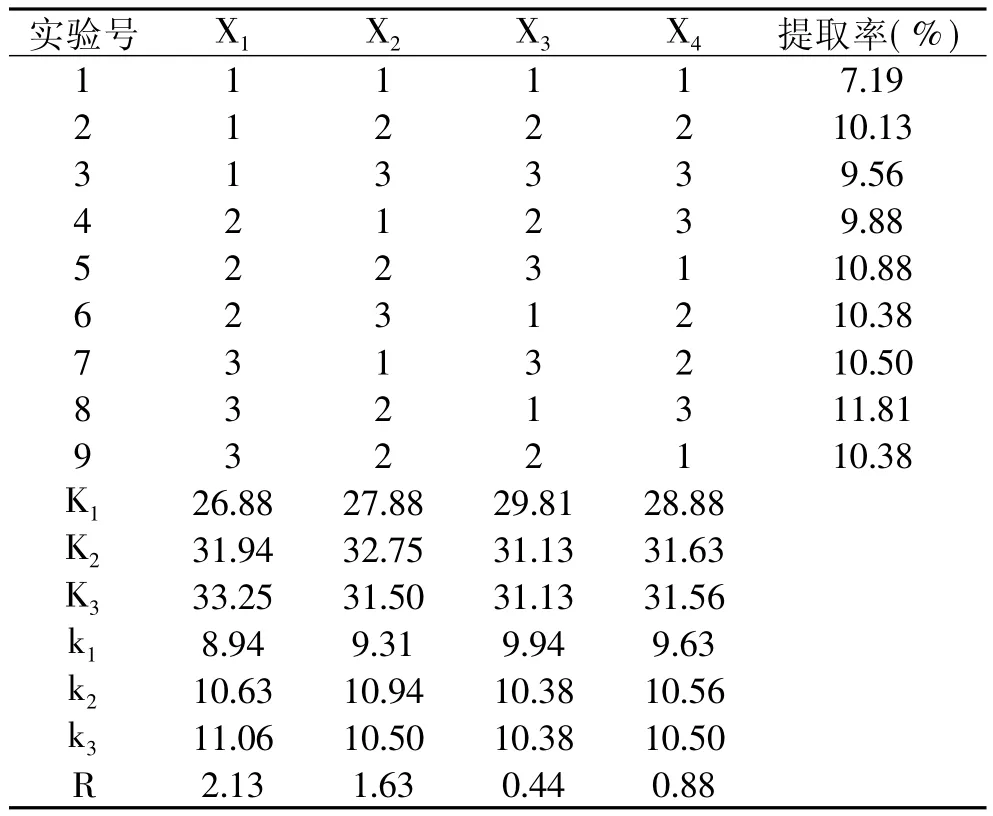
表2 正交实验方案及结果
由表2实验结果可见,莲房中原花青素的最佳提取工艺为:提取温度50℃,提取溶剂60%乙醇,料液比1∶30,提取时间30m in。各种因素对提取效果影响的主次顺序依次为乙醇浓度>提取温度>料液比>提取时间。通过极差分析检验可知,4种因素对提取率均有影响。
2.2 莲房原花青素的柱层析纯化
2.2.1 树脂的筛选结果 根据表3,聚酰胺树脂的吸附率与吸附量均最大,但是解析率最小,这对于原花青素原料会有很大的浪费,且不利于树脂的重复利用;D-101的解析率最高但是吸附率最小,会导致纯化的效率低下;综合考虑吸附率与解析率,认为大孔树脂DA-201为最佳的选择。

表3 不同树脂对莲房原花青素的吸附与解析
2.2.2 大孔树脂DA-201的静态吸附与解吸附
2.2.2.1 吸附动力学 大孔树脂DA-201对原花青素的吸附率与时间的关系见图5。可以看出,大孔树脂DA-201的吸附速度很快,30m in基本已经达到吸附饱和,饱和吸附率在36%左右。因此应使吸附时间大于30m in,以确保吸附平衡。
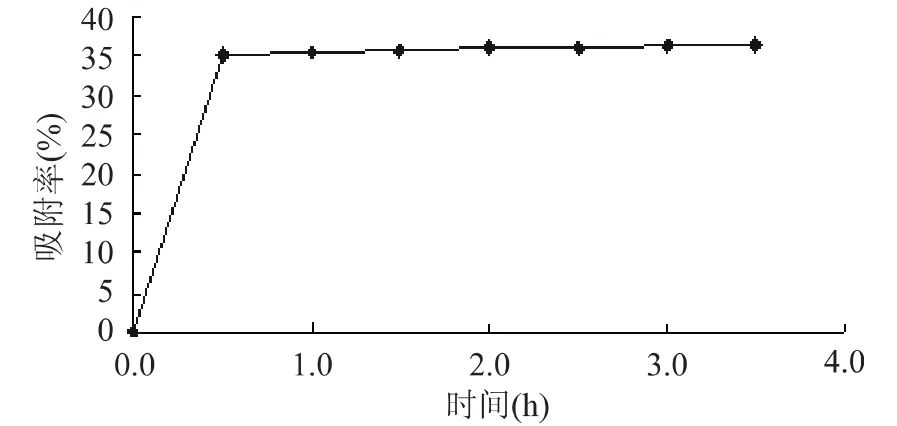
图5 大孔树脂DA-201对莲房原花青素的吸附动力学曲线
2.2.2.2 静态吸附等温线测定 不同浓度下树脂对原花青素的吸附量关系如图6。由图6可见,原花青素在树脂上的吸附量随着提取液浓度的增加而增大。但同时,吸附率会随着提取液浓度的增加而减小,所以选择浓度时要综合考虑。树脂的吸附率一般与上样溶液的浓度成反比,通常以较低浓度进行吸附较为有利,如果上样浓度偏高,则吸附率会显著减少[11]。
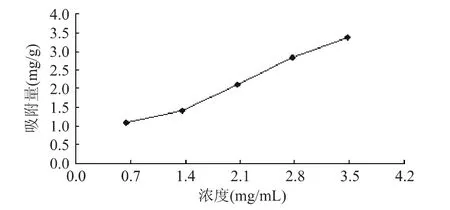
图6 大孔树脂DA-201对莲房原花青素的吸附等温线
2.2.3 大孔树脂DA-201的动态吸附与解吸附 动态上样的吸附曲线如图7。
由图7可见,当流出液为74m L时,树脂达到饱和吸附,饱和吸附量为3.4mg/g湿树脂。

图7 大孔树脂DA-201吸附动力学曲线
以原花青素浓度(mg/m L)对洗脱液体积(m L)作图得动态解吸曲线,如图8。
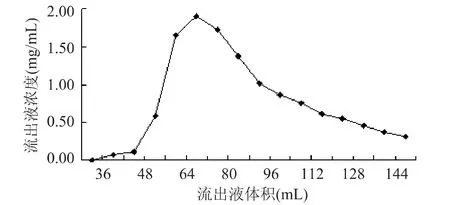
图8 洗脱曲线
从图8可见,乙醇溶液通过50m L左右时,原花青素开始被洗脱下来,然后迅速达到高峰,乙醇溶液通过120m L后,洗脱液浓度基本保持在一个低点,有拖尾现象。
2.2.4 比较不同浓度乙醇的洗脱效果 不同浓度乙醇的洗脱率见表4。

表4 不同浓度乙醇的洗脱效果
由表4可知,70%乙醇的洗脱能力高于其他2种浓度的乙醇溶液,为比较适合的洗脱剂,洗脱率可达84.1%。
分别合并收集到的洗脱液,在40℃减压蒸馏除去洗脱液中的乙醇和水,通过喷雾干燥可得原花青素产品为浅黄色粉末。
3 结论
3.1 对原花青素的提取条件进行了探讨,结果表明,莲房中原花青素的最佳提取工艺为:提取温度50℃,提取溶剂 60%乙醇,料液比1∶30,提取时间30m in。在此条件下,采用硫酸-香草醛法,以儿茶素为对照品,测定莲房粉中原花青素的干基含量为7.58%,比一般葡萄籽原花青素的得率(4.6%)高,因此它是一种新的、很有应用前景的原花青素生产原料。
3.2 综合 3种大孔吸附树脂 D-101、DA-201、DM-301和聚酰胺树脂的静态吸附-解吸附性能,可以看出,大孔吸附树脂DA-201是最合适的原花青素纯化树脂,具有吸附快、易解吸等特点。
3.3 以DA-201为填充料制备层析柱,上样流速0.8m L/m in,2.33mg/m L的原花青素粗提液达到吸附饱和的时间为92m in,湿树脂的动态饱和吸附量为3.4mg/g。相同流速下,100m L的蒸馏水可以洗去溶于水的杂质。
3.4 分别选用50%、70%、90%乙醇溶液作为洗脱剂,得到洗脱率最高的为70%的乙醇。上柱液浓度为2.97mg/m L,流速为0.8m L/m in时,70%的乙醇溶液洗脱率达到84.1%,且出峰快,但有拖尾现象。
[1]ZHI-QUN LING,BI-JUN XIE,ER-LING YANG.Isolation,Characterization,and Determination of Antioxidative Activity of Oligomeric Procyanidins from the Seedpod of Nelumbo nucifera Gaertn[J].J Agric Food Chem,2005,53:2441-2445.
[2]凌智群.莲房原花青素及其生物、药理活性研究[D].华中农业大学,2001.
[3]凌智群,谢笔钧,江涛,等.莲房原花青素对大鼠实验性心肌缺血的保护作用[J].中国药理学通报,2001,17(6):687-690.
[4]唐瑛,黄光华,吴建军.莲房原花青素对高脂血症大鼠脂质过氧化及内皮素的影响[J].华南国防医学杂志,2008,22(4):9-11.
[5]张海晖,段玉清,陈乾.莲房原花青素体外抗肿瘤作用研究[J].食品科技,2007(10):251-254.
[6]段玉清,张海晖,唐瑛,等.莲房原花青素对60Co-γ射线致免疫器官损伤的防护作用[J].食品科学,2006,27:220-222.
[7]石翠芳,孙智达.沙枣果肉原花青素的分离纯化[J].食品与发酵工业,2007,33(4):137-140.
[8]吴朝霞,孟宪军,吴朝晖.聚酰胺柱层析提纯原花青素及其产物清除·OH自由基能力的研究[J].食品科学,2005,26(8):113-116.
[9]赵平,宋学娟,张月萍.大孔树脂对葡萄籽原花青素的吸附研究[J].中国中药杂志,2007(10):2197-2200.
[10]C Prieur,J Rigaud,V Cheynier,et al.Oligomeric and polymeric procyanidins from grape seeds[J].Phytochemistry,1998,36(3):781-784.
[11]黎海彬,李小梅.大孔吸附树脂及其在天然产物研究中的应用[J].广东化工,2005(3):22-25.
Study on the extraction and purification of procyanidins from the seedpod of Nelumbo nucifera Gaertn.
CUI Qian,JIANG Yi-hong*,DAILei,LIN Ying
(Bioengineering & Food Science College of Zhejiang University,Hangzhou 310029,China)
The extraction and purification technology of the procyanid ins from the seedpod of Nelumbo nucifera Gaertn.were studied.The optimum extraction conditions were as follows:extraction temperature 50℃,ethanol concentration 60%,the ratio of sample to solvent volume(W/V)1∶30,extraction time 30m in.Under this condition,the yield of procyanid ins was 7.5%.The procyanid ins were further purified with macroporous resins D-101,DA-201,DM-301 and polyamide resin,the results showed that the resin DA-201 had better adsorption and elution of procyanid ins from the lotus seedpod.The ratio of stripping was 84.1%when eluting with 70%ethanol.
lotus seedpod;procyanidins;extraction;purification
TS201.2
B
1002-0306(2011)08-0238-04
2010-01-15 *通讯联系人
崔倩(1985-),女,硕士研究生,从事天然产物方面的研究。
浙江省教育厅课题(N20080086);浙江省科技厅项目(N20080439)。
