谷氨酸棒杆菌耐高温驯化及发酵条件研究
2011-10-24康传利张伟国葛向阳周杰民
康传利,张伟国,葛向阳,周杰民
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
谷氨酸棒杆菌耐高温驯化及发酵条件研究
康传利,张伟国*,葛向阳,周杰民
(江南大学工业生物技术教育部重点实验室,江苏无锡 214122)
通过逐级传代驯化的方式,逐步提高菌体的耐高温性能。经过多次驯化,获得一株耐高温菌株,并且在发酵过程中最大菌浓、产酸率、糖酸转化率均有提高。在此基础上,又对该菌的发酵条件进行了初步优化。首先对发酵温度进行了优化,发现最适发酵温度为36℃。然后又采用Plackett-Burman实验,找出影响发酵最大的三个因素:玉米浆、葡萄糖和磷酸氢二钾。最后又进行了三因素三水平的响应面实验,得到三个重要影响因素的最佳浓度为葡萄糖161.98g/L,玉米浆3.64g/L,磷酸氢二钾1.51g/L。在此培养条件下,用7L罐发酵,最终产酸达114.2g/L,糖酸转化率达61.4%。
谷氨酸棒杆菌,耐高温,驯化,Plackett Burman设计,响应曲面法
L-谷氨酸是非必需氨基酸,也是世界上销售量最大的氨基酸,而我国是谷氨酸生产第一大国。目前,我国的味精相关产品发展迅速,产量高居世界首位,年需求量为119万 t。味精年人均占有量为769g,而台湾和港澳地区为 2500g,两者相差甚远[1],市场需求较大,发展前景广阔。在夏季高温季节,要控制谷氨酸发酵温度为32℃,需采取一系列的降温措施,这无形中增加了生产的成本。特别是我国南部的味精厂,提高菌株的耐高温性能可减少因维持发酵温度所造成的能源浪费。为了减少降温所带来的费用和麻烦,筛选耐高温菌是行之有效的方法[2]。况且在较高的温度下,菌种体内的酶活较高,有利于L-谷氨酸的积累。已有很多关于谷氨酸菌种选育及发酵条件优化相关的报道,但有关提高谷氨酸菌种耐高温性能的报道很少。鉴于此,本文利用生物素缺陷型菌株为出发菌株,对其进行耐高温驯化与筛选,提高菌株对高温的耐受性,从而解决夏季L-谷氨酸发酵降温难、成本高的问题;然后又对其最适发酵温度进行了研究;而后采用Plackett-Burman设计法研究了发酵培养基中各成分对L-谷氨酸产率的影响,筛选出影响最显著的三个因素,又通过响应曲面实验确定三个营养成分的最佳浓度,以使其发酵性能得到充分的发挥。
1 材料与方法
1.1 实验材料
谷氨酸棒杆菌(Corynebacterium glutamicum)HCJ46 江南大学生物工程学院代谢调控与代谢工程研究室保藏菌种;葡萄糖 工业级,山东西王生化科技有限公司;玉米浆 华北制药康欣有限公司;尿素 上海生化试剂公司;K2HPO4·3H2O 中国医药集团上海化学试剂公司;FeSO4·7H2O、MgSO4·7H2O 鹰潭生物化学制品厂;MnSO4·4H2O 上海试剂二厂;完全培养基(g/L) 葡萄糖5、牛肉膏10、蛋白胨10、NaCl 5、琼脂 20,调 pH7.0~7.2,121℃下灭菌20min;种子培养基(g/L) 葡萄糖25、K2HPO4·3H2O 1.5、MgSO4·7H2O 0.4、玉米浆 35、尿素 5,调pH7.0~7.2,121℃下灭菌20min;发酵培养基(g/L)葡萄糖 140、K2HPO4·3H2O 2.0、MgSO4.7H2O 0.8、玉米浆 3.0、尿素 5.5,调 pH7.0~7.2,115℃ 下灭菌10m in。
1.2 实验方法
1.2.1 驯化方法 按 KiBeom Lee[3]和杨森莲[4]等的方法进行谷氨酸棒杆菌的驯化,驯化时开始选择温度32℃,在后面的实验过程中根据菌体生长情况逐渐提高培养温度(分别是34、36、37、38℃)。
1.2.2 平板分离方法 蘸取驯化后的发酵液于完全平板上划线,高温条件下(分别是34、36、37、38℃)培养20~24h,挑选生长较好的单菌落接种于保藏斜面中。
1.2.3 摇瓶初筛方法 将平板分离得到的菌株分别接种于摇瓶培养基中进行发酵,以原菌种作对照,每株 1 瓶,在高温条件下(分别是34、36、37、38℃)培养36h,淘汰产酸较低的菌株,将产酸较高的菌株进行保藏。
1.2.4 摇瓶复筛方法 将初筛得到的菌株分别接入种子培养基中,待其长到对数生长期后期,再以6%的接种量接入发酵培养基中,每株菌接三瓶,以原始菌株做对照,在高温条件下培养36h,保藏产酸最高的一株菌。
1.2.5 7L罐培养方法 发酵罐中装液量3.5L,接种量8%,通风2L/min,流加氨水控制pH7.0~7.2,通过流加泡敌消泡,发酵过程中视残糖情况补加800g/L的糖溶液。根据溶氧需求调节转速,发酵32h。
1.3 分析方法
1.3.1 pH测定 国产精密pH试纸和PHS-3C型精密pH计测定。
1.3.2 OD的测定 取发酵液稀释25倍后,在波长620nm条件下测量吸光度。
1.3.3 发酵液中还原糖及L-谷氨酸含量的测定 采用SBA-40C生物传感分析仪测定。
1.3.4 糖酸转化率的计算方法 糖酸转化率(%)=L-谷氨酸终浓度×发酵液终体积/(初糖总量+流加糖总量)×100%
2 结果与分析
2.1 谷氨酸棒杆菌的耐高温驯化[5]
首先对出发菌株的耐高温性能进行研究,如图1所示。由图1可知,当温度高于34℃时,发酵后期菌体衰亡严重,菌浓下降较大,并且随着温度升高,菌浓下降幅度越来越大,发酵过程中最大菌浓也逐渐变小。

图1 温度对出发菌株生长的影响
驯化选择的初始温度为33℃,平板、种子及发酵培养基均在此条件下培养。先培养种子,待其长到对数生长期后期,将其以6%的接种量接入发酵培养基中。待发酵培养基中的菌体长到稳定期,再转接到下一级种子培养基中,驯化过程中根据菌体生长情况逐渐提高培养温度[3]。
取未经驯化的菌体和驯化后的菌体接入发酵培养基,每4h取一次样,测定菌体量、产酸量和残糖,并对其进行比较,结果如图2。经过多次驯化,菌体生长速率加快,最大菌体量也有所增加,但未经驯化的菌体在高温条件下培养,后期菌体衰亡严重,驯化后的菌体基本无衰亡现象。驯化后葡萄糖消耗速率也明显增加,这可能由于经过驯化,菌体量逐渐增加,从而导致耗糖速率加快,而且提高温度后菌体内代谢旺盛,耗糖速率更快。由图2可知,驯化后菌体已适应高温环境,产酸速率明显加快,特别是发酵后期产酸速率较驯化前有较大提高,这可能由于经驯化后的后期菌体衰亡不明显,仍能保持极高的发酵强度,最终产酸为95.5g/L。

图2 驯化前后菌浓、残糖及L-谷氨酸产量变化曲线
由以上讨论可以看出,驯化后菌株的发酵情况明显好于驯化之前的菌株,菌种逐步适应高温的生长环境。这说明微生物具有一定的适应环境的能力,对环境的变化,微生物细胞内的代谢会进行自我调节,使其适应新环境[6]。
2.2 L-谷氨酸发酵条件优化
2.2.1 L-谷氨酸发酵最佳温度的选择 在影响细菌生长和产酸的因素中,温度起着重要作用。为了使微生物生长最快和产酸率最高,必须根据菌种的特性,选择和控制最适的培养温度。如果温度控制过低,菌体生长慢,酶活低,不利于菌体生长和产酸。若温度控制过高,虽能提高酶反应速率,但易引起菌种衰老,影响最终产酸[7]。
主要考察了 33、34、35、36、37、38℃六个温度水平下L-谷氨酸的发酵情况,结果见图3。由图3可知,当温度控制在36℃时产酸率和转化率均较高,故选择发酵温度为36℃。由此可见,经过耐高温驯化,菌株发酵的最适温度得到了提高(驯化前最适发酵温度为32℃),从而进一步提高了该菌株的产酸水平。
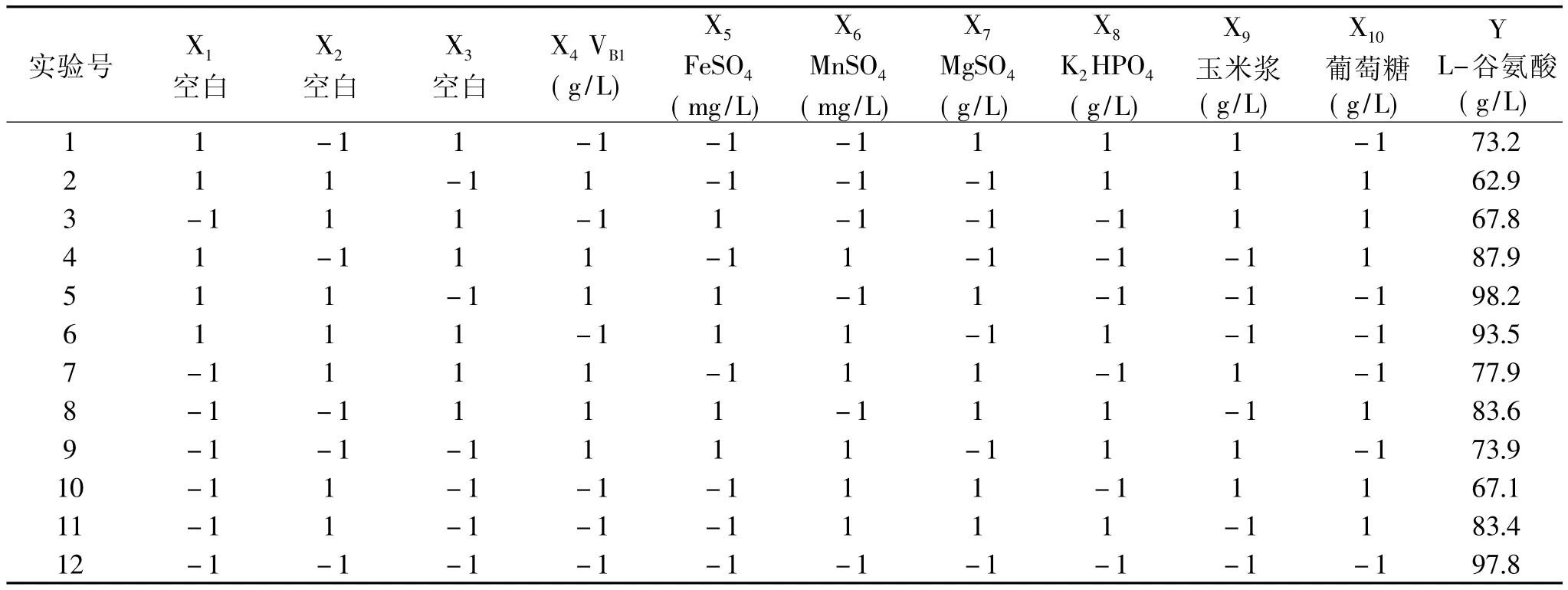
表1 Plackett Burman实验设计及结果

图3 温度对L-谷氨酸发酵的影响
2.2.2 Plackett-Burman 实 验 设 计 及 分 析[8-10]Plackett-Burman设计法是一种两水平实验优化法,它可以用最少的实验次数,从众多影响因素中快速地筛选出影响最显著的几个因素,为进一步的研究提供指导[11]。实验考察葡萄糖、玉米浆、磷酸氢二钾、硫酸镁、硫酸锰、硫酸亚铁、VB1七个因素对L-谷氨酸发酵的影响,以L-谷氨酸产量为响应值,比较各因素对最终产酸的影响,实验设计及结果见表1。Xn分别代表各因素,因实验只考虑7个因素,其余3因素(X1、X2、X3)均为虚拟项,用以估计实验误差。各因素所代表的水平及相对重要性见表2。

表2 Plackett-Burman实验设计各因素、水平及相对重要性
表2中P值越小,说明该因素对产酸的影响越显著,即葡萄糖、玉米浆和磷酸氢二钾3个因素对L-谷氨酸产量有显著影响,故选择这三个因素进行响应曲面实验,进一步研究它们对产酸的影响。
2.2.3 响应面法实验设计及结果[12-14]由前面的Plackett-Burman实验可知,影响L-谷氨酸发酵的主要营养成分为葡萄糖、玉米浆和磷酸氢二钾。采用Box-Behnken中心组合,设计了三因素三水平的响应面分析方法,以L-谷氨酸产量为指标作响应面,以期找到各因素的最佳浓度,因素水平的见表3。

表3 实验因素水平表
用软件Design expert7.1进行实验设计,共进行17次实验,17个实验点可分为两类,一类是析因点,即自变量取值在X1、X2、X3所构成的三维顶点,一共有12个析因点;另一类称为零点,为响应面区域的中心点,零点实验重复5次,用于实验误差估计,实验结果见表4。

表4 响应面实验设计及实验结果
根据上述实验结果,以L-谷氨酸的产量Y为响应值,利用Design Expert7.1软件对表4进行二次多元回归拟合,得到L-谷氨酸产量对编码自变量X1,X2,X3的二次多项回归方程:Y=101.13+17.27X1-1.49X2+2.49X3+2.84 X1X2-0.71X1X3-0.97X2X3-13.32-5.18-5.07。回归分析表明,大于F值的概率(Pr>F)小于0.0001,说明回归方程的显著性及可靠性极高;该决定系数R2=0.9831,这表示方程的拟合度较高,可用于分析和预测L-谷氨酸产量。本设计实验中 CV=2.32%,较低,说明实验操作可信。
应用Design-Expert7.1软件将二次回归模型进行规范分析,得到三个影响因子相互之间的响应面立体图,见图4~图6。通过该组图可以了解任何两因素对L-谷氨酸积累的交互影响。

图4 玉米浆(X1)及磷酸氢二钾(X2)对L-谷氨酸发酵影响的响应面图

图5 玉米浆(X1)与葡萄糖(X3)对L-谷氨酸发酵影响的响应面图

图6 磷酸氢二钾(X2)与葡萄糖(X3)对L-谷氨酸发酵影响的响应面图
由图4~图6可知,回归模型存在稳定点,稳定点即最大值,利用回归方程分别对X1、X2、X3求偏导,令导数等于0,得到的最佳点:X1=0.645,X2=0.013,X3=0.198,Y=106.932。换算成实验条件:葡萄糖161.98g/L,玉米浆 3.64g/L,磷酸氢二钾 1.51g/L,L-谷氨酸产量最高值为106.932g/L。为了验证预测值与实际值之间的拟合程度,以上面三因子的最优浓度进行摇瓶实验,五次实验后测得L-谷氨酸产量接近,平均值为105.6g/L,与预测值十分相近,证明了该模型具有很高的可信度。
2.3 优化条件下的耐高温菌株发酵过程曲线
在优化的条件下,经7L罐发酵,发酵过程中菌浓(OD620)、残糖(Rg)及产酸(Glu)变化情况见图7。由该图7可知,菌体生长基本无延滞期,发酵后期菌体衰亡不严重,最大OD达1.05。在整个发酵过程中均能保持较高的耗糖速率和产酸速率,最终产酸达114.2g/L,糖酸转化率为61.4%,达到了高产率和高转化率的统一。
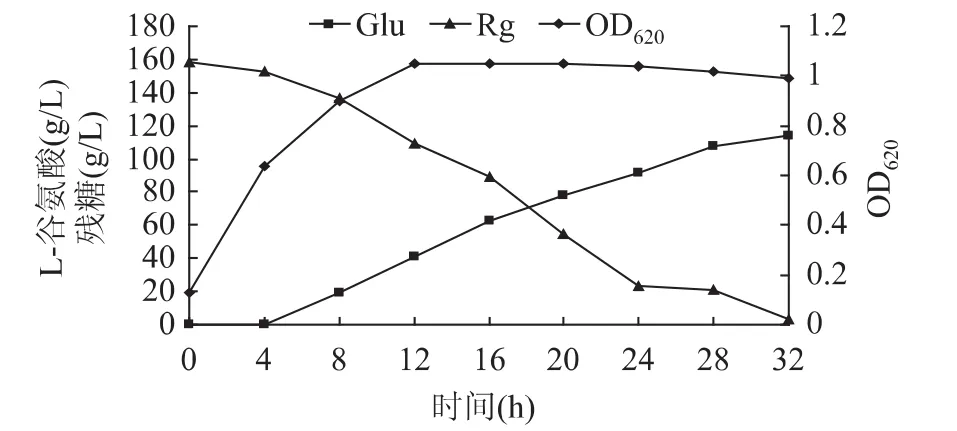
图7 优化条件下的发酵过程曲线
3 结论
以生物素缺陷型菌株为出发菌株,经过耐高温驯化,使其耐高温性能得到提高,并且发酵过程中最大菌浓、产谷氨酸量和糖酸转化率均有提高。然后对其发酵条件进行了初步优化,首先对其最适发酵温度进行了研究,发现36℃为最适发酵温度。而后采用Plackett-Burman设计实验,结果表明玉米浆、葡萄糖和磷酸氢二钾对L-谷氨酸发酵影响最显著。在此基础上,又采用三因素三水平的响应面方法对发酵培养基继续优化,得到三个重要影响因素的最佳浓度为葡萄糖161.98g/L,玉米浆3.64g/L,磷酸氢二钾1.51g/L。在此培养条件下,用7L罐发酵,最终产酸达114.2g/L,糖酸转化率达61.4%。
虽然通过本研究提高了菌体的耐高温性能,但发酵过程中采取单一的温度控制方式(36℃)不能取得最佳的发酵结果,因为菌体生长的最适温度和产酸的最适温度不同。所以在以后的研究中还要对分阶段温度控制策略进行深入探讨。
[1]李华玮,苏庆辉,李志江,等.谷氨酸生产行业现状综合分析[J].农产品加工,2005(8):65-67.
[2]马立安,贺飞英.耐高温柠檬酸菌种驯化及筛选[J].中国酿造,2007(11):57-58.
[3]KiBeom Lee.Enhanced production of lactid acid by an adapted strain of Lactobacillusdelbrueckii subsp.Lactis[J].World J Microbiol Biotechnol,2007(23):1317-1320.
[4]杨森莲,张克旭,陈宁.谷氨酸温度敏感突变株的驯化及发酵条件研究[J].中国酿造,2006(7):18-20.
[5]王昌魁,张利莉,贺江舟,等.耐高温耐高糖酵母的筛选与驯化[J].江西农业学报,2008,20(5):100-101.
[6]赵宇星,周惠明,钱海峰.酸豆乳生产菌种的驯化研究[J].食品科技,2004(11):28-30.
[7]于信令,于军.氨基酸发酵生产的调控优化[J].发酵科技通讯,2006,35(1):28-30.
[8]卞芙蓉,劳兴珍,郑绗,等.酵母发酵生产谷胱甘肽的培养基优化[J].中国生化药物杂志,2009,30(3):184-186.
[9]毕静莹,卢丽娟,秦义,等.Plackett-Burman设计法筛选影响灵芝富锌能力的主要培养基组分[J].安徽农业科学,2010,38(10):5335-5337.
[10]YU Lei,LEI Ting,PEI Xiao-lin.Rapid Screen of Medium Components for L(+)Lactic Acid Production by Lactobacillus rhamnosus[J].Food Science,2007,28(11):382-385.
[11]Mohamed Hajji,Ahmed Rebai,Neji Gharsallah,et al.Optimization of alkaline protease production by Aspergillus clavatus ES1 in Mirabilis jalapa tuber powder using statistical experimental design[J].Appl Microbiol Biotechnol,2008,79:915-923.
[12]陈银芳.L-赖氨酸产生菌选育及其发酵条件的调控[D].江南大学,2009.
[13]刘春辉.L-谷氨酰胺产生菌选育及其代谢调控的初步研究[D].江南大学,2009.
[14]秦海斌,张伟国.金属离子及添加表面活性剂对谷氨酸发酵的影响[J].食品工业科技,2009,30(10):167-169.
Domestication of thermotolerant Corynebacterium glutamicum and study on its fermentation condition
KANG Chuan-li,ZHANG Wei-guo*,GE Xiang-yang,ZHOU Jie-m in
(Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi214122,China)
The thermotolerant property of Corynebacterium glutamicum was improved gradually via a passage transfer approach.After many times of domestication,a thermotolerant strain was obtained.And also,the maximum cell concentration,L-glutamic acid productivity,conversion rate had been increased in fermentation course.The fermentation condition of this strain was further studied.Firstly,the fermentation temperature was studied and found the optimal temperature was 36℃.Then,the top three factors were found out by Plackett-Burman experiment,which were corn steep liquor,glucose and K2HPO4.Finally,three factors and three levers of response surface experiment were carried out.The optimal concentrations of the three important factors were obtained,which were glucose 161.98g/L,corn steep liquor 3.64g/L and K2HPO41.51g/L.At the optimal conditions,the L-glutamic acid concentration reached 114.2g/L and conversion rate reached 61.4%in 7-L bioreactor.
Corynebacterium glutamicum;thermotolerant;domestication;Plackett Burman design;response surface methodology
TS201.3
A
1002-0306(2011)08-0188-05
2010-08-09 *通讯联系人
康传利(1984-),男,硕士研究生,主要从事菌种选育及发酵条件优化的研究。
国家“863”计划项目(2006AA020301)。
