TLR活化参与环孢素A诱发的慢性肾小管间质损伤
2011-10-24洪英礼金英顺崔镇花
洪英礼, 金英顺, 崔镇花, 陈 瑛, 李 灿
(延边大学附属医院肾内科,吉林 延吉 133000)
TLR活化参与环孢素A诱发的慢性肾小管间质损伤
洪英礼, 金英顺, 崔镇花, 陈 瑛, 李 灿△
(延边大学附属医院肾内科,吉林 延吉 133000)
目的探讨慢性肾小管间质损伤的免疫发生机制。方法Sprague-Dawley大鼠皮下注射环孢素A(CsA,15 mg·kg-1·d-1) 4周建立慢性肾小管间质损伤模型,对照组给予皮下注射橄榄油 (1 mL·kg-1·d-1)。检测两组大鼠的肾功能;三色染色和免疫组织化学染色确定肾小管间质损伤程度(炎性细胞浸润和带状纤维化);荧光原位杂交技术和免疫组织化学染色分别观察肾内Toll样受体(TLR)、TLR配基-热休克蛋白70 (HSP70)及补体系统成分(C3、C4d和C9)的表达。结果与对照组相比,肾毒性组表现为肾功能低下、肾间质大量ED-1阳性细胞浸润、肾小管间质带状纤维化(P<0.01)。同时,肾毒性组TLR2和TLR4的mRNA 和蛋白水平明显上调;TLR 配体 HSP70 免疫活性增加;补体C3、C4d和C9的免疫活性显著增加。这些高表达的免疫成份主要位于肾小管间质受损部位。结论激活的肾内天然免疫与CsA引起的慢性肾小管间质损伤有关。
肾小管间质损伤; 天然免疫; 受体,Toll样; 热休克蛋白质70; 补体; 环孢菌素
天然免疫(innate immunity)应答是机体防御感染性疾病的第一防线,天然免疫是由Toll样受体 (Toll-like receptor, TLR)及其配体所介导[1]。最近研究表明,TLR通过识别不同病原体的病原体相关分子模式(pathogen-associated molecular pattern,PAMP)在抗感染天然免疫中发挥作用。TLR可对PAMP 进行识别,引发的信号转导途径能导致炎症介质的释放,在天然免疫防御中起重要作用,并最终激活获得性免疫系统。因此,TLR控制着由天然免疫向获得性免疫的转变。然而,有关天然免疫引起肾损伤的报道甚少。
环孢素A(cyclosporine A, CsA)是一种强有力的免疫抑制剂,但长期使用可引起慢性 CsA 肾毒性,导致移植肾功能延迟(delayed graft function),限制了其在临床的使用。研究表明,慢性 CsA 肾毒性以慢性肾小管间质损伤为特点,表现为肾小管间质炎症和带状纤维化[2],其分子机制尚不完全明确,目前认为与炎症介质[3]、转化生长因子β1[4]等有关。本实验利用慢性 CsA 肾毒性动物模型旨在探讨:1)是否慢性肾小管间质损伤与肾内激活的天然免疫系统有关;2)是否补体系统参与了慢性肾小管间质损伤。
材 料 和 方 法
1动物模型
雄性Sprague-Dawley大鼠, 体重220-240 g, 喂食低盐饮食下(0.05 % sodium, Teklad Premier) 随机分成2组:对照组 (n=6):皮下注射橄榄油 (1 mL·kg-1·d-1, Sigma) 4周;CsA毒性组 (n=8) 皮下注射 CsA (15 mg·kg-1·d-1, Novartis Pharma) 4周。
2肾功能测定
监测2组大鼠的体重。处死大鼠前,将大鼠放入代谢笼中(Tecniplast Gazzada),采血、收集24 h尿,测定血清和24 h尿肌酐, 用以下公式计算肌酐清除率: (24 h尿量×尿肌酐/血清肌酐)/100 g BW。
3肾脏病理
肾组织由过碘酸-赖氨酸-多聚甲醛液(periodate-lysine-paraformaldehyde) 固定, 石蜡包埋后切片(厚4 μm)。脱蜡后行三色(Masson trichrome) 染色,观察肾小管间质纤维化。采用我们以往方法[5]评估肾小管间质纤维化程度,利用数字化显微镜分析仪(TDI Scope EyeTMVersion 3.0 for Windows, Olympus),每张切片上至少观察20个不同区域。在100倍显微镜下,获取图像,利用 Polygon Program定量地计算肾皮质受损部位的百分数。由2个观察者对每个样本随机进行盲法评分。
4免疫组织化学染色
免疫组化步骤如下:石蜡包埋的切片置二甲苯脱蜡和梯度乙醇中脱水, 室温下 (37 ℃) 0.3% H2O2/甲醛30 min处理后, PBS液洗3次。置微波炉中加热 5 min行抗原修复 (98 ℃),PBS 液洗3次。滴加非免疫性血清封闭液, 室温下进行20 min。PBS液洗3次后,在4 ℃下滴加Ⅰ抗孵育12-16 h (ED-1, Serotec Inc.; C3, Santa Cruz Biotechnology; C4d, Quidel Corporation; C9,由Cardiff大学Dr.B.P.Morgan提供;TLR2, Im-genex; TLR4, Santa Cruz; HSP70, Stressengen)。PBS 液洗3次后滴加Ⅱ抗, 室温孵育2 h。以DAB为底物显色, 呈棕黄色为止(具体调节时间)。自来水流水洗涤,复染苏木素,常规树脂封片。数字化显微镜分析仪(Polygon Program)定量地计算抗体染色的百分数和ED-1阳性细胞计数。
5TLR2、TLR4的原位杂交(insituhybridization)
利用 DIG RNA 标记的试剂盒制备TLR2、TLR4 特异探针,在石蜡包埋的切片按照常规方法进行原位杂交。具体方法如下:二甲苯脱蜡和梯度乙醇中脱水, 室温下 (37 ℃) 0.3% H2O2/甲醛30 min处理后, PBS液洗3次。置微波炉中加热5 min行波炉抗原修复 (98 ℃),PBS 液洗3次。分别置0.2 mol/L盐酸和1%Triton X-100液中15 min,室温下与10 mg/L蛋白酶K (Boehringer Mannheim) 浸渍20 min,2×SSC液冲洗后在含有50%除去离子的甲醛、4×SSC、2×Dehardt′s、1 g/L salmon-sperm DNA、1 g/L yeast transfer RNA液中与0.3 mg/L digoxigenin-labeled sense或antisense TLR2、TLR4特异探针过夜进行杂交。室温下切片0.1×SSC冲洗后,杂交过的探针用羊抗-DIG抗体(Fab)结合碱性磷酸酶标记,以NBT/X-磷酸酶(Boehringer Mannheim)显影。数字化显微镜分析仪(Polygon Program)定量地计算肾皮质显影部位的百分数。
6统计学处理
结 果
1慢性肾小管间质损伤
与对照组相比,在毒性组肾组织中,可以观察到大量ED-1阳性细胞浸润(83±14vs11±2,P<0.01), 见图1D、表1;还可见肾小管间质带状纤维化[(25±5)%vs(0±0)%,P<0.01], 见图1B、表1。同时,肾功能低下,表现为血肌酐的上升[(109.7±12.5)μmoL/Lvs(58.1±2.0)μmoL/L,P<0.01]和肌酐清除率的下降[(0.16±0.03) mL·min-1·100 g-1vs(0.57±0.05) mL·min-1·100 g-1,P<0.01], 见表1。以上结果表明肾小管间质严重受损。
表12组大鼠肾功能及肾小管间质损伤程度
Table 1. Renal function and quantitative analysis of tubulointerstitial fibrosis and inflammatory cell infiltration

SCr(μmol/L)CCr(mL·min-1·100g-1)TIF(%)ED-1-positivecellControl(n=6)58.1±2.00.57±0.050±011±2CsA(n=8)109.7±12.5∗∗0.16±0.03∗∗25±5∗∗83±14∗∗
**P<0.01vscontrol group. SCr: serum creatinine; CCr: creatinine clearance rate; TIF: tubulointerstitial fibrosis.

Figure 1. The degree of tubulointerstitial injury detected by Masson trichrome staining (A,B) and immunohistochemistry for ED-1(C,D). A,C: control group; B,D: CsA group.
图1肾小管间质损伤程度
2TLR2mRNA和蛋白的表达
如图2所示,正常肾组织中可以观察到TLR2 mRNA和蛋白的表达,主要位于肾小管上皮细胞,而肾间质没有TLR2的表达。与对照组相比,毒性组大鼠肾TLR2 mRNA和蛋白的表达明显增加,特别是在肾小管间质细胞或浸润细胞中高表达[mRNA:(18±3)%vs(6±2)%;蛋白:(23±5)%vs(6±3)%,P<0.01]。

Figure 2.Insituhybridization (A,B) and immunohistochemistry (C,D) for TLR2 mRNA and protein expression. A,C: control group; B,D: CsA group.
图2TLR2的RNA原位杂交
3TLR4mRNA和蛋白的表达
TLR4的表达情况与TLR2极为相似。与对照组相比,毒性组大鼠肾TLR4 mRNA和蛋白的表达明显增加[mRNA:(27±8)%vs(5±2)%;蛋白:(25±9)%vs(4±2)%,P<0.01],见图3B、D。

Figure 3.Insituhybridization (A,B) and immunohistochemistry (C,D) for TLR4 mRNA and protein expression. A,C: control group; B,D: CsA group.
图3TLR4的RNA原位杂交
4热休克蛋白70蛋白的表达
热休克蛋白70(heat-shock protein 70,HSP70)蛋白被认为是天然免疫的配体。免疫组化结果显示对照组肾髓质正常表达HSP70,皮质可以观察到少量HSP70蛋白。CsA 4周治疗后,肾髓质HSP70的表达不增加,而皮质HSP70的免疫活性明显增加[(75±10)%vs(10±6)%,P<0.01],见图4B。
5补体系统成分的表达
与对照组相比,毒性组补体C3、C4d和C9的免疫活性显著增加,主要是肾小管上皮细胞、间质细胞、浸润细胞,尤其是在肾小管间质受损部位[C3:(38±14)%vs(2±1)%;C4d:(30±3)%vs(5±3)%;C9:(35±11)%vs(9±6)%,P<0.01],见图5。
讨 论
TLR 是数年前研究果蝇胚胎发育中发现的背腹侧分化基因(dToll)编码的一种跨膜受体蛋白。哺乳动物的天然免疫分子Toll样受体是Toll样蛋白的同源体,在识别和抵御各种病原微生物中发挥作用,参与免疫反应。目前已被确认的成员共有10个[1]。最近学者发现,激活的TLR参与了肾缺血再灌注损伤[6]、慢性肾衰竭[7]、急性肾移植排斥反应和移植肾功能延迟[8],给予TLR抑制剂CpG-ODN明显改善小鼠系统性红斑狼疮性肾炎[9],确定TLR在肾损伤中的作用。本实验利用RNA原位杂交和免疫组化技术探讨天然免疫系统家族在肾小管间质的表达与分布。结果表明,对照组肾小管上皮细胞中仅有少量TLR2和TLR4 mRNA和蛋白的表达,而在毒性组其表达明显上调,位于近曲、远曲肾小管上皮细胞、间质细胞、浸润细胞。有趣的是,这些高表达主要分布于肾小管间质损伤部位。由此,我们推测激活的TLR2和TLR4 参与了CsA所致慢性肾小管间质损伤的天然免疫。
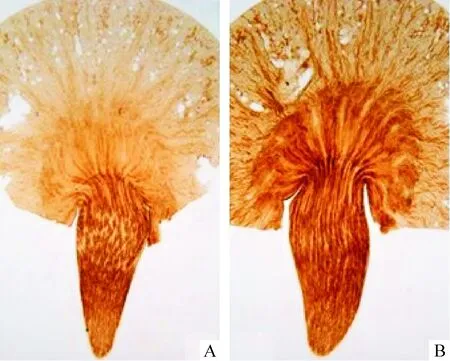
Figure 4. Immunohistochemistry for heat-shock protein 70. A: control group; B: CsA group.
图4热休克蛋白70的免疫组织化学染色
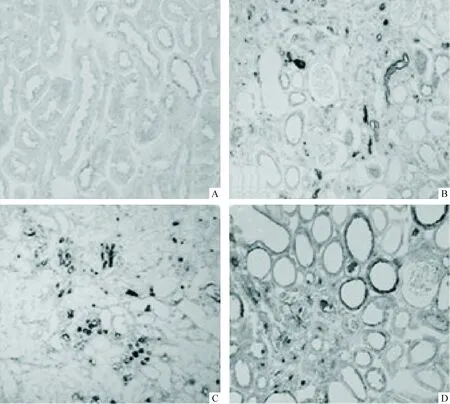
Figure 5. Immunohistochemistry for C3 (B), C4d(C)and C9(D). A: control group; B-D: CsA group.
图5补体系统成分的免疫组织化学染色
炎症细胞浸润、细胞外基质参与了慢性 CsA 肾小管间质损伤的过程。因此,受损的肾小管细胞和降解的细胞外基质可释放、产生大量的内源性物质如TLR配体。基于HSP70来源于受损细胞并参与内源性天然免疫调节作用[10],本研究检测HSP70的表达。结果表明,对照组肾皮质仅观察到少量HSP70蛋白,而在毒性组大鼠肾中,HSP70的表达显著上调,主要位于皮质、外髓质的肾小管上皮细胞、间质细胞,该部位正是CsA的损伤靶区域。综上所述, HSP70免疫活性增加可能协同TLR2和TLR4以自分泌或旁分泌方式参与了天然免疫反应,导致慢性肾小管间质损伤。
补体通过经典途径、甘露糖结合凝集素途径(mannan-binding lectin, MBL)或旁路替代途径被激活,从而参与天然免疫系统。其中,C3参与各种肾脏疾病的发展。Tang等[11]和Welch等[12]报道C3在正常肾组织中没有表达,仅在弥漫性炎症状态下或局灶节段硬化的肾组织中高表达。C4d被认为抗体介导的慢性移植肾病中排斥反应的一种标志物[13],但在其它疾病中如缺血再灌注肾损伤中亦有表达。C9即膜攻击复合物(membrane attack complex, MAC)是补体激活的终末产物,介导慢性肾小管间质损伤。本研究利用免疫组化检测C3、C4d和MAC(C9)在肾内的表达。结果表明,C3、C4d和C9的免疫活性明显增加,与TLR的表达相似,这些补体成分的高表达同样位于肾小管间质受损区域。激活的补体系统参与天然免疫介导的慢性肾小管间质损伤。此外,激活的TLR间接地诱导补体产生,因为TLR4敲除小鼠比野生型小鼠表现为低的C3水平[14]。
综上所述, 在CsA引起的慢性肾小管间质损伤中,CsA激活天然免疫系统导致免疫性肾损伤。本研究结果为各种非免疫性肾疾病中免疫性肾损伤的机制研究提供了分子理论基础。
[1] Janeway CA Jr, Medzhitov R. Innate immune recognition[J]. Annu Rev Immunol, 2002, 20(1):197-216.
[2] Li C, Yang CW, Park JH, et al. Pravastatin treatment attenuates interstitial inflammation and fibrosis in a rat model of chronic cyclosporine-induced nephropathy[J]. Am J Physiol Renal Physiol, 2004, 286(1):F46-F57.
[3] Li C, Yang CW, Kim WY, et al. Reversibility of chronic cyclosporine nephropathy in rats after withdrawal of cyclosporine[J]. Am J Physiol Renal Physiol, 2003, 284(2):F389-F398.
[4] Shihab FS, Andoh TF, Tanner AM, et al. Role of transforming growth factor-beta 1 in experimental chronic cyclosporine nephropathy[J]. Kidney Int, 1996, 49(4):1141-1151.
[5] Li C, Sun BK, Lim SW, et al. Combined effects of losartan and pravastatin on interstitial inflammation and fibrosis in chronic cyclosporine-induced nephropathy[J]. Transplantation, 2005, 79(11):1522-1529.
[6] Rusai K, Sollinger D, Baumann M, et al. toll-like receptors 2 and 4 in renal ischemia/reperfusion injury[J]. Pediatr Nephrol, 2010, 25(5):853-860.
[7 ] Gollapudi P, Yoon JW, Gollapudi S, et al. Leukocyte Toll-like receptor expression in end-stage lidney disease[J]. Am J Nephrol, 2010, 31(3):247-254.
[8] Gluba A, Banach M, Hannam S, et al. The role of Toll-like receptors in renal diseases[J]. Nat Rev Nephrol, 2010, 6(4):224-235.
[9] Graham KL, Lee LY, Higgins JP, et al. Treatment with a Toll-like receptor inhibitory GpG oligonucleotide delays and attenuates lupus nephritis in NZB/W mice[J]. Autoimmunity, 2010, 43(2):140-155.
[10]Vabulas RM, Ahmad-Nejad P, Ghose S, et al. HSP70 as endogenous stimulus of the Toll/interleukin-1 receptor signal pathway[J].J Biol Chem, 2002,277(17):15107-15112.
[11]Tang S, Sheerin NS, Zhou W, et al. Apical proteins stimulate complement synthesis by cultured human proximal tubular epithelial cells[J]. J Am Soc Nephrol, 1999, 10(1):69-76.
[12]Welch TR, Blystone LW. C3 is central to the interstitial component of experimental immune complex glomerulonephritis[J]. Clin Immunol, 2005, 115(1):80-84.
[13]Collins AB, Schneeberger EE, Pascual MA, et al. Complement activation in acute humoral renal allograft rejection: diagnostic significance of C4d deposits in peritubular capillaries[J]. J Am Soc Nephrol, 1999, 10(10):2208-2214.
[14]Ross RJ,Zhou M,Shen D,et al. Immunological protein expnession profile inccl2/Cx3cr1 deficient mice with lesions similar to age-related macular degeneration[J].Exp Eye Res,2008,86(4):675-683.
ActivatedToll-likereceptorsparticipateinchronicrenaltubulointerstitialinjuryinducedbycyclosporineA
HONG Ying-li, JIN Ying-shun, CUI Zhen-hua, CHEN Ying, LI Can
(NephrologyandDialysisUnit,DepartmentofInternalMedicine,YanbianUniversityHospital,Yanji133000,China.E-mail:canlimd@yahoo.com)
AIM: To study the role of innate immunity in the pathogenesis of renal tubulointerstitial injury.METHODSThe model of nephrotoxic nephropathy was induced by chronic cyclosporine A (CsA) administration (15 mg·kg-1·d-1for 4 weeks) in Sprague-Dawley rats. The tubulointerstitial injury, characterized by inflammatory cell infiltration and striped fibrosis, was examined by the methods of immunohistochemistry and trichrome staining. The expression of Toll-like receptors (TLR), TLR ligand heat-shock protein 70 (HSP70)and intrarenal complement elements (C3, C4d and C9) was evaluated in rat kidneys by the methods ofinsituhybridization and immunohistochemistry.RESULTSCompared with the normal rats, the rats exposed to CsA showed impaired renal function, ED-1-positive cell infiltration and striped tubulointerstitial fibrosis (allP<0.01). Concomitantly, CsA treatment up-regulated the expression of TLR2 and TLR4 at mRNA and protein levels in renal tubular cells, accompanied by increased putative TLR ligand (HSP70) and the immunoreactivity of intrarenal complements. These up-regulated innate immunity components were located in the areas of severe tubulinterstitial injury.CONCLUSIONCsA-induced renal tubulointerstitial injury is closely associated with the activation of intrarenal innate immunity.
Tubulointestitial injury; Innate immunity; Receptors,Toll-like; Heat-shock proteins 70; Complement; Cyclosporine
R363
A
1000-4718(2011)03-0555-05
2010-03-15
2010-12-02
△通讯作者Tel:0433-2660799; E-mail: canlimd@yahoo.com
10.3969/j.issn.1000-4718.2011.03.026
