白花丹醌增强TRAIL诱导Kasumi-1细胞凋亡及其机制*
2011-10-24徐同鹏刘立根蒋雪玮谢英华赵莉敏韩曦瑶陆道培
徐同鹏, 刘立根,2△, 蒋雪玮, 高 武, 谢英华, 赵莉敏, 韩曦瑶, 陆道培,2
(1复旦大学附属上海市第五人民医院血液科,复旦大学血液病研究中心,上海 200240; 2上海道培医院, 上海 200240)
白花丹醌增强TRAIL诱导Kasumi-1细胞凋亡及其机制*
徐同鹏1, 刘立根1,2△, 蒋雪玮1, 高 武1, 谢英华1, 赵莉敏1, 韩曦瑶1, 陆道培1,2
(1复旦大学附属上海市第五人民医院血液科,复旦大学血液病研究中心,上海 200240;2上海道培医院, 上海 200240)
目的观察白花丹醌、rsTRAIL单独及其联合体外诱导Kasumi-1细胞凋亡的作用,探讨其作用机制。方法采用WST-8 (CCK-8)比色法测定rsTRAIL、白花丹醌单独和联合应用对Kasumi-1细胞的生长抑制率;用流式细胞术、TUNEL法观察并且检测凋亡率;实时定量PCR检测白花丹醌作用后DR4和DR5 mRNA水平变化;Western blotting法检测单独应用及联合应用后DR5、caspase-3、caspase-8、caspase-9、Bid、Bax及c-FLIP的变化。结果(1)白花丹醌和rsTRAIL单独应用均可抑制Kasumi-1细胞的生长,联合应用可增加对Kasumi-1细胞的生长抑制率且呈时间和剂量依赖性(P<0.05)。(2)rsTRAIL(100 μg/L)和白花丹醌(2 μmol/L)单用及其联合使用诱导Kasumi-1细胞Annexin V阳性细胞百分率分别为(27.7±2.9)%、(25.6±3.1)%和(52.1±3.3)%。(3)TUNEL法检测发现联合应用组较单用组凋亡细胞显著增多。(4)实时定量PCR检测发现白花丹醌可以上调DR5的表达。(5)Western blotting发现白花丹醌单独作用及其联合rsTRAIL应用时上调DR5、激活caspase-8和下调c-FLIP表达。结论白花丹醌具有增强TRAIL诱导Kasumi-1细胞凋亡的作用,其机制与DR5上调、caspase-8激活和c-FLIP下调有关。
Kasumi-1细胞; 细胞凋亡; 白花丹醌; 肿瘤坏死因子相关凋亡诱导配体; 基因,DR5; 基因,DR4
肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)是TNF超家族成员之一,是一种Ⅱ型膜蛋白,通过与其特异性死亡受体(DR4和DR5)结合而激活凋亡信号转导途径,从而诱导肿瘤细胞凋亡[1]。白花丹醌是中药白花丹的主要活性成分,具有广泛的药理活性,包括抗菌消炎、抗生殖、抗凝等作用[2,3]。研究发现,白花丹醌也具有明显的抗肿瘤作用,能够抑制K562、Raji、Jurkat、NB4等白血病细胞系以及宫颈癌和肝癌等实体瘤细胞系的生长和增殖[3-5]。Kasumi-1是培养自人t(8;21)急性髓系白血病患者的细胞系,为体外研究该类型白血病的良好模型。尽管伴t(8;21)急性髓系白血病患者相对预后良好,复发和耐药仍然是威胁患者长期生存的主要问题。本研究旨在探讨TRAIL及其联合白花丹醌体外诱导Kasumi-1细胞凋亡的作用,为此类患者的治疗寻找新的治疗方法。
材 料 和 方 法
1材料
1.1细胞系与主要试剂 Kasumi-1细胞由中国协和医科大学天津血研所王建祥教授馈赠,用含20%胎牛血清的RPMI-1640培养液在37 ℃、5% CO2、饱和湿度下的孵育箱中培养,取对数生长期的细胞进行实验。白花丹醌购自Sigma,溶解于二甲亚砜(dimethyl sulfoxide,DMSO)中,配成0.1mol/L储备溶液,置于4 ℃保存,使用时应用RPMI-1640培养液稀释至工作浓度(工作液中DMSO终浓度均小于0.1%,预实验证实对Kasumi-1细胞无影响)。人重组可溶性三聚体TRAIL(rsTRAIL)由上海恰尔生物技术有限公司馈赠。CCK-8试剂购自日本同仁化学,AnnexinⅤ/PI试剂盒购自南京凯基生物,TUNEL试剂盒购自罗氏公司。胎牛血清购自Gibco,逆转录试剂盒购自Fermentas,SYBR Green PCR Master Mix 购自BD。兔多抗anti-DR5和anti-Bid购自Abcam,鼠单抗anti-caspase-3、anti-caspase-8、anti-caspase-9、anti-Bcl-2和anti-Bax购自RD,anti-GAPDH购自Cell Signaling,鼠单抗anti-cFLIP购自Stressgen。 HRP标记的山羊抗兔和山羊抗鼠Ⅱ抗购自Chemicon。
1.2培养细胞分组 将Kasumi-1细胞按照5×108cells/L的浓度接种到96孔板,分为4组:rsTRAIL组(10、25、50、100、250、500、1 000 μg/L,作用12 h、24 h、48 h、72 h)、白花丹醌组(2、4、6、8、10、12 μmol /L,作用12 h、24 h、48 h)、联合用药组(在加入不同浓度rsTRAIL的同时分别加入2 μmol/L和4 μmol/L的白花丹醌作用12 h、24 h)和空白对照组(不加任何药物)。
2方法
2.1Wright染色观察细胞形态学变化 取不同药物处理组的细胞,甩片固定后滴加瑞氏染液染1 min,加等量pH 6.4的磷酸盐缓冲液轻轻晃动玻片,均匀静置5 min,显微镜下观察形态变化。
2.2CCK-8比色法检测细胞抑制率 将细胞悬液以RPMI-1640培养液洗涤并调整细胞密度至5×108cells/L,加入96孔培养板中,每孔200 μL。分别以不同的药物剂量作为1组,每组均设3个复孔及1个对照孔,对照孔加入空白对照组的细胞。药物作用12、24、48、72 h后,每孔加入CCK-8 20 μL,温箱中继续孵育3 h后选择450 nm波长测定各孔的吸光度(A)值。以该组复孔的平均值作为该组细胞的A值,并计算细胞生存率:细胞生存率(%)=(实验A-空白A)/A(对照A-空白A)×100%,实验重复5次。
2.3Annexin V/PI双染色检测细胞凋亡率 不同药物剂量作用细胞12 h后,分别取1×106个不同用药组细胞用PBS洗涤2次,加入FITC标记Annexin V和PI(操作按说明书进行),避光放置1 h,流式细胞仪(FACS Caliber,BD)检测,Cell Quest软件进行数据分析。Annexin V阳性且PI阴性的细胞为早期凋亡细胞,Annexin V和PI均为阳性的细胞为晚期凋亡细胞,二者合并计算细胞凋亡率,实验重复5次。
2.4TUNEL法检测细胞凋亡 收集不同浓度rsTRAIL(25、50、100 μg/L)单独作用、不同浓度rsTRAIL(25、50、100 μg/L)联合2 μmol/L和4 μmol/L白花丹醌作用12 h的各组细胞,甩片固定后脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL)法检测细胞凋亡,按照说明书步骤操作。结果判定:四唑氮蓝(NBT)显色,凋亡细胞核被染成深褐色,非凋亡细胞呈蓝色。每组浓度取3个独立实验标本,每张切片随机计数200个细胞,根据TUNEL阳性细胞计算细胞凋亡。
2.5实时定量PCR检测基因变化 2 μmol/L和4 μmol/L白花丹醌作用Kasumi-1细胞8 h和12 h后,用Trizol提取细胞总RNA,逆转录成cDNA(按照试剂盒操作说明)。合成cDNA第1链后进行real-time PCR。反应条件如下:SYBR Green Mix(2×)10 μL,上游引物0.25 μL,下游引物0.25 μL,DEPC水7.5 μL,cDNA模板2 μL。上述20 μL体系95 ℃预变性10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。引物序列:DR4正义链5’-GGCTGAGGACAATGCTCACA-3’, 反义链5’-TTGCTGCTCAGAGACGAAAGTG-3’;DR5正义链5’-CCAGCCCTCCCTCAGATGTAC-3’, 反义链5’-TGTAAGGTTGTCCAGTTCAAAAGACT-3’;β-actin正义链5’-CCAGCTCACCATGGATGATG-3’,反义链5’-ATGCCGGAGCCGTTGTC- 3’。
数据分析:DR4和DR5 mRNA半定量用2-△△ct来表示(△Ct为目的基因Ct值减去β-actin的Ct值,△△Ct为用药组的△Ct值减去对照组的△Ct值)。实验重复3次,取其平均值半定量最后的表达水平。
2.6Western blotting检测细胞系凋亡相关蛋白的表达 2 μmol/L和4 μmol/L白花丹醌分别单独作用Kasumi-1细胞8 h和12 h,100 μg/L rsTRAIL单独作用Kasumi-1细胞12 h,2 μmol/L白花丹醌联合100 μg/L rsTRAIL作用12 h后,收集不同处理组细胞标本,制备细胞总蛋白,用BCA法测蛋白浓度,每组样品均取30 μg总蛋白上样量进行SDS-PAGE凝胶电泳,将蛋白电转至PVDF膜上,5%脱脂奶粉室温封闭1 h,加入Ⅰ抗4 ℃过夜,然后加入Ⅱ抗室温孵育1 h,加入ECL显影液,暗室显影。
3统计学处理

结 果
1Wrigh染色后显微镜下形态
普通光学显微镜下观察不同药物处理后细胞形态学改变。单用rsTRAIL(100 μg/L)、单用白花丹醌2 μmol/L和联合rsTRAIL(100 μg/L)+白花丹醌2 μmol/L作用12 h后观察发现,单用和联合用药组细胞形态均出现胞体缩小和胞核固缩等显著变化,但联合用药组改变更为显著,见图1。
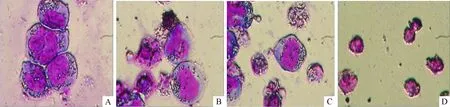
Figure 1. Cell death induced by rsTRAIL, plumbagin or combination of plumbagin with rsTRAIL for 12 h.Morphological aspect of Kasumi-1 cells were analyzed by Wrighting staining (×100).A:control;B:plumbagin(2 μmol/L);C:rsTRAIL(100 μg/L);D:combination of plumbagin with rsTRAIL.
图1白花丹醌、rsTRAIL单用和联合用药对Kasumi-1细胞作用的形态学观察
2细胞生长抑制实验结果
不同浓度的白花丹醌和rsTRAIL单用对Kasumi-1细胞均有抑制生长作用,但是联合2 μmol/L或4 μmol/L白花丹醌后,rsTRAIL对细胞的生长抑制作用更为显著,见图2。
3流式细胞术(AnnexinV/PI双染色)检测凋亡率
收集白花丹醌(2 μmol/L)、rsTRAIL(100 μg/L)单独和联合用药作用12 h后的Kasumi-1细胞,用AnnexinV FITC/PI 双标记检测细胞凋亡率。结果发现,rsTRAIL联合白花丹醌作用Kasumi-1细胞12 h,与相同质量浓度rsTRAIL和相同质量浓度的白花丹醌分别单独作用Kasumi-1细胞12 h相比,能明显增加细胞凋亡率,前者Annexin V - FITC 阳性率水平为(52.1±3.3)%, 后两者分别为(27.7±2.9)% 和(25.6±3.1)%,差异显著(P<0.01),见表1、图3。
4TUNEL法检测细胞凋亡
白花丹醌与rsTRAIL联合作用12 h后即可检测到较多Kasumi-1细胞凋亡,凋亡细胞染成深褐色,非凋亡细胞呈蓝色。各组细胞凋亡率的比较见图4,不同浓度rsTRAIL可诱导Kasumi-1细胞发生凋亡,而联合2 μmol/L或4 μmol/L白花丹醌后,平均凋亡率均高于单用rsTRAIL组,表明白花丹醌能够显著增强rsTRAIL诱导的Kasumi-1细胞凋亡效应。
5实时定量PCR法检测Kasumi-1细胞DR5和DR4mRNA水平变化
2 μmol/L和4 μmol/L白花丹醌作用Kasumi-1细胞8 h和12 h后,与空白对照组比较,DR5 mRNA表达显著增加,而DR4 mRNA水平增加不明显,与空白对照组比较无显著差异,见图5(以上数据取自3次独立实验的平均值)。因此,白花丹醌作用后可以上调DR5的mRNA水平,但对DR4 mRNA水平无明显影响。

Figure 2. Effects of plumbagin,rsTRAIL and combination of rsTRAIL with plumbagin on growth inhibition of Kasumi-1 cells.A: effects of various concentrations (10 -1 000 μg/L) of rsTRAIL on cell viability at 12 h,24 h,48 h or 72 h;B: effects of different concentrations (2 - 12 μmol/L) of plumbagin on cell viability at 12 h, 24 h or 48 h;C: effects of rsTRAIL combined with 2 μmol/L or 4 μmol/L plumbagin on cell viability at 24 h.*P<0.05vscontrol(0);△P<0.05vsrsTRAIL alone group.P2+rsTRAIL: the combination of 2 μmol/L plumbagin with various concentrations of rsTRAIL; P4+rsTRAIL: the combination of 4 μmol/L plumbagin with various concentrations of rsTRAIL.
图2rsTRAIL、白花丹醌单用和两者联用对Kasumi-1细胞的生长抑制作用
表1白花丹醌(2μmol/L)、rsTRAIL(100μg/L)单独和联合用药12h后Kasumi-1细胞AnnexinV的阳性率


GroupAnnexinV-positiverate(%)Control7.3±2.1Plumbagin25.6±3.1∗∗rsTRAIL27.7±2.9∗∗plumbagin-rsTRAIL52.1±3.3△△
**P<0.01vscontrol;△△P<0.01vsplumbagin or rsTRAIL.
6白花丹醌单独及联合rsTRAIL对Kasumi-1细胞DR5蛋白的影响
以未加药物的Kasumi-1细胞为对照组,经2 μmol/L和4 μmol/L白花丹醌分别处理8 h和12 h后,DR5的表达量明显增加,并与白花丹醌作用时间和浓度呈正相关,见图6A,经2 μmol/L白花丹醌和100 μg/L rsTRAIL联合作用Kasumi-1细胞 12 h后,DR5的表达量也明显增加,见图6B,说明白花丹醌单独及联合rsTRAIL均可以上调Kasumi-1细胞DR5蛋白的表达。
7白花丹醌联合rsTRAIL对Kasumi-1细胞相关凋亡蛋白的影响
以未加药物的Kasumi-1细胞为空白对照组,以2 μmol/L白花丹醌、100 μg/L rsTRAIL单独作用12 h的细胞作为阴性对照,经2 μmol/L白花丹醌和100 μg/L rsTRAIL联合作用12 h后,细胞相关凋亡蛋白caspase-3、-8、-9和Bid较对照组明显激活,白花丹醌单独作用组及联合用药组Bax蛋白表达量增加、c-FLIP蛋白表达量减少,见图7,表2,提示联合用药可以激活caspase-3、-8、-9和Bid,并且上调促凋亡蛋白Bax和下调抑制凋亡蛋白c-FLIP的表达。
讨 论
t(8;21)阳性急性髓系白血病约占急性白血病患者的10%-15%,被认为是预后良好的一种类型。国外报道其长期生存率为60%-70%[6],国内两个较大系列的研究报告5年总生存率仅为39%和50%,难治或复发仍然是患者治疗失败的主要原因。因此,寻找新的治疗药物对提高此类患者完全缓解率乃至长期生存具有重要的临床价值。
TRAIL是肿瘤坏死因子超家族成员,具有诱导肿瘤细胞或/和转化细胞凋亡而不损伤正常细胞的作用,是该家族中唯一被认为有望应用于临床的抗肿瘤药物。临床前研究中发现,它对人白血病有较强的杀伤作用而对宿主细胞几乎无毒性[7],但是耐药限制了其临床应用[8]。白花丹醌具有良好的杀伤肿瘤细胞的作用,通过线粒体途径诱导肿瘤细胞的凋亡,但大剂量使用时具有较强的细胞毒作用[13]。 Kasumi-1是一种经典的t(8;21)阳性急性髓系白血病细胞株,目前尚未见有关TRAIL和/或白花丹醌对Kasumi-1细胞作用的报道。
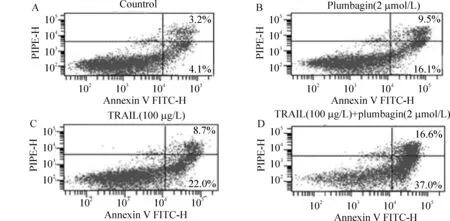
Figure 3. Co-treatment of rsTRAIL and plumbagin resulted in a striking increase in apoptosis of Kasumi-1 cells. The percentage of apoptotic cells was determined by Annexin V/PI staining. A:control; B: 2 μmol/L plumbagin; C:100 μg/L rsTRAIL;D: combination of 2 μmol/L plumbagin with 100 μg/L rsTRAIL.
图3流式细胞术测定TRAIL、白花丹醌单用和联合对Kasumi-1细胞AnnexinV/PI表达的作用

Figure 4. Co-treatment of rsTRAIL and plumbagin resulted in a striking increase in apoptosis of Kasumi-1 cells. After indicated treatment for 12 h, the cells were TdT-UTP nick end-labelled and imaged by light microscopy(×400). The content of TUNEL-positive cells was the number of brown precipitate in each photograph.TUNEL-positive cells were apoptotic cells of early stage.*P<0.05vsrsTRAIL alone group.
图4TUNEL法测定TRAIL、白花丹醌和联合对Kasumi-1细胞凋亡的作用
本研究发现rsTRAIL体外单独应用可以诱导Kasumi-1细胞的凋亡,但是单独应用浓度500 μg/L以上的rsTRAIL其细胞凋亡率维持在70%左右,不再出现显著增加,提示存在TRAIL耐药可能。白花丹醌单独应用可以剂量依赖性诱导Kasumi-1细胞凋亡,2 μmol/L以下低浓度则诱导细胞凋亡显著减弱。2 μmol/L和4 μmol/L白花丹醌联合50-500 μg/L rsTRAIL可以剂量和时间依赖性诱导Kasumi-1细胞凋亡,提示白花丹醌能够增强TRAIL诱导的白血病细胞株Kasumi-1凋亡。

Figure 5. Analysis of DR4 and DR5 based on mRNA levels from Kasumi-1 cells 8 h,12 h after treatment with 2 μmol/L and 4 μmol/L of plumbagin. Results were reported as average fold induction relative to the untreated sample. All detection values were normalized according to the β-actin internal control.*P<0.05vscontrol group.
图5白花丹醌对Kasumi-1细胞DR5、DR4mRNA表达的影响
TRAIL凋亡途径是外源性诱导细胞凋亡通路,细胞死亡受体DR4和DR5的表达、caspases激活、Bcl-2家族蛋白等多种因素参与该通路的激活。
表2白花丹醌(2μmol/L)、rsTRAIL(100μg/L)单独和联合用药12h后Kasumi-1细胞凋亡相关蛋白的相对表达量

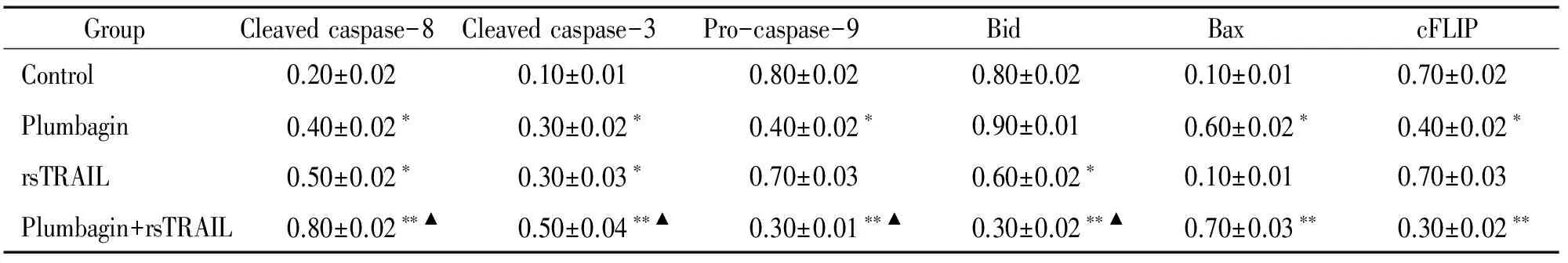
GroupCleavedcaspase-8Cleavedcaspase-3Pro-caspase-9BidBaxcFLIPControl0.20±0.020.10±0.010.80±0.020.80±0.020.10±0.010.70±0.02Plumbagin0.40±0.02∗0.30±0.02∗0.40±0.02∗0.90±0.010.60±0.02∗0.40±0.02∗rsTRAIL0.50±0.02∗0.30±0.03∗0.70±0.030.60±0.02∗0.10±0.010.70±0.03Plumbagin+rsTRAIL0.80±0.02∗∗▲0.50±0.04∗∗▲0.30±0.01∗∗▲0.30±0.02∗∗▲0.70±0.03∗∗0.30±0.02∗∗
All the values were normalized acconding to the GAPDH internal control.*P<0.05,**P<0.01vscontrol;▲P<0.05vsplumbagin or rsTRAIL.


图6白花丹醌单独及联合rsTRAIL对Kasumi-1细胞DR5蛋白表达的影响

Figure 7. Western blotting for caspase-3, caspase-8, caspase-9, Bid, Bax, and cFLIP. Kasumi-1 cells were treated with plumbagin (2 μmol/L)alone, rsTRAIL (100 μg/L) alone or with both agents for 12 h.
图7白花丹醌单独及联合rsTRAIL对Kasumi-1细胞凋亡相关蛋白表达的影响
TRAIL耐药涉及细胞表面死亡受体和诱骗受体的表达、c-FLIP表达以及凋亡蛋白抑制因子(IAP)表达等[8]。有研究发现DR5蛋白差异表达可作为评价肿瘤细胞对TRAIL敏感程度的观察指标之一,某些抗肿瘤药物可以通过上调DR5的表达而发挥和TRAIL的协同作用[9-12]。本研究结果表明,白花丹醌可以上调Kasumi-1细胞DR5的表达,提示增加DR5的表达是白花丹醌增强Kasumi-1细胞TRAIL的敏感性机制之一。
白花丹醌属于蒽醌类药物,其醌核具有较强的亲电子作用,通过与还原性谷胱甘肽作用降低细胞清除氧自由基的能力,从而激活活性氧依赖的细胞内源性途径诱导的细胞凋亡[4,13]。本研究发现,单用白花丹醌可以激活Bax和caspase-9,提示内源性通路是其诱导细胞凋亡的主要途径。Caspase-8是外源性凋亡途径中非常重要的信号蛋白,非常有趣的是,本研究发现白花丹醌可以显著激活caspase-8,与Xu等[13]发现白花丹醌诱导NB4细胞凋亡时caspase-8激活一致。已有研究[14]发现,表阿霉素等依赖内源性凋亡通路的抗肿瘤药物可以通过caspase-3激活caspase-8且不依赖Fas,提示外源性凋亡途径和内源性凋亡途径之间存在交叉通路。因此,我们推测激活casapse-8这一重要的细胞外源性凋亡通路信号蛋白与白花丹醌增强TRAIL诱导的Kasumi-1细胞凋亡有关。
c-FLIP通过其N端的2个DED竞争性结合FADD和/或caspase-8/l0,阻断外源性凋亡通路中caspase-8/10的活化,使caspases级联反应不能继续,从而阻断外源性凋亡信号转导,起到抑制凋亡的作用,是TRAIL耐药的重要机制[15]。 本研究发现单独应用低浓度白花丹醌(2 μmol/L)可以显著下调c-FLIP的表达,与rsTRAIL联合应用时其下调c-FLIP作用仍然存在,提示白花丹醌下调c-FLIP表达也是其增强TRAIL诱导Kasumi-1细胞凋亡的机制之一。
综上所述,白花丹醌通过多种机制增强TRAIL诱导Kasumi-1细胞凋亡,具有潜在逆转TRAIL耐药的作用,有望为难治/复发t(8;21)急性髓系白血病的治疗找到一条新的途径,但尚需更深入的实验和临床研究。
[1] Wiley SR,Schooley K,Smolak PJ,et al.Identification and characterization of a new member of the TNF family that induces apoptosis[J].Immunity,1995,3(6):673-682.
[2] 郭晓庄.有毒中草药大辞典[M].第1版.天津:天津科技翻译出版公司,1992.177-179.
[3] Lin LC,Yang LL,Chou CJ. Cytotoxic naphthoquinones and plumbagic acid glucosides fromPlumbagozeylanica[J].Phytochemistry,2003,62(4):619-622.
[4] Srinivas P, Gopinath G, Banerji A,et al. Plumbagin induces reactive oxygen species,which mediate apoptosis in human cervical cancer cells[J].Mol Carcinog,2004,40(4):201-211.
[5] 赵艳丽,陆道培.白花丹醌对人急性早幼粒细胞白血病细胞的体外效应[J]. 中国实验血液学杂志,2006,14(2):208-211.
[6] Paschka P, Marcucci G, Ruppert AS, et al. Adverse prognostic significance of KIT mutations in adult acute myeloid leukemia with inv(16) and t(8;21): a Cancer and Leukemia Group B Study[J]. J Clin Oncol,2006,24(24):3904-3911.
[7] 杨 雷,杨联萍,李茹冰,等. TRAIL对多种肿瘤细胞的杀伤作用[J].中国病理生理杂志,2007,23(6):1236-1237、1239.
[8] Zhang L, Fang B. Mechanisms of resistance to TRAIL-induced apoptosis in cancer[J]. Cancer Gene Ther,2005,12(3): 228-237.
[9] Wen J, Nimmanapalli R, Nguyen D, et al. Antileukemic drugs increase death receptor 5 levels and enhance Apo-2L-induced apoptosis of human acute leukemia cells[J]. Blood,2000,96(12):3900-3906.
[10]Carter BD, Mak DH, Schober WD, et al. Triptolide sensitizes AML cells to TRAIL-induced apoptosis via decrease of XIAP and p53-mediated increase of DR5[J]. Blood,2008,111(7):3742-3750.
[11]Kang J,Bu J,Hao Y,et al.Subtoxic concentration of doxorubicin enhances TRAIL-induced apoptosis in human prostate cancer cell line LNCaP[J].Prostate Cancer Prostatic Dis,2005,8(3):274-279.
[12]Komdeur R,Meijer C,Van Zweeden M,et al.Doxorubicin potentiates TRAIL cytotoxicity and apoptosis and can overcome TRAIL-resistance in rhabdomyosarcoma cells[J].Int J Oncol,2004,25(3):677-684.
[13]Xu KH,Lu DP. Plumbagin induces ROS-mediated apoptosis in human promyelocytic leukemia cellsinvivo[J]. Leuk Res,2010,34(5): 658-665.
[14]Wieder T, Essmann F, Prokop A, et al. Activation of caspase-8 in drug-induced apoptosis of B-lymphoid cells is independent of CD95/Fas receptor-ligand interaction and occurs downstream of caspase-3[J]. Blood, 2001, 97(5): 1378-1387.
[15]Mahalingam D, Szegezdi E, Keane M,et al. TRAIL receptor signalling and modulation: Are we on the right TRAIL? [J].Cancer Treat Rev, 2009, 35(3): 280-288.
PlumbaginenhancesTRAIL-inducedapoptosisinKasumi-1cells
XU Tong-peng1, LIU Li-gen1,2, JIANG Xue-wei1, GAO Wu1, XIE Ying-hua1, ZHAO Li-min1, HAN Xi-yao1, LU Dao-pei1,2
(1DepartmentofHematology,TheFifthPeople’sHospitalofShanghai,BloodDiseaseResearchCenter,FudanUniversity,Shanghai200240,China;2ShanghaiDaopeiHospital,Shanghai200240,China.E-mail:liuligen@medmail.com.cn)
AIM: To investigate the effect of plumbagin and tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) on the apoptosis of leukemic Kasumi-1 cells.METHODSKasumi-1 cells were treated with plumbagin alone, recombinant soluble TRAIL(rsTRAIL) alone or the combination of plumbagin with rsTRAIL to induce apoptosis. The cell proliferation was analyzed by CCK-8 assay. Apoptosis was determined by flow cytometry with AnnexinⅤ/PI double staining and TUNEL staining. The expression of DR4 and DR5 at mRNA level was measured by real-time PCR. The expression of signal transduction proteins, such as DR5, caspase-3, caspase-8, caspasep-9, Bid, Bax and c-FLIP was detected by Western blotting.RESULTSBoth rsTRAIL and plumbagin induced the apoptosis in Kasumi-1 cells, and combination of plumbagin with rsTRAIL enhanced the apoptosis. The ratios of Annexin V-positive Kasumi-1 cells were (27.7±2.9)%, (25.6±3.1)% and (52.1±3.3)% in 100 μg/L rsTRAIL group, 2 μmol/L plumbagin group and the combination group, respectively, and the positive rate in combination group was significantly higher than those in other 2 groups. TUNEL assay demonstrated that the number of apoptotic cells in combination group was higher than that in the cells treated with rsTRAIL or plumbagin alone. Plumbagin up-regulated the expression of DR5 at mRNA level in Kasumi-1 cells, and up-regulation of DR5, activation of caspase-8 and down-regulation of c-FLIP at protein level were detected in the cells treated with plumbagin alone and the combination of plumbagin with rsTRAIL.CONCLUSIONPlumbagin enhances TRAIL-induced apoptosis in Kasumi-1 cells by up-regulating DR5, activating caspase-8 and down-regulating c-FLIP.
Kasumi-1 cells; Apoptosis; Plumbagin; Tumor necrosis factor-related apoptosis-inducing ligand; Genes,DR5; Genes,DR4
R363
A
1000-4718(2011)03-0481-07
2010-11-15
2011-01-10
国家自然科学基金资助项目(No.30672415);上海市科委攻关项目(No.054119528)
△通讯作者 Tel:021-24289908; E-mail: liuligen @medmail.com.cn
10.3969/j.issn.1000-4718.2011.03.012
