丹酚酸B抑制氧化应激引起骨髓间质干细胞凋亡的研究*
2011-10-24卢碧燕童秀珍邓宇斌吴洪福侯景义
卢碧燕, 童秀珍, 邓宇斌△, 吴洪福, 侯景义
(中山大学 1中山医学院病理生理教研室,2附属第一医院血液科,广东 广州 510080)
丹酚酸B抑制氧化应激引起骨髓间质干细胞凋亡的研究*
卢碧燕1, 童秀珍2, 邓宇斌1△, 吴洪福1, 侯景义1
(中山大学1中山医学院病理生理教研室,2附属第一医院血液科,广东 广州 510080)
目的观察丹酚酸B (Sal B)对氧化应激介导骨髓间质干细胞(BMSCs)凋亡的影响并探讨其作用机制。方法大鼠BMSCs培养鉴定后分为5组:空白对照组、氧化应激组、低浓度Sal B+H2O2组、中浓度Sal B+H2O2组和高浓度Sal B+H2O2组。应用MTT、流式细胞仪(FCM)及Hoechst标记的方法检测Sal B对氧化应激介导的细胞活性下降以及凋亡效应的影响;通过DCF荧光染色的方法检测过氧化氢及Sal B对细胞内活性氧生成的影响;用Western blotting的方法检测p-ERK1/2表达情况。结果MTT结果显示不同浓度的Sal B共处理BMSCs 24 h能够提高氧化应激情况下的细胞活性,其中中浓度组的作用更为明显。Hoechst标记以及FCM检测的结果表明:10 μmol/L Sal B处理能够提高细胞活性,减少凋亡数。正常组细胞的DCF阳性细胞率为28.7%±8.1%,经500 μmol/L H2O2刺激24 h后,阳性细胞数急剧上升,高达86.9%±12.4%。而10 μmol/L Sal B处理组的上升不明显,仅有42.1%±10.8%。由此可见,Sal B处理可以减少细胞内活性氧的生成;细胞在氧化应激的条件下p-ERK1/2在15 min内开始上调,持续120 min。而这种上调经10 μmol/L Sal B处理可以有效降低,同时Sal B可以降低细胞基础的p-ERK1/2表达。结论Sal B 增强BMSCs抗氧化应激能力从而减少H2O2刺激引起的细胞凋亡,其保护机制可能与参与调节凋亡相关信号通路MEK/ERK1/2和抑制细胞内活性氧生成有关。
丹酚酸B; 骨髓间质干细胞; 氧化性应激; 活性氧簇; 细胞外信号调节激酶1/2
骨髓间质干细胞(bone mesenchymal stem cells, BMSCs)作为成体干细胞的一种,获取简单,扩增容易,同时具有自我更新和多向分化潜能,更重要的是其移植后能够逃避宿主免疫监视,并且分泌治疗性物质起到修复和替代受损的神经组织的作用。因此,干细胞治疗为脊髓和中枢神经系统损伤性疾病带来了希望[1]。相对于其它类型的干细胞而言,BMSCs还具有获取方便,扩增容易,遗传背景稳定,免疫原性低等优势。然而,BMSCs治疗的实验研究和临床应用遭遇瓶颈。移植细胞如何在局部恶劣的微环境中存活及定向分化等关键问题尚待解决[2,3]。已有研究证明丹酚碳B(salvianolic acid B,Sal B)具有很强的抗氧化作用和明显的抗炎作用,为了更好地阐明Sal B对移植BMSCs的保护作用及其机制,为Sal B的进一步应用提供实验依据,本研究拟通过过氧化氢刺激细胞模拟体内损伤局部微环境中氧化应激诱导BMSCs凋亡,观察Sal B处理对氧化应激介导的BMSCs凋亡的影响并进一步探讨其可能的保护机制。
材 料 和 方 法
1材料
DMEM/F12培养基(Invitrogen),胎牛血清(fetal bovine serum,FBS,Hyclone);Hoechst 33342和AnnexinV-FITC/PI试剂盒购于晶美生物工程有限公司。
2方法
2.1大鼠BMSCs的分离和培养 取60-80 g 的雌性SD 大鼠,断颈处死,无菌条件下取双侧股骨, PBS液反复冲洗骨髓腔至变白。将冲洗液收集于离心管中, 1 000 r/min离心5 min, 加入 DMEM/F12培养液5-6 mL。重悬细胞于25 cm2培养瓶中, 37 ℃、5% CO2、饱和湿度培养。每3 d换液1次,去除未贴壁细胞。每天在倒置相差显微镜下观察细胞的形态及生长情况。待贴壁细胞达90%融合时,用2.5 g/L胰蛋白酶消化贴壁细胞, 1∶2传代,本实验均选用第4代细胞,按实验室常规做流式表面标志鉴定。
① 探讨不同浓度Sal B对氧化应激状态下BMSCs活性及凋亡的影响 细胞分别被暴露于0、1、10、100 μmol/L Sal B及500 μmol/L H2O224 h。
② 探讨Sal B对p-ERK1/2表达的影响 细胞分3组,分别用10 μmol/L Sal B 和(或)500 μmol/L H2O2处理,在15 min、30 min、60 min、120 min 4个时点取蛋白样品。
2.2MTT检测H2O2处理对BMSCs活性的影响 取对数生长期细胞,以5×105细胞接种于96孔板,100 μL/well。在37 ℃、5% CO2条件下常规培养过夜后,按实验要求给予不同处理,分别加入500 μmol/L H2O2处理24 h后,每组设8个平行孔。处理完毕后,每孔加5 g/L MTT 20 μL,继续培养4 h,吸出培养液,加DMSO含0.04 mol/L HCl 100 μL/well,待其完全溶解后,用酶联免疫仪在波长570 nm处读取吸光度(A)。设定正常对照组MTT存活率为100%,其余各组的MTT存活率按公式:MTT存活率=(实验孔A值/对照孔A值)×100%。
2.3Hoechst 33342染色 将BMSCs接种在6孔板内的盖玻片上,各实验组按要求给予不同处理因素作用一定时间后,加入新鲜配制的40 g/L多聚甲醛于4 ℃固定细胞10 min,再加5 g/L Hoechst 33342染色10 min,PBS液洗后,用封片液封片后荧光显微镜观察、摄片。正常细胞核出现均匀的强度荧光;细胞核如呈浓缩致密的固缩形态或颗粒状荧光,记为凋亡的细胞。
2.4流式细胞术检测Sal B对BMSCs凋亡的影响 常规消化BMSCs, 调整细胞浓度至4×108cells/L, 接种于6孔培养板, 3 mL/well, 培养过夜后, 吸出培液, 常规消化BMSCs, 分别离心, 弃上清。 用4 ℃预冷的PBS洗细胞1次, 分别用100 μL结合缓冲液(1∶4稀释)重新悬浮细胞, 按试剂盒说明加入5 μL AnnexinⅤ-FITC和10 μL 20 mg/L碘化丙啶溶液, 混匀, 置于室温避光孵育15 min, 流式细胞仪(flow cytometry, FCM)分析凋亡情况。
2.5流式细胞仪检测活性氧簇(reactive oxygen species,ROS) 胰酶消化成单细胞悬液;吸取500 μL细胞悬液,加入1 mmol/L DCFH-DA 5 μL,使DCFH-DA终浓度为10 μmol/L,置于37 ℃避光孵育30 min;孵育结束后,PBS洗涤细胞2次去除可能的细胞外荧光物质;各实验组按要求给予不同的处理因素5 min后,上流式细胞仪检测细胞内活性氧。
3Westernblotting检测p-ERK1/2蛋白表达
细胞培养至80% 左右密度时,各实验组按要求给予不同处理因素作用一定时间后,加入400μL裂解液提取蛋白电泳转膜后,加入按1∶1 000稀释的p-ERK1/2 Ⅰ 抗,滴加过氧化物酶标记 Ⅱ 抗后ECL显色。
4统计学处理

结 果
1不同浓度SalB对H2O2引起BMSCs活性下降的影响
500 μmol/L H2O2刺激24 h BMSCs活性下降为53.60%±4.21%,而 Sal B共处理对H2O2引起的细胞活性的降低有抵抗作用,其中10 μmol/L和100 μmol/L效果明显,细胞活性分别上升至 85.33%±9.08%和75.78%±6.28%,见图1。
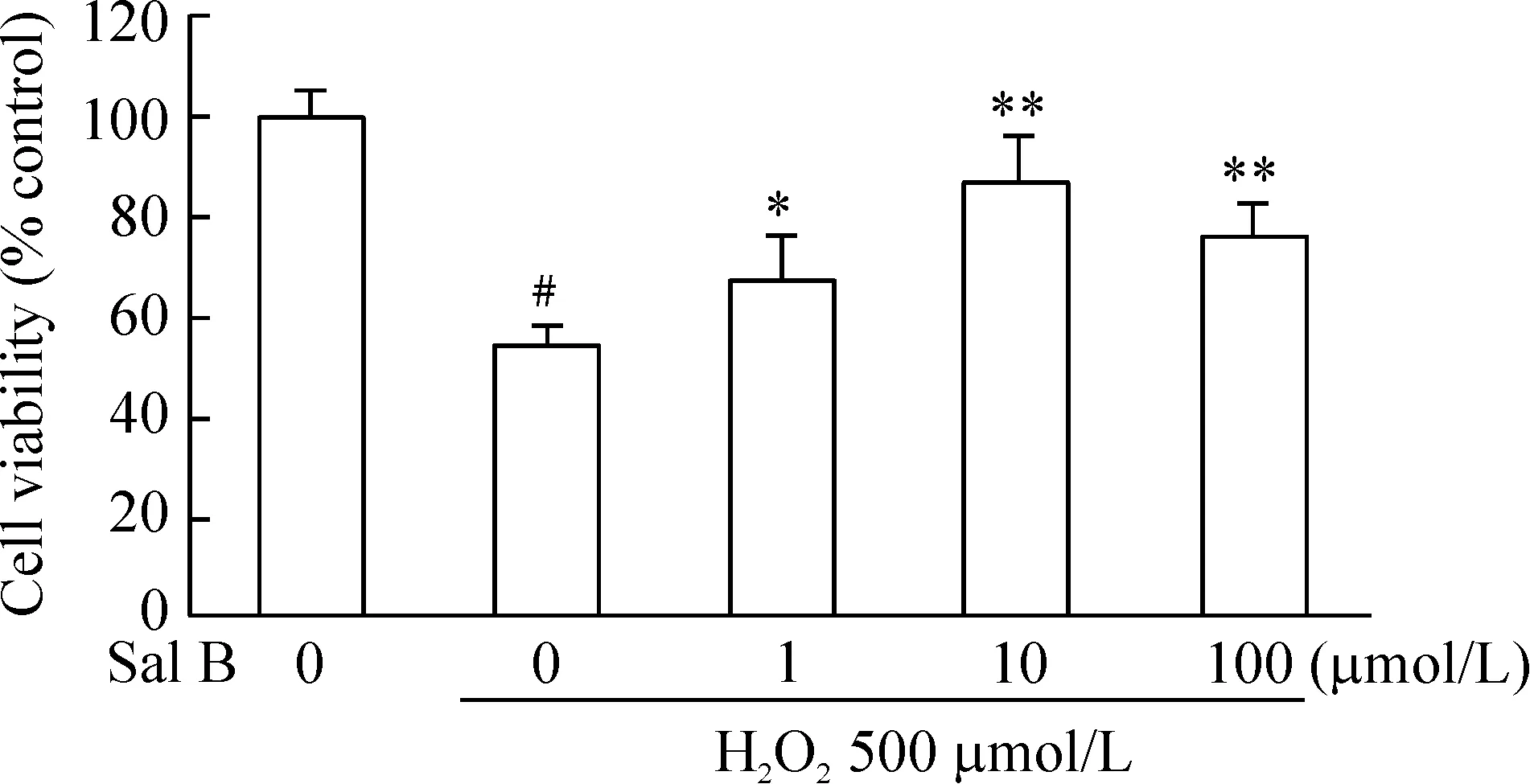

图1MTT法检测SalB对细胞活性的影响
2SalB对H2O2诱导BMSCs凋亡的影响
2.1Hoechst荧光染色后,在荧光显微镜下观察到
正常对照组BMSCs染色质分布均匀,为弥漫均匀的低强度荧光;阳性对照组及1 μmol/L Sal B处理组细胞核呈浓缩致密的固缩形态或颗粒状荧光; 10 μmol/L Sal B组和100 μmol/L Sal B组细胞核呈浓缩致密的固缩形态或颗粒状荧光的凋亡细胞较阳性对照组明显减少,P<0.05,见图2。
2.2Annexin V/PI 双染色法显示Sal B处理可以对抗高浓度H2O2诱导的BMSCs凋亡,正常对照组BMSCs的凋亡率为3.15%±1.31%;500 μmol/L H2O2作用BMSCs 24 h,凋亡率增加到36.90%±8.37%,P<0.01。而1 μmol/L、10 μmol/L和100 μmol/L Sal B处理后凋亡率分别为35.93%±5.57%、14.27%±6.12%和27.17%±2.44%。可见,10 μmol/L和100 μmol/L Sal B可明显降低500 μmol/L H2O2引起的BMSCs凋亡,P<0.01,见图3。
3SalB处理对BMSCs胞内活性氧生成的影响
正常组细胞的DCF阳性细胞率为28.7%±8.1%,经500 μmol/L H2O2刺激5 min后,阳性细胞数急剧上升,高达86.9%±12.4%。而10 μmol/L Sal B处理组的上升不明显,仅有42.1%±10.8%。由此可见,Sal B处理可以减少细胞内活性氧的生成,见图4。

图2Hoechst染色法检测细胞凋亡率
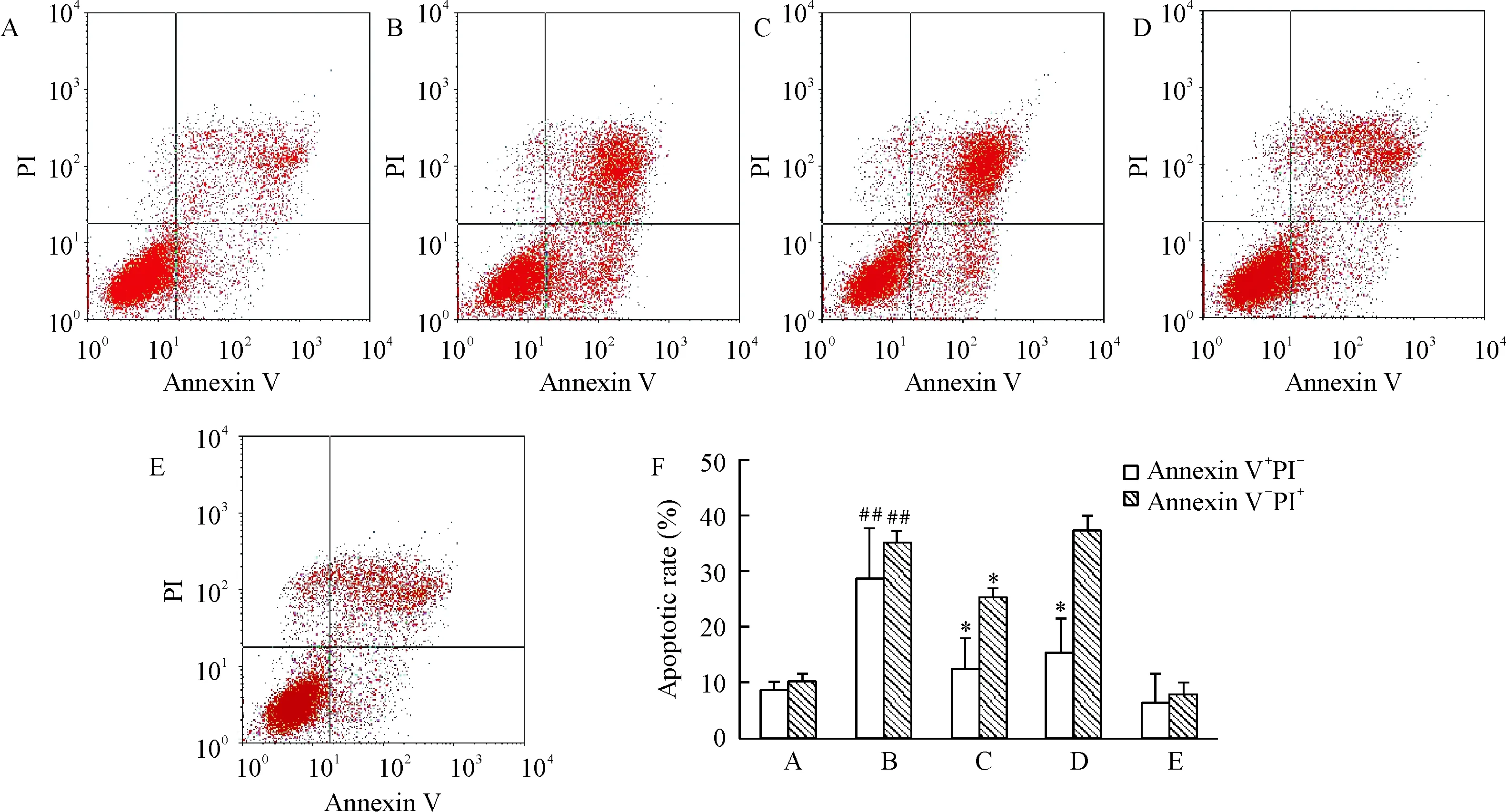
图3流式细胞仪检测细胞凋亡率

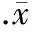
图4DCF荧光染色检测细胞内活性氧生成
4p-ERK1/2的表达
BMSCs经500 μmol/L H2O2刺激,最早在15 min即可观察到p-ERK1/2表达的上升,而这种上升持续至120 min。10 μmol/L Sal B处理可以有效抑制H2O2引起的p-ERK1/2 激活。同时Sal B可以降低细胞基础的p-ERK1/2表达,见图5。
讨 论
ROS在氧化应激状态下一方面可以通过细胞膜脂质过氧化,抑制蛋白质功能,破坏核酸和染色体等方式损伤细胞;另一方面ROS亦可作为第二信使,激活多种氧敏感的信号分子,调节多种基因表达,继而调控多种生理和病理过程,在细胞和组织和器官的发育和生长过程中发挥重要的作用[4-6]。BMSCs是一类存在于骨髓网状间质内的非造血干细胞,已被广泛应用到临床骨损伤、缺血缺氧性神经元细胞和心肌细胞损伤的修复及治疗。但由于组织在缺血缺氧性损伤和缺血再灌注过程中,细胞内ROS清除系统功能降低,生成系统活性增强,引起ROS大量产生和堆积,而损伤局部不断聚集的ROS不仅导致了组织细胞的损伤,也阻碍了移植BMSCs的迁移、分化,甚至直接导致了它们的凋亡或坏死,从而减少了它们在损伤局部的存活数量,从根本上限制了它们在组织修复中的应用。因此,如果能够采用一定的措施降低损伤局部的氧化应激水平或者提高细胞的抗氧化应激能力就可以很好地降低移植细胞的丢失率,收到更为理想的治疗效果。
Sal B具有很强的抗氧化作用,可以清除超氧阴离子和自由基,抑制脂质过氧化反应,其抗氧化作用高于维生素C、维生素E以及银杏提取物(EGb761),是目前己知的抗氧化作用最强的天然产物之一[7]。既往的研究显示Sal B能够通过降低炎症因子刺激下血管内皮细胞渗通性、减少VCAM-1和ICAM-1等细胞黏附因子的表达、抑制血小板的凝集、增加纤维蛋白溶解等多种机制治疗缺血再灌注心肌损伤、急性心肌梗死、动脉粥样硬化等疾病[8,9]。同时也有研究表明,Sal B可以抑制肝星形细胞的激活,减少胶原纤维的合成对治疗肝硬化有较好疗效[10,11]。而最近一些研究则发现Sal B对小鼠缺血再灌注引起的脑损伤有保护作用。静脉注射Sal B可以减少缺血脑组织的缺血体积,降低脑组织中的MDA含量[12]。实验证实,Sal B对脑缺血再灌注引起的记忆功能碍有明显改善作用。体外实验证实Sal B可以减少氧化应激、Aβ等刺激因素引起的大鼠神经细胞凋亡现象[12,13]。本课题组曾在2007年首创性地将Sal B应用于脊髓损伤的治疗研究[14]。实验结果显示Sal B和BMSCs的联合应用可以促进移植BMSCs的存活,更好地促进脊髓损伤大鼠的后肢功能恢复;在体外还观察到Sal B可以有效保护BMSCs免受炎症因子TNF-α刺激引起的损伤。以上一系列研究资料提示了Sal B增强BMSCs对有害刺激的防御能力,提高细胞移植成活率的可能性。本实验首先观察了不同浓度Sal B对500 μmol/L H2O2引起的BMSCs细胞活性下降和细胞凋亡数目增加效应的影响。结果显示500 μmol/L H2O2的刺激下,BMSCs细胞活性明显下降,细胞凋亡数目增加。而Sal B处理不仅可以提高氧化应激状态下BMSCs的细胞活性,也减少了500 μmol/L H2O2引起的细胞凋亡。
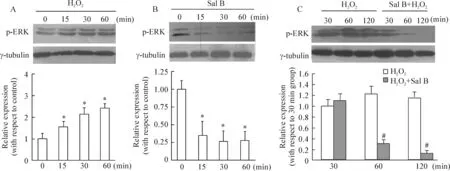

图5不同处理p-ERK1/2蛋白水平的时程变化
氧化应激状态下,细胞内多个信号转导通路被激活。这些信号通路之间的关系错综复杂,它们的激活对于细胞存活或死亡起着至关重要的作用。MEK/ERK是其中一条研究较多的通路。最早的研究资料表明MEK/ERK信号通路调控细胞的生长、存活和分化[15,16]。在损伤因素刺激下p-ERK1/2的激活有助于机体调动体内的抗凋亡机制,抵抗有害因素的损伤,提高机体的适应能力,提高细胞存活。但随着研究的进一步深入,Fischer等[17]则持相反意见,他们指出p-ERK1/2的激活是一定刺激条件下引发细胞凋亡的必要步骤,扮演着凋亡主要执行者caspase-3上游基因的角色。对于这样矛盾的资料,Liu等[18]认为这是由于p-ERK1/2基因功能复杂性所导致的,p-ERK1/2究竟促进凋亡还是抑制凋亡应该取决于不同的细胞 。而在BMSCs,观察到p-ERK1/2促进凋亡,而Sal B的应用可以有效抑制氧化应激状态下ERK1/2的激活。实验观察到Sal B抑制氧化应激介导的BMSCs凋亡与MEK/ERK通路相关,这与早前Liu等[18]在rCMECs上观察到的相一致。
存在问题:由于实验条件制约,本实验主要把研究重点集中放在MEK/ERK信号通路在Sal B抑制氧化应激介导BMSCs凋亡的作用上,没有全面探讨其它信号通路如PI3K等在这个过程中的作用,在以后的实验里应该继续探讨其它凋亡相关信号通路在Sal B抑制氧化应激介导BMSCs凋亡效应中的作用以进一步明确Sal B的作用机制,为这种中药单体的临床应用提供更多的实验依据。本室已在此工作基础上开展Sal B促进脊髓损伤康复的研究和基因修饰BMSCs治疗脑缺血损伤的研究[19,20]。
实验结果显示Sal B可以增强BMSCs抗氧化应激能力从而减少H2O2刺激引起的细胞凋亡,其保护机制可能与Sal B直接降低氧化应激情况下细胞内活性氧的生成水平,抑制前凋亡基因p-ERK1/2的激活有关。这为Sal B这种中药单体的临床应用提供新的实验依据。
[1] Meirelles Lda S, Nardi NB. Methodology, biology and clinical applications of mesenchymal stem cells[J]. Front Biosci, 2009,14: 4281-4298.
[2] Patel AN, Spadaccio C, Kuzman M, et al. Improved cell survival in infarcted myocardium using a novel combination transmyocardial laser and cell delivery system [J]. Cell Transplant, 2007, 16(9): 899-905.
[3] Geng YJ. Molecular mechanisms for cardiovascular stem cell apoptosis and growth in the hearts with atherosclerotic coronary disease and ischemic heart failure[J]. Ann N Y Acad Sci, 2003, 1010: 687-697.
[4] Song YS, Lee BY, Hwang ES, et al. Distinct ROS and biochemical profiles in cells undergoing DNA damage-induced senescence and apoptosis[J]. Mech Ageing Dev, 2005, 126(5): 580-590.
[5] Wiseman A. p53 protein or BID protein select the route to either apoptosis (programmed cell death) or to cell cycle arrest opposing carcinogenesis after DNA damage by ROS[J]. Med Hypotheses, 2006, 67(2): 296-299.
[6] Jung U, Zheng X, Yoon SO, et al. Se-methylselenocysteine induces apoptosis mediated by reactive oxygen species in HL-60 cells[J]. Free Radic Biol Med, 2001, 31(4): 479-489.
[7] Liu CS, Cheng Y, Hu JF, et al. Comparison of antioxidant activities between salvianolic acid B andGinkgobilobaextract (EGb 761) [J]. Acta Pharmacol Sin,2006,27(9):1137-1145.
[8] He HB, Yang XZ, Shi MQ, et al.Comparison of cardioprotective effects of salvianolic acid B and benazepril on large myocardial infarction in rats[J]. Pharmacol Rep, 2008,60(3):369-381.
[9] Chen YH, Lin SJ, Ku HH, et al. Salvianolic acid B attenuates VCAM-1 and ICAM-1 expression in TNF-α-treated human aortic endothelial cells[J]. J Cell Biochem, 2001, 82(3):512-521
[10]Lin YL, Wu CH, Luo MH, et al.Invitroprotective effects of salvianolic acid B on primary hepatocytes and hepatic stellate cells[J]. J Ethnopharmacol, 2006,105(1-2):215-222.
[11]Zhao JF, Liu CH, Hu YY, et al. Effect of salvianolic acid B on Smad3 expression in hepatic stellate cells[J].Hepatobiliary Pancreat Dis Int, 2004,3(1):102-105.
[12]Tian J, Li G, Zhang S, et al. SMND-309, a novel derivate of salvianolic acid B, attenuates apoptosis and ameliorates mitochondrial energy metabolism in rat cortical neurons[J]. Basic Clin Pharmacol Toxicol, 2009,104(2):176-184.
[13]Tian J, Fu F, Li G, et al. SMND-309, a novel derivate of salvianolic acid B, ameliorates cerebral infarction in rats: Characterization and role[J]. Brain Res, 2009,1263:114-121.
[14]Bi XB, Deng YB, Gan DH, et al.Salvianolic acid B promotes survival of transplanted mesenchymal stem cells in spinal cord-injured rats[J]. Acta Pharmacol Sin, 2008,29(2):169-176.
[15]Yang B, Oo TN, Rizzo V.Lipid rafts mediate H2O2prosurvival effects in cultured endothelial cells[J]. FASEB J,2006,20(9): 1501-1503.
[16]Wang J, Shen YH, Utama B, et al. HCMV infection attenuates hydrogen peroxide induced endothelial apoptosis-involvement of ERK pathway[J]. FEBS Lett, 2006,580(11): 2779-2787.
[17]Fischer S, Wiesnet M, Renz D, et al. H2O2induces paracellular permeability of porcine brain-derived microvascular endothelial cells by activation of the p44/42 MAP kinase pathway[J]. Eur J Cell Biol,2005,84(7): 687-697.
[18]Liu CL,Xie LX,Li M, et al. Salvianolic acid B inhibits hydrogen peroxide-induced endothelial cell apoptosis through regulating PI3K/Akt signaling[J].PLoS ONE,2007,2(12):e1321.
[19]邓宇斌,甘丹卉,卢碧燕,等. 丹酚酸B促进大鼠急性脊髓损伤修复及量效关系探讨[J].中华神经医学杂志,2009,8(10):1019-1023.
[20]叶伟标,邓宇斌,叶美红,等.慢病毒载体介导HIF-1α基因修饰骨髓间质干细胞促进脑缺血大鼠神经功能恢复的研究[J]. 中国病理生理杂志,2010, 26(2):256-261.
SalvianolicacidBreducesapoptosisofbonemarrowstemcellsinducedbyhydrogenperoxide
LU Bi-yan1, TONG Xiu-zhen2, DENG Yu-bin1, WU Hong-fu1, HOU Jing-yi1
(1DepartmentofPathophysiology,ZhongshanSchoolofMedicine,2DepartmentofHematology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail:dengyub@mail.sysu.edu.cn)
AIM: To investigate the effect of salvianolic acid B (Sal B) on apoptosis of rat bone mesenchymal stem cells(BMSCs) induced by hydrogen peroxide(H2O2).METHODSBMSCs were incubated with Sal B at the concentration of 1, 10 or 100 μmol/L while treated with lethal concentration of H2O2(500 μmol/L). The effect of Sal B at different concentrations on the viability of BMSCs was detected by MTT. Flow cytometry were used to determine the protective role of Sal B in apoptosis of BMSCs. The changes of chromatin distribution in BMSCs were observed by Hoechst 33342 staining. The expression of p-ERK1/2 was detected by Western blotting.RESULTSSal B protected the BMSCs against H2O2as the cell viability was increased from (53.60±4.21)% to (85.33±9.08)% or (75.78±6.28)% in a dose-dependent manner. After exposed to H2O2, about 50%-65% BMSCs displayed apoptotic morphology. Treatment with Sal B at the concentrations of 10 and 100 μmol/L reduced the cytotoxic effect of H2O2on BMSCs to about 32% and 47%, respectively. The results of flow cytometric analysis confirmed the cytoprotective effect of Sal B. This protective effect was concomitant with significant reduction of ROS generation. Moreover, H2O2time-dependently induced a pronounced increase in ERK1/2 phosphorylation,which was effectively inhibited by Sal B.CONCLUSIONSal B protects BMSCs against H2O2-induced apoptosis. Sal B may exert its protective effect on BMSCs by triggering intracellular anti-apoptosis mechanism as well as reducing the oxidative stress.
Salvianolic acid B; Bone mesenchymat stem cells; Oxidative stress; Reactive oxygen species; Extracellular signal-regulated kinase 1/2
R363
A
1000-4718(2011)03-0475-06
2010-09-16
2010-12-15
广东省中医药局资助项目(No.2008078);广东省自然科学基金资助项目(No.C030307);中山大学国家大学生创新训练项目(No.200834;No.200837)
△通讯作者 Tel:020-87331698;E-mail:dengyub@mail.sysu.edu.cn
10.3969/j.issn.1000-4718.2011.03.011
