人脐带间充质干细胞低氧条件培养液对小鼠造血系统自然衰老的影响*
2011-10-24周艳华许婷婷何冬梅谭广销刘革修
周艳华, 许婷婷, 李 军, 何冬梅, 谭广销, 刘革修
(暨南大学医学院血液病研究所,广东 广州 510632)
人脐带间充质干细胞低氧条件培养液对小鼠造血系统自然衰老的影响*
周艳华, 许婷婷, 李 军, 何冬梅, 谭广销, 刘革修△
(暨南大学医学院血液病研究所,广东 广州 510632)
目的通过探讨人脐带间充质干细胞(hUC-MSCs)低氧条件培养液对小鼠造血系统自然衰老的延缓作用,进一步了解hUC-MSCs对机体造血的支持作用机制。方法将6月龄的BALB/c小鼠随机分为实验组和对照组,前者腹腔注射hUC-MSCs低氧条件培养液,每4 d 1次,持续6个月;后者注射培养基。干预后观察小鼠一般情况,并于干预后第3个月和第6个月分别比较两组的外周血象(白细胞与血红蛋白)、单侧股骨骨髓有核细胞(BMCN)计数、造血祖细胞集落(CFU-GM、 CFU-E、 CFU-MK)培养、成纤维细胞集落(CFU-F)培养和外源性脾集落形成单位(CFU-S)计数。于第6个月时观察骨髓病理变化、测定比较骨髓细胞重建造血能力及P16蛋白表达情况。结果实验组小鼠的一般情况优于对照组;干预后第3个月,实验组的BMNC、CFU-GM和CFU-MK多于对照组,而外周血象、CFU-F和CFU-E无明显差别;干预后第6个月,外周血象仍无显著差别,其余的上述指标实验组均明显高于对照组,且各组的这些指标随时间变化呈不断下降的趋势,但实验组的下降速度明显慢于对照组,差异显著(P<0.05)。组织学观察发现,实验组造血组织较对照组丰富,P16蛋白的表达也明显低于对照组,而对照组骨髓脂肪化显著增加;实验组骨髓细胞的造血重建能力明显优于对照组。结论hUC-MSCs分泌的细胞因子能够延缓小鼠造血系统的衰退,有望应用于延缓衰老的研究。
间充质干细胞; 脐带; 衰老; 细胞因子类
间充质干细胞(mesenchymal stem cells,MSCs)因具有独特的、多样的生物学活性而成为近年医学研究热点,因为具有免疫调节作用而被应用于免疫性疾病治疗,因为具有多向分化潜能而被应用于再生医学研究与应用,因为可分泌多种细胞因子和生长因子而被应用于调节组织特异细胞生物学活性研究[1,2]。然而在培养MSCs过程中换液常常将这些细胞因子、生长因子等丢弃了。这些培养液是否存在潜在价值呢?本研究采用人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)低氧条件培养液对小鼠自然衰老进行干预研究,观察是否对造血系统有积极作用,以期为延缓造血干细胞衰老的研究开辟一条新思路。
材 料 和 方 法
1材料
足月剖宫产健康新生儿的脐带取自暨南大学华侨医院;6月龄雌性BALB/c纯系小鼠40只、8周龄雌性BALB/c小鼠80只,SPF级,体重(20±2) g,购自广东省医学实验动物中心,动物合格证号:SCXK(粤)2008-0002,所有动物实验均按照中国科学技术委员会颁发的实验动物管理条例执行,在无菌条件下饲养;DMEM/F12培养基、IMDM培养基、胶原酶Ⅳ和胰蛋白酶均购自Gibco;胎牛血清(fetal bovine serum,FBS)购自PAA;甲基纤维素、地塞米松、胰岛素、抗坏血酸、β-磷酸甘油与油红O购自Sigma;促红细胞生成素(erythropoietin,EPO)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、干细胞因子(stem cell factor,SCF)和促血小板生成素(thrombopoietin,TPO)均购自Peprotech;P16免疫组织化学试剂盒购自福州迈新生物技术公司。
2方法
2.1脐带间充质干细胞的分离培养及低氧条件培养液的制备 脐带间充质干细胞的分离培养及鉴定按文献报道[3]的方法进行。经过鉴定的第5代细胞生长至80%融合时换不含血清的营养丰富培养液并置于37 ℃、5% O2、5% CO2、饱和湿度培养箱中培养24 h,收集培养液保存于-80°备用。
2.2hUC-MSCs低氧条件培养液干预小鼠造血系统自然衰老的观察 随机取8只6月龄雌性BALB/c小鼠,于干预前测定其单侧股骨骨髓有核细胞计数、成纤维细胞集落、造血祖细胞集落培养、外源性脾集落形成单位计数,剩余的随机分为实验组和对照组,每组16 只。实验组为hUC-MSCs低氧培养液干预组:经腹腔输注制备好的hUC-MSCs 低氧条件培养液0.5 mL,每4 d 1次,持续输注6个月;对照组为未干预组: 经腹腔相应地输注0.5 mL培养基。2组动物分别于干预开始后第3个月、第6个月测定外周血象、骨髓有核细胞计数、成纤维细胞集落培养和造血祖细胞集落培养计数,并比较各组小鼠生存情况;第6月时,观察骨髓病理变化及P16蛋白表达情况、对骨髓细胞造血重建能力进行测定比较。
2.3外周血象测定及骨髓有核细胞(bone marrow nucleated cell,BMNC)计数 实验组和对照组分别于干预前、干预后第3个月和第6个月尾静脉取血,常规测定其外周血白细胞(white blood cell,WBC)和血红蛋白(hemoglobin,Hb)。于第3个月时每组各处死8只小鼠,无菌条件下取出左侧股骨,按照常规方法,计数BMNC,调整细胞浓度用于祖细胞集落培养、成纤维细胞集落培养。于第6个月时处死各组剩余的8只小鼠,方法同前,计数BMNC,并进行祖细胞集落培养、成纤维细胞集落培养及骨髓细胞造血重建能力的测定,且另一侧股骨用于做骨髓病理切片。
2.4造血祖细胞集落(colony-forming units-granulocyte and macrophage, CFU-GM;colony-forming units-erythroid,CFU-E;colony-forming units-megakaryocyte,CFU-MK)培养 将上述方法得到的骨髓有核细胞,接种于24孔板,细胞浓度为2×108cells/L,0.5 mL cells/well,1个复孔,分别在以下3种体系中进行培养:(1)CFU-GM培养体系:含20%的FBS、G-CSF 60 μg/L、SCF 20 μg/L和0.8%甲基纤维素的IMDM培养基;(2)CFU-E培养体系:含20%的FBS、EPO 4 kU/L、SCF 20 μg/L和0.8%甲基纤维素的IMDM培养基;(3)CFU-MK培养体系:含20%的FBS、TPO 60 μg/L、SCF 20 μg/L和0.8%甲基纤维素的IMDM培养基。置于37 ℃、5% CO2、饱和湿度培养箱中孵育,3 d后计数CFU-E集落数,大于8个细胞计数为1个集落;7 d后计数CFU-GM集落数,大于50个细胞计数为1个集落;14 d 后计数CFU-MK集落数,大于3个细胞计数为1个集落。
2.5成纤维细胞集落形成单位( fibroblast colony-forming units,CFU-F)培养 建立CFU-F培养体系[4],再加入已制备好的骨髓细胞悬液,以5×104cells/cm2的密度接种于6孔板,置于37 ℃、7% CO2、饱和湿度培养箱中培养,每3 d换液1次,第14 d在倒置显微境下计数大于30个细胞的集落。
2.6外源性脾集落形成单位(exogenous spleen colony-forming units,CFU-S)计数 CFU-S计数反映供体小鼠骨髓细胞居留在受体小鼠脾脏造血组织中的干细胞数量。受体为8周龄雌性BALB/c小鼠,在接受致死量[60Coγ](8 GY)照射后4 h左右,由尾静脉注射上述过程中得到的骨髓有核细胞各0.2 mL(含2×106cells)。2周后,断颈处死小鼠取出脾脏,浸在Bouin液中24 h,80%乙醇中脱色3 d(每天换液1次),然后进行CFU-S 计数。
2.7骨髓病理变化及P16蛋白表达测定 在上述过程中得到的股骨快速放入体积分数为4%盐酸甲醛脱钙固定液中,12 h后进行常规脱水、浸蜡、石蜡包埋、切片,HE染色后在显微镜下观察骨髓造血组织情况并摄像。骨髓组织的衰老程度观察通过检测其P16蛋白的表达情况,采用免疫组织化学染色检测,操作步骤按试剂盒说明进行,DAB显色,封片后并摄像。
2.8骨髓细胞的造血重建能力测定 干预后第6个月,进行骨髓移植实验,受体为8周龄雌性BALB/c小鼠,40只,分为5 组(8只/组);供体为上述得到的骨髓有核细胞以及另外制备的年轻小鼠的骨髓细胞。受体小鼠在接受致死量[60Coγ](8 GY)照射后4 h内进行移植。(1)Ⅰ组:供体小鼠为经hUC-MSCs培养液干预后的小鼠,受体接受照射后,输注细胞0.1 mL(含5×106cells);(2)Ⅱ组:供体小鼠为未经hUC-MSCs培养液干预的小鼠,受体接受照射后,输注细胞0.1 mL(含5×106cells);(3)Ⅲ组:供体为年轻的8周龄小鼠,受体接受照射后,输注细胞0.1 mL(含5 ×106cells);(4)Ⅳ组:单纯照射组,受体接受照射后,输注IMDM 0.1 mL;(5)Ⅴ组:空白对照组,不接受照射,仅输注IMDM 0.1 mL。移植后,小鼠每天饮庆大霉素酸化水(4×105U/L)。观察各组小鼠一般情况更及存活状态;各组分别在照射前(+0 d)及照射后+7 d、+14 d、+21 d、+28 d测定小鼠外周血WBC及Hb变化,并进行各组生存率比较。
3统计学处理
结 果
1小鼠MSCs输注实验中一般情况观察
对照组小鼠在观察期内(6-12月龄)出现毛发粗糙无光泽,脱毛较多,体重减轻,运动逐渐迟缓,精神状态较差;而实验组小鼠在观察期内毛发保持光亮,较少脱毛,体重保持稳定,运动能力及精神状态改变不明显。
2hUC-MSCs低氧条件培养液输注对小鼠造血系统的影响
经测定比较两组小鼠外周血象,无显著差异,随着时间的变化也未出现显著波动,见表1。但是其余指标变化明显,干预后第3个月测定,实验组的BMNC、CFU-GM、CFU-MK计数均高于对照组(P<0.05),而CFU-F、CFU-E、CFU-S计数无显著差异;第6个月测定实验组的指标均明显高于对照组(P<0.05)。随时间变化各组指标变化呈不同的趋势,实验组下降速度明显慢于对照组,差异显著(P<0.05),见表2。
3hUC-MSCs低氧条件培养液输注对小鼠骨髓病理变化及P16蛋白的影响
骨髓切片显示,实验组有核细胞较多,造血组织明显多于对照组;而对照组脂肪组织明显多于实验组,见图1A-C。P16蛋白与造血组织衰老程度密切相关,大都表达在细胞浆中,经免疫组化染色后,阳性细胞呈棕黄色,实验组P16蛋白表达量明显低于对照组,但高于年轻的8周龄小鼠,见图2A-C。
表1hUC-MSCs条件培养液干预对小鼠外周血象的影响

ExperimentalgroupControlgroupWBCHbWBCHbBeforeintervention9.73±3.08103.90±15.959.26±1.73100.46±2.073rdmonth9.50±1.13109.34±13.658.99±1.91104.72±14.076thmonth9.74±2.67114.85±18.989.59±2.49105.48±3.37
表2hUC-MSCs条件培养液对小鼠BMNC计数、造血祖细胞集落生长、CFU-F和CFU-S的影响

ExperimentalgroupControlgroupBeforeintervention3rdmonth6thmonthBeforeintervention3rdmonth6thmonthBMNC9.9±2.210.0±1.2▲9.5±0.8◆10.5±1.98.9±1.37.9±0.8CFU-GM37.0±8.835.2±6.6##31.7±8.6∗∗36.5±7.827.5±8.421.4±9.6CFU-E29.9±6.125.9±7.925.7±6.9∗∗31.9±5.825.4±7.019.1±6.1CFU-MK54.5±11.557.8±12.4▲52.5±11.6∗∗53.4±10.549.8±12.241.2±9.1CFU-S44.3±9.342.5±10.842.5±4.9∗∗45.1±10.340.6±11.133.7±8.4CFU-F63.4±12.756.8±12.050.1±11.0∗∗61.9±11.952.1±11.740.6±8.9
▲P<0.05vscontrol group at 3rd month;##P<0.01vscontrol group at 3rd month;◆P<0.05vscontrol group at 6th months;**P<0.01vscontrol group at 6th months.The change trends were different with time,P<0.05.
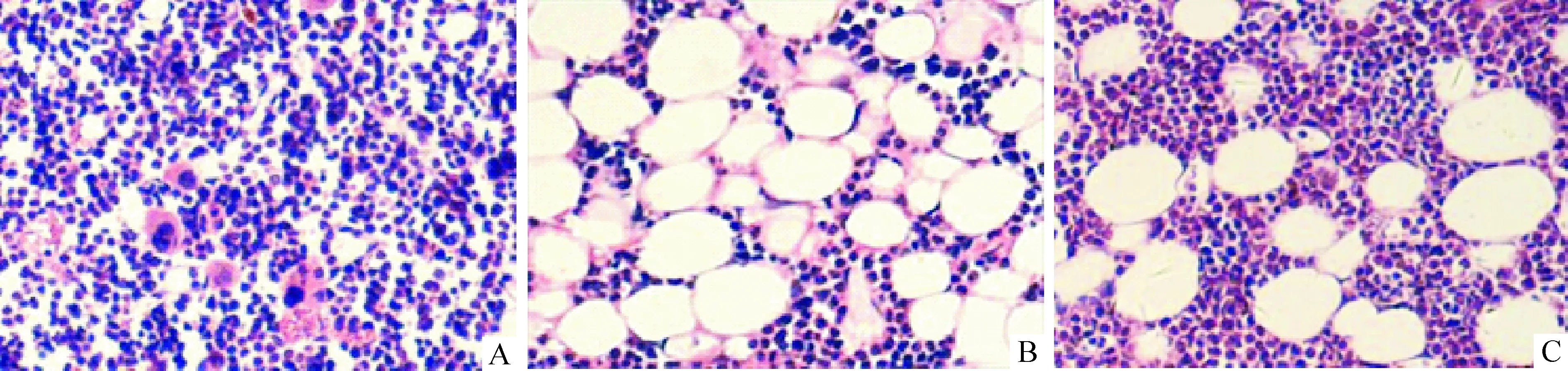
Figure 1. Histological observation of mouse bone marrow (HE staining,×100). A:the bone marrow biopsy of young mice,with very rich hematopoietic tissue and almost invisible adipose tissue;B:the bone marrow biopsy of control group, less hematopoietic tissue was observed and much more adipose tissue was filled in almost the whole marrow cavity;C:the bone marrow biopsy of experimental group, more hematopoietic tissue and less adipose tissue were found compared with that of control group.
图1小鼠骨髓组织学观察

Figure 2. The expression of P16 protein in mouse bone marrow(×200). A:young mice;B:conrtrol group;C:experimental group;D:negative control.
图2骨髓P16蛋白的表达量
4hUC-MSCs低氧条件培养液输注后的供体对小鼠骨髓细胞造血重建能力的影响
不同时点WBC、Hb量及其两者动态变化的比较可以反映不同供体骨髓重建造血的能力。移植后1-2周为小鼠骨髓抑制的严重期,Ⅳ组小鼠死亡时间为第+6 d-第+14 d,主要死于造血衰竭。Ⅰ、Ⅱ、Ⅲ各组的指标随时间恢复的趋势不同(P<0.01),Ⅲ组WBC与Hb恢复最快,Ⅱ组恢复最慢,Ⅰ组介于两者之间,见表3、4。Ⅳ组生存率为0,Ⅲ组与Ⅴ组的小鼠全部存活,Ⅰ、Ⅱ组均有小鼠死亡,但Ⅰ组生存率(88.5%)高于Ⅱ组(63.5%)。
表3 各组小鼠不同时点外周血WBC的变化
▲▲P<0.01vsⅡ group;##P<0.01vsⅢ group;○P<0.05vsⅣ group;●●P<0.01vsⅣ group;**P<0.01vsⅤ group.
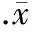
表4 各组小鼠不同时点外周血Hb的变化
▲▲P<0.01vsⅡ group;○○P<0.01vsⅢ group;#P<0.05vsⅢ group;●●P<0.01vsⅣ group;**P<0.01vsⅤ group.
讨 论
衰老(aging or senescence)是机体的细胞、组织与器官在结构和功能上逐渐出现不可逆转地、全面地退化,其关键在于组织特异干细胞衰老、再生能力下降。造血系统作为人体重要的系统之一,随着年龄的增长会出现功能不断衰退。造血系统的核心是造血干细胞(hematopoietic stem cells,HSCs),通过增殖与发育分化以持续补充机体各种血细胞需要;而骨髓MSCs则与基质等组成造血微环境,支持调节HSCs生物学活性。造血系统渐进的衰老表现为造血细胞的产生及造血微环境稳态调控能力的下降[4,5],其最终结果是造血功能衰退、不能满足机体需要。HSCs衰老表现为自我复制与增殖能力下降,导致骨髓中造血干/祖细胞数量减少;MSCs衰老则表现为分泌重要细胞因子和生长因子的能力下降、对HSCs调节支持作用下降,而且向脂肪细胞分化、抑制造血[6]。那么,有什么措施延缓造血系统衰老、调整机体健康状态?
几十年国内外骨髓移植结果显示,HSCs具有极强的免疫原性和免疫力、可产生移植排斥反应;而且进行骨髓移植难度极大。所以,直接运用年轻HSCs取代机体内衰老HSCs具有极大难度,很难被应用于抗衰老。既然衰老MSCs分泌重要细胞因子和生长因子的能力下降、对HSCs调节支持作用下降,那么,是否可以通过补充相应重要细胞因子和生长因子以增强对HSCs支持作用呢?本研究给中老年老鼠定期输注间充质干细胞低氧条件培养液,结果发现这不仅可改善其一般情况,还可以调节骨髓造血干/祖细胞数量与质量以及骨髓造血微环境:实验组小鼠骨髓造血祖细胞集落数、外源性脾集落形成单位数、造血重建能力和CFU-F数均显著高于同期对照组小鼠;组织学观察显示实验组造血组织比同期对照组丰富、脂肪化轻,而且未经MSCs低氧条件培养液干预的小鼠骨髓P16蛋白表达量明显高于干预小鼠。P16蛋白是抑癌基因P16编码,是细胞周期蛋白依赖激酶抑制因子,是细胞衰老的重要指标,通过阻止pRb蛋白磷酸化,进而抑制从G1期进入S期所需的下游基因的表达,将细胞周期阻断在G1期、细胞则逐渐衰老;抑制P16,细胞周期蛋白依赖激酶活性增加,pRb磷酸化失活,转录因子EZF活性增高,多种生命必需基因得以表达,DNA修复能力增强,端粒缩短减慢,从而延缓细胞衰老[7,8]。所以,本研究结果说明hUC-MSCs低氧条件培养液干预可延缓小鼠造血系统自然衰老。由于hUC-MSCs可被干扰素-γ激活而提高MHCⅠ类分子的表达水平并表达MHCⅡ类分子,如将其多次注射于炎症区域或注射前应用干扰素-γ则能诱发免疫反应[9],因此,与直接应用hUC-MSCs本身相比,其条件培养液在临床应用方面可能具有其优点,如在不能直接应用hUC-MSCs时选择其条件培养液。
hUC-MSCs低氧条件培养液为什么具有这些作用呢?研究显示,hUC-MSCs 不仅具有极强的增殖和分化能力[10,11],表达原始干细胞标志,如白血病抑制因子受体通路、胚胎干细胞特异基因Ⅰ、Nanog、Oct-4等[12,13],具有干细胞特性;而且能分泌多种细胞因子,如白细胞介素-6、单核细胞趋化蛋白-1、生长相关癌基因、肝细胞生长因子、胰岛素样生长因子结合蛋白4和白细胞介素-8等[14],支持CD34+脐带血HSCs扩增[15];支持ESCs发育分化[16]。这些资料说明hUC-MSCs具有极强的生物学活性,可产生重要因子发挥支持调节作用。最近研究发现干细胞在低氧环境中具有更好的生物学活性。MSCs培养在低氧环境中不仅增殖更快,而且干细胞标志性基因表达水平更高,端粒逆转录酶的活性增加[17,18]。利用人体皮肤细胞培养iPS细胞时把培养环境的氧浓度从通常的21%降到5%,iPS细胞的生成效率可提高到原来的2.5-4.2倍[19]。刘革修等[20-23]研究发现MSCs在低氧环境中多种生长因子表达增高。所以,推测hUC-MSCs低氧条件培养液延缓小鼠造血系统自然衰老作用可能与hUC-MSCs在低氧条件下分泌重要细胞因子和生长因子有关。其详细情况有待进一步研究。
[1] Noort WA, Feye D, Van Den Akker F, et al. Mesenchymal stromal cells to treat cardiovascular disease:strategies to improve survival and therapeutic results[J]. Panminerva Med,2010,52(1):27-40.
[2] Kode JA, Mukherjee S, Joglekar MV, et al. Mesenchymal stem cells:immunobiology and role in immunomodulation and tissue regeneration[J]. Cytotherapy,2009,11(4):377-391.
[3] 许婷婷,周艳华,刘革修,等. 人脐带间充质干细胞对小鼠自然衰老过程中骨髓脂肪化的影响[J].中国病理生理杂志,2010,26(4):816-818.
[4] Naveiras O, Nardi V, Wenzel PL, et al. Bone-marrow adipocytes as negative regulators of the haematopoietic microenvironment[J]. Nature,2009,460(7252):259-263.
[5] Ksiazek K. A comprehensive review on mesenchymal stem cell growth and senescence[J]. Rejuvenation Res,2009,12(2):105-116.
[6] Fehrer C, Lepperdinger G. Mesenchymal stem cell aging[J]. Exp Gerontol,2005,40(12):926-930.
[7] Krishnamurthy J, Torrice C, Ramsey MR, et al. Ink4a/Arf expression is a biomarker of aging[J]. J Clin Invest,2004, 114(9):1299-1307.
[8] Ohtani N, Yamakoshi K, Takahashi A, et al. The p16INK4a-RB pathway: molecular link between cellular senescence and tumor suppression[J]. J Med Invest,2004,51(3-4):146-153.
[9] Cho PS, Messina DJ, Hirsh EL, et al. Immunogenicity of umbilical cord tissue derived cells[J]. Blood,2008,111(1):430-438.
[10]Lu LL, Liu YJ, Yang SG, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica,2006,91(8):1017-1026.
[11]Kestendjieva S, Kyurkchiev D, Tsvetkova G, et al. Characterization of mesenchymal stem cells isolated from the human umbilical cord[J]. Cell Biol Int,2008,32(7):724-732.
[12]Weiss ML, Medicetty S, Bledsoe AR, et al. Human umbilical cord matrix stem cells:preliminary characterization and effect of transplantation in a rodent model of Parkinson’s disease[J]. Stem Cells,2006,24(3):781-792.
[13]Weiss ML, Anderson C, Medicetty S, et al. Immune properties of human umbilical cord Wharton’s jelly-derived cells[J]. Stem Cells,2008,26(11):2865-2874.
[14]Chao KC, Chao KF, Chen CF, et al. A novel human stem cell coculture system that maintains the survival and function of culture islet-like cell clusters[J]. Cell Transplant,2008,17(6):657-664.
[15]Bakhshi T, Zabriskie RC, Bodie S, et al. Mesenchymal stem cells from the Wharton’s jelly of umbilical cord segments provide stromal support for the maintenance of cord blood hematopoietic stem cells during long-termexvivoculture[J]. Transfusion,2008,48(12):2638-2644.
[16]Hiroyama T, Sudo K, Aoki N, et al. Human umbilical cord-derived cells can often serve as feeder cells to maintain primate embryonic stem cells in a state capable of producing hematopoietic cells[J]. Cell Biol Int,2008,32(1):1-7.
[17]D’Ippolito G, Diabira S, Howard GA, et al. Low oxygen tension inhibits osteogenic differentiation and enhances stemness of human MIAMI cells[J]. Bone,2006,39(3):513-522.
[18]Grayson WL, Zhao F, Izadpanah R, et al. Effects of hypoxia on human mesenchymal stem cell expansion and plasticity in 3D constructs[J]. J Cell Physiol,2006,207(2):331-339.
[19]Yoshida Y, Takahashi K, Okita K, et al. Hypoxia enhances the generation of induced pluripotent stem cells[J]. Cell Stem Cell,2009,5(3):237-241.
[20]刘革修, 张 洹, 何冬梅, 等. 低氧诱导胎肝间质细胞表达碱性成纤维生长因子[J]. 第二军医大学学报,2005,26(9):1012-1014.
[21]刘革修, 张 洹, 何冬梅, 等. 低氧诱导胎肝基质细胞表达转化生长因子β1表达升高[J]. 第二军医大学学报,2005,26(10):1148-1151.
[22]刘革修,张 洹, 何冬梅. 人骨髓间充质细胞在低氧培养条件下脑源性神经营养因子的表达[J]. 中国临床康复,2006,10(29):1-3.
[23]刘革修, 张 洹, 何冬梅. 低氧诱导胎肝间质细胞表达胰岛素样生长因子[J]. 中国老年学杂志,2007,27(2):129-131.
Effectsofhypoxic-conditionedmediumofmesenchymalstemcellsfromhumanumbilicalcordonnaturalsenescenceofmousehematopoieticsystem
ZHOU Yan-hua, XU Ting-ting, LI Jun, HE Dong-mei, TAN Guang-xiao, LIU Ge-xiu
(InstituteofHematology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tliugx@jnu.edu.cn)
AIM: To explore the anti-aging roles of hypoxic-conditioned medium of mesenchymal stem cells from human umbilical cord (hUC-MSCs) on the natural senescence of hematopoietic system in aging mice.METHODSThe 6-month-old BALB/c mice were randomly divided into experimental group and control group. The mice in experimental group were intraperitoneally injected with hypoxic-conditioned medium of hUC-MSCs every 4 days for 6 months, and the mice in control group were injected with medium. After treated with hypoxic-conditioned medium of hUC-MSCs, the general situations of the mice were observed. Three months and 6 months after treatment, peripheral hemogram(white blood cell and hemoglobin), bone marrow nucleated cell (BMNC)count, hematopoietic progenitor cell colony (CFU-GM, CFU-E, CFU-MK)culture, fibroblast colony (CFU-F)culture, and exogenous spleen colony-forming unit (CFU-S)count were compared between the 2 groups. Bone marrow histology, P16 expression, and the capability of hematopoietic reconstruction of the bone marrow cells were also compared at the sixth month.RESULTSThe general status of the mice in experimental group was better than that in control group. At the third month, BMNC, CFU-GM and CFU-MK of the experimental group were higher than those in control group. No significant difference of the peripheral hemogram, CFU-F, CFU-E and CFU-S was observed. At the sixth month, all the indexes mentioned above in experimental group were higher than those in control group except peripheral hemogram. All the indexes had a similar descending-tendency during 6 months, but the tendency of experimental group was much slower than that of control group with significant difference (P<0.05). In experimental group, more hematopoietic tissue and less adipose tissue were observed, and the expression level of P16 was lower than those in control group. The hematopoietic reconstruction capability of bone marrow cells in experimental group was better than that in control group.CONCLUSIONThe cytokines from hUC-MSCs slow down the natural recession of hematopoietic system in aging mice, which may be considered to be a potential strategy of anti-aging research in the future.
Mesenchymal stem cells; Umbilical cord; Aging; Cytokines
R322
A
1000-4718(2011)03-0469-06
2010-10-08
2011-01-13
国家自然科学基金资助项目(No. 30670902)
△通讯作者 Tel:020-85220262;E-mail: tliugx@jnu.edu.cn
10.3969/j.issn.1000-4718.2011.03.010
