一株多菌灵降解菌包埋条件及降解特性
2011-10-20窦晶晶冯贵颖呼世斌西北农林科技大学资源环境学院陕西杨凌700西北农林科技大学理学院陕西杨凌700中国水利水电第三工程局勘测设计研究院陕西西安7006
窦晶晶,冯贵颖,呼世斌*,李 琳(.西北农林科技大学资源环境学院,陕西 杨凌 700;.西北农林科技大学理学院,陕西 杨凌 700;.中国水利水电第三工程局勘测设计研究院,陕西 西安 7006)
一株多菌灵降解菌包埋条件及降解特性
窦晶晶1,冯贵颖2,呼世斌2*,李 琳3(1.西北农林科技大学资源环境学院,陕西 杨凌 712100;2.西北农林科技大学理学院,陕西 杨凌 712100;3.中国水利水电第三工程局勘测设计研究院,陕西 西安 710016)
采用海藻酸钠(SA)和聚乙烯醇(PVA)对 1株多菌灵降解菌进行包埋,并对最佳包埋条件及包埋后的降解效果进行研究.结果表明:SA包埋法的最佳条件为:菌液与2% SA按1:5体积比混合,在4% CaCl2溶液中室温交联24h.PVA包埋法的最佳条件为:菌液与10%PVA按1:5比例混合,在3%CaCl2溶液中室温交联24h.活化48h后,在30℃、 pH6的条件下,SA包埋的多菌灵降解菌对多菌灵的降解率可达80.4%.PVA包埋的降解菌的降解率为76.3%.
多菌灵;降解菌;包埋条件优化;降解特性
多菌灵(MBC)是一种高效广谱低毒的内吸性杀菌剂,常用于蔬菜和谷类的病害防治,性质稳定难降解,易对生态环境造成威害.已有研究[1-2]结果表明,微生物降解是沉积环境中多菌灵去除的主要途径.如果筛选的微生物抗不良环境能力较弱,将使其在自然环境中的降解性能受到影响.固定化微生物技术可以将优势菌种固定,可保持较高的活性[3],提高降解效率[4-5],且被固定化后的细胞具有反应速率快、耐毒害能力强[6]等优势.固定化技术的包埋法是利用线性网状结构的高分子聚合物的加裹作用,使优势菌通过扩散进入多孔载体内,或利用高聚物在形成凝胶时将优势菌包埋于内部[7].包埋形成的载体可防止细胞渗出,但底物仍能渗入并与细胞发生作用.本研究探讨海藻酸钠与聚乙烯醇包埋多菌灵降解菌的条件和降解特性,以期为包埋技术在农药降解的研究方面提供理论依据.
1 材料与方法
1.1 菌种与试剂
多菌灵降解菌株属产碱菌属(Alcaligenes sp.),由西北农林科技大学污染控制研究中心从长期使用多菌灵的土壤中富集分离获得.
多菌灵原药纯度为97.5%,海藻酸钠(SA)、聚乙烯醇(PVA)等试剂均为分析纯.
基础盐培养基(g/L):NaCl 1.0,NH4NO31.0,K2HPO41.5,KH2PO40.5,MgSO4·7H2O 0.1,FeSO4·7H2O 0.01,蒸馏水1000mL , pH值调至7.0左右.
LB 培养基(g/L):蛋白胨 10.0,酵母膏 5.0,NaCl 5.0 .
1.2 实验方法
1.2.1 SA包埋 在室温条件下,按表 1所设定的比例,将 SA于蒸馏水中加热至完全溶解,冷却后与培养 48h的多菌灵降解菌的菌液混合均匀.用注射器将混合液滴入 CaCl2溶液中形成均匀小球,交联一段时间后将固定化小球取出,用0.9%的NaCl溶液洗涤后保存备用.

表1 SA正交实验表Table 1 The orthogonal experiment table of SA
SA包埋条件的确定:以交联时间、SA和CaCl2浓度以及为因素,每个因素设 3个水平.以固定化小球对多菌灵的去除率为目标函数,采用L9(34)正交表进行正交实验,确定最佳包埋条件.其他条件为:多菌灵初始浓度 250mg/L,菌液接入量20%(V/V)、LB培养基与固定化小球的体积比为 10:1,基础盐培养基加入量 25%(V/V)、温度30℃,初始 pH6,摇床转速为 150r/min,活化时间48h,培养时间48h.
1.2.2 PVA包埋 在室温条件下,按表2所设定的比例,将PVA与SA按10∶1混合加热至完全溶解,冷却后与培养 48h多菌灵降解菌的菌液混合均匀.用注射器将其滴入 CaCl2的饱和硼酸溶液中成球,交联一定时间后将固定化小球取出,用0.9%的NaCl溶液洗涤保存备用.
PVA包埋条件确定:选定交联时间、PVA和CaCl2浓度为因素,并设3个水平.以固定化小球对多菌灵的去除率为目标函数,采用 L9(34)正交表进行正交实验,探讨最佳的包埋条件.其他条件为:PVA 浓度与SA浓度比例10∶1,多菌灵初始浓度、菌液接入量、基础盐培养基加入量等与
1.2.1 相同.

表2 PVA正交实验表Table 2 The orthogonal experiment table of PVA
1.2.3 包菌小球的物理性质测定 弹性系数的测定:选取3 颗形态完好、大小均匀的小球呈品字形置于载玻片上,并放上盖玻片.测量载玻片与盖玻片之间的高度H1,选取适当的砝码置于盖玻片上,测量固定化小球被压缩后的高度H2,据式(1)计算固定化小球的弹性系数.
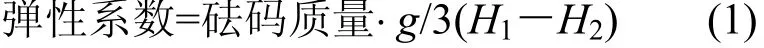
式中:g为重力常数,取值9.8N/kg.
包菌小球直径的测定:选取 5个大小均匀的包菌小球,用游标卡尺测其直径,计算平均直径.
传质性能的测定:选取50个小球于50mL红墨水中.放置24h后,于460nm分别测定加入包菌小球前后的红墨水吸光度,计算固定化小球吸附红墨水的百分比,判断传质性能的差异.
1.2.4 包埋小球降解能力的测定 降解菌的培养:从平板上挑取多菌灵降解菌的单菌落,接种于50mL LB培养基中,于30℃、120r/min培养48h作为包埋菌液.
包菌小球的活化:将包菌小球置于 LB培养基中,于30℃、120r/min活化48h.
包菌小球降解条件的研究:将包菌小球置于多菌灵 250mg/L的基础盐培养基中,于 30℃、120r/min培养.采用三波长校正光度法对小球的降解能力进行分析[8].
标准曲线的绘制:吸取多菌灵标准液 0,0.10,0.20,0.40,0.60,0.80,1.00mL,用 1cm 石英比色皿,以盐酸(HCl与H2O为1∶11)调节分光光度计零点,分别测定278、281和290nm波长的吸光度.根据ΔA = A281-(A278+ A290)/2计算校正吸光度ΔA ,再以ΔA为纵坐标,多菌灵的含量为横坐标,绘制标准曲线.
培养液中多菌灵的提取:取一定量的培养液,加 HCl酸化至 pH 1~2.用 CHCl3提取 2次,每次25mL,合并提取液,水洗1次,水洗液合并入水层,用于多菌灵测定.
1.2.5 包菌小球最适降解条件的研究 温度:将活化后的包菌小球,置于含多菌灵的基础盐培养基中,在20,25,30,35,40℃摇床培养后,于48h取样检测多菌灵含量.
pH 值:将活化后的包菌小球,置于含多菌灵的不同pH值(5.0,5.5,6.0,6.5,7.0,7.5,8.0)的基础盐培养基中,30℃、120r/min摇床培养,48h后取样检测多菌灵的含量.
接种量:按1:10,2:10,3:10的接种量接入活化后的包菌小球,于 30℃、120r/min摇床培养,48h后取样检测多菌灵含量.
农药初始浓度:将活化后的包菌小球置于含多菌灵50,100,150,200,250和300mg/L的基础盐培养基中,于30℃、120r/min 摇床培养,48h后取样检测多菌灵含量.
活化时间:包菌小球于 LB培养基中活化24,36,48,60,72h后,置于含多菌灵的基础盐培养基中,30℃、120r/min摇床培养,48h后取样检测多菌灵含量.
实验均以不接菌液为空白,以相同菌液含量的游离多菌灵降解菌培养液为对照,按散菌的接入体积计算出相应的包菌小球体积,每个处理重复3次.
2 结果与分析
2.1 SA包埋条件的确定
以交联时间、SA和CaCl2浓度为因素,正交实验结果见表3.
表3显示,在所选取的3个因素中,对降解效果影响最大的是交联时间,最小的是 CaCl2浓度.这是因为交联时间不足,SA与钙离子没有充分形成钙凝胶,导致包埋小球的强度不足,从而影响微生物的附着以及生长;交联时间过长,凝胶的强度过高,影响包埋小球的传质性能,也无法获得良好的去除效果[9].另外,SA 浓度越高,包埋后的小球传质性能越差,氧气以及反应底物的扩散阻力越大,固定化微生物反应活性受到抑制[10].结果表明,SA浓度2%时,多菌灵降解菌的降解效果最好(80.4%).因此,后续实验选取SA浓度2%,CaCl2浓度4%,交联24h.

表3 SA正交实验结果Table 3 The orthogonal experiment results of SA
2.2 PVA包埋条件的确定
选定交联时间、PVA和 CaCl2浓度为因素,正交实验得到的最佳包埋条件见表4.

表4 PVA正交实验结果Table 4 The orthogonal experiment results of PVA
从正交实验结果(表4)可以看出,3个因素中,对PVA包埋的降解效果影响大小依次是:交联时间> PVA 浓度> CaCl2浓度.交联时间越长,多菌灵的去除效果越差.PVA浓度对包埋效果的影响与海藻酸钠的影响相似:即浓度越高,包埋后的小球密度越高,传质性能越差,氧气以及反应底物的扩散阻力越大,固定化的微生物反应活性受到抑制[11].由于硼酸对微生物有毒性作用,包埋剂中的 SA作为多糖类天然高分子化合物,对微生物细胞有保护作用,因此提高了固定化细胞的相对活性[12].当PVA浓度为10%时,48h多菌灵的去除率达到76.3%,而游离微生物在同样条件下120h的降解率仅为70%[13].因此,确定PVA浓度10%、CaCl2浓度3%,交联24h为最适包埋条件.
2.3 包菌小球的物理性质
2.3.1 弹性系数 固定化小球的弹性系数直接表征小球的强度.当SA的浓度为2%,3%和4%时,弹性系数分别为9.85,11.23和13.81N/m;当PVA的浓度为 9%,10%和 11%时,弹性系数分别为14.82,16.50和18.60N/m.结果表明:同一包埋材料不同浓度的包菌小球弹性系数不同,包埋剂浓度越大,包菌小球的弹性系数越高.
2.3.2 传质性能 固定化小球对墨水中的红色物质有吸附作用.若红墨水的吸光度大,说明固定化小球吸收的红色物质少,传质性能较差,反之亦然.SA和PVA包埋小球的传质性能分别为27.2%和13.6%.
2.3.3 包菌小球直径 SA包埋小球与PVA包埋小球的平均直径分别为0.268cm和0.322cm.
2.4 包菌小球的最适降解条件
2.4.1 温度对包菌小球降解多菌灵的影响 随温度的升高,包菌小球对多菌灵的降解呈先升高后降低的变化(图1).30℃,SA和PVA包菌小球对多菌灵的降解效果最好,散菌、SA和 PVA包菌小球的多菌灵降解率分别为 63.6%,81.5%和73.3%.可以看出,通过SA和 PVA的包埋,多菌灵降解菌的降解效果高于未包埋的散菌.温度从20℃提高到 30℃,SA包菌小球对多菌灵的降解率较PVA包菌小球高约15%左右;继续升高温度,2种包菌小球的降解率均下降,尤以 SA包菌小球下降明显.这可能是由于 SA机械性能较差,温度升高,SA受热软化,内部的多菌灵降解菌受到外界温度的影响,致使活性降低.

图1 温度对包菌小球降解多菌灵的影响Fig.1 Temperature influence on carbendazim degradation rate of embedded bacteria
2.4.2 pH值对包菌小球降解多菌灵的影响图2显示,体系的pH值为5时,散菌、SA与PVA包菌小球的多菌灵降解率分别为20.0%,51.9%和56.8%.pH值为7时,散菌、SA与PVA包菌小球的多菌灵降解率分别为 40.3%,48.8%和 53.3%.研究结果表明,pH5.5~6.5范围,多菌灵降解菌的降解率较高;在pH6时,SA与PVA包菌小球的降解率为 76.8%和 78.9%,散菌的降解率为 52.5%.研究结果说明,经过SA和PVA的包埋,多菌灵降解菌的降解活性得到提高.

图2 pH值对包菌小球降解多菌灵的影响Fig.2 pH influence on carbendazim degradation rate of embedded bacteria
这是因为体系的pH<6时,H+浓度较高,H+可能会与某些营养物质结合,并能从这些物质或微生物细胞表面置换出某些阳离子,从而影响微生物细胞的结构稳定性和活性,导致包菌小球对多菌灵的去除率下降.当体系的 pH>7,OH-的浓度较高,会影响营养物质的溶解度、微生物细胞表面的电荷平衡和胶体性质,也可能导致固定化细胞活性的降低,从而影响包菌小球对多菌灵的去除率[14].
2.4.3 接种量对包菌小球降解多菌灵的影响图 3表明,SA包埋中降解菌的接种量为 1:10,2:10,3:10时,降解8h,去除率分别为41.2%,43.5%和 45.2%;降解时间延长到 48h,去除率分别达到72.3%,74.6%和68.5%.从图4可知,PVA包埋降解菌的接种量为1:10,2:10, 3:10时,降解8h,去除率分别为51.2%, 54.5%和55.6%;继续增加到48h,去除率分别为74.6%,77.2%和76.8%.从8h到24h,降解率提高了约 15%,此时体系中的反应底物、氧气和营养物质等逐渐渗透到包菌小球内部,微生物开始快速生长和大量繁殖.在24h~48h范围,体系中的反应底物、氧气和营养物质的渗透达到平衡,微生物之间、微生物细胞之间对营养物质的竞争,导致整体细胞活性的下降,到48h时降解达到平衡[15].
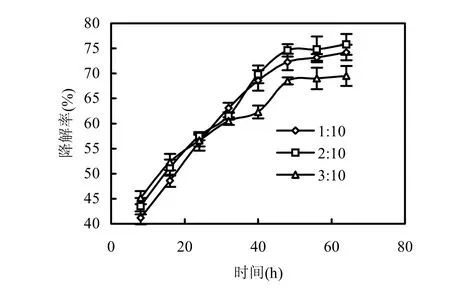
图3 接种量对SA小球降解多菌灵的影响Fig.3 Inoculumconcentration influence on carbendazim degradation rate of SA embedded bacteria
图3 、图4表明,48h以后,多菌灵降解菌对多菌灵的去除基本不变.SA包埋法的 3种接种量,多菌灵的去除率分别为 74.2%,75.8%和 69.5%.PVA包埋法的3种接种量,多菌灵的去除率分别为 75.5%,78.1%和 77.1%.因此,确定多菌灵去除率最高的2:10为最佳菌接种量.

图4 接种量对PVA小球降解多菌灵的影响Fig.4 Inoculumconcentration influence on carbendazim degradation rate of PVA embedded bacteria
2.4.4 多菌灵初始浓度对包菌小球降解多菌灵的影响 图 5显示,多菌灵浓度为 50mg/L时,多菌灵可完全降解.当多菌灵浓度为100mg/L时,游离菌对多菌灵的降解率为 91%,2种包菌小球的多菌灵降解率维持在 100%.这可能是因为整个降解环境采用无任何碳源的基础盐培养基,微生物以多菌灵为唯一碳源,因此可以将多菌灵完全降解.在多菌灵浓度为 300mg/L时,游离菌、SA和 PVA包菌小球对多菌灵的降解率分别为48.3%,56%和 60%.这可能是因为一种高浓度的碳源物质在代谢时,会抑制活性酶系统代谢其他类型的的碳源基质,或者抑制其他碳源代谢途径中的一种或者几种关键酶的合成[16].
2.4.5 活化时间对包菌小球降解多菌灵的影响 活化时间增加,包菌小球降解多菌灵的效果呈现升高-降低的变化(图 6).包菌小球的活化时间由 24h增加到 48h,多菌灵的去除率呈上升趋势.活化24h,SA和PVA去除率分别为71.8%和71.2%;活化时间增加到48h,SA和PVA降解率分别提高到 78.2%和 80.3%.研究结果说明:固定化后的多菌灵降解菌,在 24~48h之间,处于指数生长期.超过48h,由于微生物进入衰亡期,其降解效果大幅降低.因此,确定48h为最佳活化时间.

图5 初始浓度对包菌小球降解多菌灵的影响Fig.5 The initial concentration influence on carbendazim degradation rate of embedded bacteria

图6 活化时间对包菌小球降解多菌灵的影响Fig.6 The activation time influence on carbendazim degradation rate of embedded bacteria
3 结论
3.1 本实验条件下包埋的最适条件为:SA浓度2%、CaCl2浓度4%,交联24小时;PVA浓度10%、CaCl2浓度3%,交联24h.培养48h后多菌灵的降解率分别为80.4%和76.3%.
3.2 最适温度为30℃,SA与PVA包菌小球的多菌灵降解率为 81.5%和 73.3%,比游离菌分别提高了28.1%和15.3%.
3.3 反应体系的最佳pH值为6,SA与PVA包菌小球的多菌灵去除率为 76.8%和 78.9%,比游离菌分别提高了46.3%和50.3%.
3.4 接种量为 2:10时,多菌灵去除率最高,SA PVA包埋的多菌灵去除率分别为 75.8%和78.1%.
3.5 多菌灵浓度100mg/L时,游离菌的降解率为91%;SA与PVA包菌小球可以将其完全降解;增加多菌灵的浓度,降解能力降低.
3.6 在最佳的活化时间(48h),SA与PVA包菌小球的去除率分别为78.2%和80.3%.
[1] 许敬亮,王志春,王 堃,等.多菌灵降解菌株 djl-6-2的分离、鉴定及降解特性 [J]. 中国环境科学, 2006,26(3):307-310.
[2] 田连生,陈 菲.木霉对多菌灵的生物降解特性研究 [J]. 土壤学报, 2009,46(6):1127-1132.
[3] 王建龙.生物固定化技术与水污染控制 [M]. 北京:科学出版社,2002:15-18.
[4] 张建辉,孔 瑛,侯影飞,等.聚乙烯醇包埋石油脱硫菌UP-2的研究 [J]. 中国环境科学, 2006,26(suppl):92-96.
[5] 孙 凌,李 轶,胡洪营.活性炭固定耐冷菌对硝基苯的降解特性 [J]. 中国环境科学, 2009,29(9):941-945.
[6] Toshimitsu Onaka, Jin Konishi, Yoshitaka Ishii, et a1.Desulfurization characteristics of Thermophilic Paenibacius sp.strain all against asymmetrically alkylated dibenzothiophene [J].Journal Bioscience and Bioengineering, 2001,92(2):193-196.
[7] 裴海燕,胡文容,李 力,等.聚氧化乙烯作为固定化细胞包埋剂的研究 [J]. 山东工业大学学报, 2001,31(6):511-518.
[8] 于彦彬,苗在京,万述伟,等.三波长校正光度法测定水果蔬菜中多菌灵残留量 [J]. 理化检验-化学分析手册, 2005,41(5):353-357.
[9] 蒋宇红,黄 霞,俞毓馨.几种固定化细胞载体的比较 [J]. 环境科学, 1993,14(2):11-l5.
[10] 杨海波.小球藻藻固定化培养的初步研究 [J]. 水产科学,2001,20(5):2-7.
[11] 吴晓磊,刘建广,黄 霞,等.海藻酸钠和聚乙烯醇作为固定化微生物包埋剂的研究 [J]. 环境科学, 1993,14(2):28-31.
[12] 沈耀良,黄 勇,赵 丹.固定化微生物污水处理技术 [M]. 北京:化学工业出版社, 2002:45-67.
[13] 许炳云.多菌灵降解菌的筛选和降解研究 [D]. 杨凌:西北农林科技大学, 2009.
[14] 周 定,侯文华.固定化微生物处理含酚废水研究 [J]. 环境科学, 1990,11(1):1-6.
[15] 秦 力.固定化微球制备技术及相关性能研究 [D]. 重庆:重庆大学, 2006.
[16] 张锡辉.高等环境化学与微生物学原理及应用 [M]. 北京:化学工业出版社, 2000:153-156.
Study on embedding conditions and degradation characteristics of a carbendazim degrading bacteria.
DOU Jing-jing1, FENG Gui-ying2, HU Shi-bin2*, Li Lin3(1. College of Resources and Environment, Northwest Agriculture and Forestry University, Yangling 712100, China; 2. College of Science, Northwest Agriculture and Forestry University,Yangling 712100, China; 3. Water Resources and Hydropower Survey and Design Institute of the Third Engineering Bureau, Xi’an 710016, China). China Environmental Science, 2011,31(3):431~436
Embedding a carbendazim degrading bacteria with sodium alginate (SA) and polyvinyl alcohol (PVA), the optimal embedding conditions and the efficiency of degradation after embedding were studied. The optimal SA embedding condition is that the bacteria were mixed with 2% SA (1:5) and cross-link in 4% CaCl2for 24h at room temperature. The optimal PVA embedding condition is that the bacteria were mixed with 10% PVA (1:5) and cross-link in 3% CaCl2under the same condition. After 48h activation, at pH6and 30℃, the degradation rate of SA embedding carbendazim degrading bacteria can reach 80.4%, and the degradation rate of PVA embedding bacteria can reach 76.3%.Key words:carbendazim;degrading bacteria;optimization of embedded;degradation
X172
A
1000-6923(2011)03-0431-06
2010-07-26
中央环保专项资金(财建【200】号)
* 责任作者, 教授, hushibin2003@yahoo.com.cn
窦晶晶(1986-),女,河北邢台人,硕士研究生,主要从事环境微生物的研究.
